三维荧光法直接测定花生芽不同部位白藜芦醇的含量
杨 振 王雅洁 邢蓬蕊 张晓峥 杨志孝
( 泰山医学院,山东 泰安 271000)
白藜芦醇(resveratrol,Res)是一种多酚类化合物,化学名为芪三酚(3, 5,-trihydroxystilbene)。它是许多植物受到真菌感染、紫外线照射或病理状况下产生的一种植物抗毒素,在许多植物中都含有白藜芦醇,尤其是葡萄、花生、虎杖中含量比较丰富[1-2]。研究表明白藜芦醇不但具有抗血栓、抗突变、抗氧化、抗炎、提高人体免疫力等功效, 而且具有抑制肿瘤等效能[3-13]。台湾嘉义大学的邱义源教授最新研究证实,花生发芽后,其白藜芦醇含量迅速增加,化验分析表明,花生芽里的白藜芦醇含量是花生仁的 100 倍。这正是花生芽在美国、日本及台湾等地区被广泛追捧的原因之一。
目前在国内花生芽这一优质食物资源还没有被消费者所认识, 很多人认为花生芽可能会被黄曲霉毒素污染, 存在花生芽不可食用的误区, 实际上只要在培植过程中控制好温度、湿度及通风,就可完全避免花生芽的霉变及黄曲霉毒素的污染, 因此,人们可以放心食用。为更好的开发利用花生芽这一优质食物资源, 我们对花生芽进行了优化培植, 并采用三维荧光法对花生芽及花生芽的不同部位进行了白藜芦醇的含量测定。 花生芽除了含有丰富白藜芦醇以外,还含有多种生物酶、多种维生素等营养成分。另外花生在发芽的过程中脂肪以能量的形式被消耗,脂肪的含量大大降低;同时在发芽的过程中蛋白质被水解成低分子肽、氨基酸等,更有利于人体的吸收利用。花生芽是一种天然的优质食品,它含有丰富的白藜芦醇等生物活性物质,所以具有重要的保健功能[3-13]。因此,引导人们多食用花生芽这一优质天然食品,对于提高人群健康水平具有重要的意义。本实验的目的就是培植和分析花生芽不同部位白藜芦醇的分布情况,为进一步开发、合理利用花生芽这一优质的植物资源,提供重要的研究数据。实验过程如下:
1 实验方法
1.1实验材料
仪器设备: F-4500 fluorescence spectrophotometer (日本 日立公司)、GZX-400BSH-Ⅲ光照培养箱(上海新苗医疗器械制造有限公司)、BGZ-146鼓风干燥箱(上海博讯实业有限公司)、TG 332A-微量分析天平(0.01 mg /20 g, 上海分析天平厂)、k-30 高速冷冻离心机(sigma公司)。
试剂材料:白藜芦醇标准(Sigma 公司)、无水乙醇(GR.)、95%乙醇(GR.)、石油醚(AR.)、NaOH(AR.)、HCl(AR.)
1.2花生芽的培植
选择优质花生米,除去残次及霉变种粒,以35 ℃的水温浸泡12 h, 沥水后用湿布覆盖,以30 ℃温度,于培养箱中避光催芽,当花生萌芽后取出放入培养盘中,首先在培养盘放入2 cm厚度的洁净细沙喷水润湿,将萌芽的花生单层摆放,覆盖2 cm的洁净细沙,再覆盖湿布,放入光照培养箱中(闭光),以28 ℃温度进行培养,或自然坏境不条件培养,适当喷水保持湿度,当花生芽生长到10 cm时收集。
1.3白藜芦醇标准系列溶液的配制
用微量分析天平(10万分之一)准确称取标准白藜芦醇0.01000 g(10 mg),用95%的乙醇溶解转移至10 ml的容量瓶中定容,浓度为1 mg/mL (1000 μg/ml)。
取6只10 ml容量瓶(经过校正), 用杰尔森加样枪分别吸取标准白藜芦醇溶液0、10、20、40、60、80 μl于容量瓶中,然后分别加入95%的乙醇溶液定容10.0 ml, 白藜芦醇标准系列溶液的浓度为分别为0、1、2、4、6、8 μg/ml,同法配制标准空白一份。
1.4花生芽待测样品溶液的制备
将花生芽在鼓风干燥箱中,以75 ℃温度干燥24 h,冷却后首先挑选根、茎、瓣、叶齐全的花生芽,再将剩余花生芽的根、茎、瓣、叶分别收集, 用植物粉碎机分别打成细粉。 各称取花生芽0.1548 g、根0.1287 g、茎0.1260 g、瓣0.1216 g、叶0.1031 g 。分别放入50 ml的带塞三角瓶中,各加入12 ml石油醚,在超声提取器中控制温度50 ℃,超声提取30 min脱脂,倾出提取液后,自然干燥,再加95%乙醇溶液8.0 ml、8.0 ml进行二次超声提取,合并提取液,以3500r/min的速度离心8 min,将上清液转移至25ml的容量瓶中,用95%乙醇溶液定容,同法配制样品空白一份。
1.5标准白藜芦醇和样品溶液荧光活性的判定
利用F-4500荧光光度计,仪器参数设置如下:激发波长(λex)为200~800 nm, 读取间隔10 nm;发射波长(λem)为200~800 nm, 读取间隔10 nm。 激发和发射的狭缝宽度均为5 nm, 扫描速度为12000 nm.min-1,PMT电压为700V,响应时间为自动,扫描光谱进行仪器自动校正。分别对4 μg/ml白藜芦醇标准溶液、花生芽、根、茎、瓣、叶提取液,进行三维荧光图谱扫描,仪器自动绘制三维立体扫描图谱见图1~6。
1.6标准白藜芦醇测定波长的选择
按上述仪器条件,选择λex 270、280、290、300、310、320、330 nm为激发波长, 在发射波长λem200~800 nm波长范围进行二维平面图谱扫描,见图7。
1.7样品溶液测定波长的选择
选择激发波长λex260、270、280、290、300、310、320、330 nm;在发射波长λem200~800 nm范围内,对花生芽提取液进行图谱扫描,扫描图偶见图8。
1.8标准曲线绘制
从白藜芦醇标准溶液和样品溶液的荧光图谱分析, 激发波长为λex=300 nm时,白藜芦醇和样品均在在388 nm处有较强的荧光活性。 因此选择测定波长激发波长λex =300 nm和发射波长λem=388 nm。 分别对浓度为0、1、2、4、6、8 μg/ml的标准系列进行测定, 仪器自动绘制标准工作曲线见图9 。
1.9样品测定及回收率实验
按上述仪器条件和方法,对花生芽样品溶液平行测定5次,结果见表1。
以花生芽提取溶液作为实验溶液,分别吸取998mL花生芽提取液3份,分别加入浓度为(1000 μg/ml)标准白藜芦醇贮备液0.5、1.0、2.0 μl(既0.5、1.0、2.0 μg白藜芦醇), 再分别加入95%的乙醇 1.5、1.0、0 L补足1000 μl,然后进行测定,并计算回收。结果见表2。
按同样的仪器条件对花生芽、花生芽根、花生芽茎、花生芽瓣、花生芽叶溶液直接进行浓度测定,并计算花生芽及花生不同部位白藜芦醇的含量,结果见表3。
2 结果与分析
2.1白藜芦醇标准溶液及花生芽不同部位三维荧光图谱
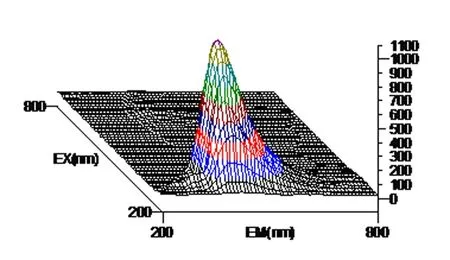
图1 白藜芦醇标准(4ug/mL)溶液三维荧光图谱
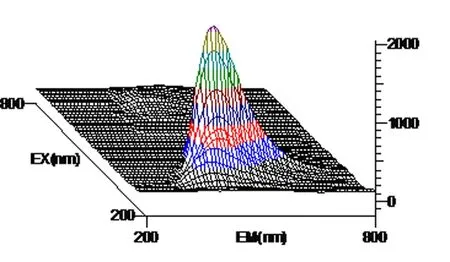
图2 花生芽提取液三维荧光图谱
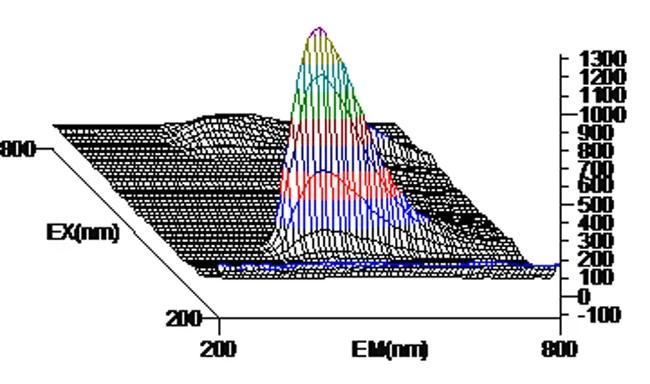
图3 花生芽根提取液三维荧光图谱
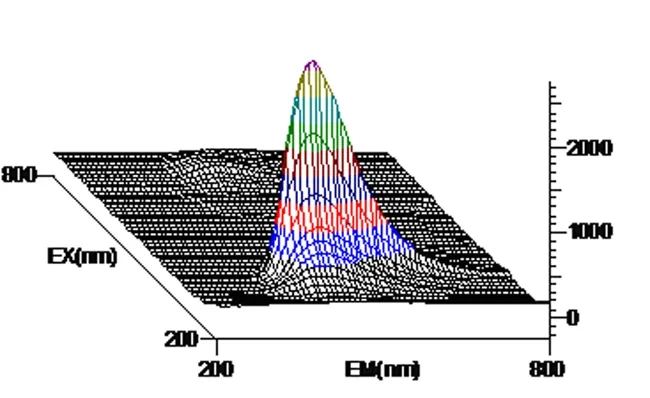
图4 花生芽茎提取液三维荧光图谱
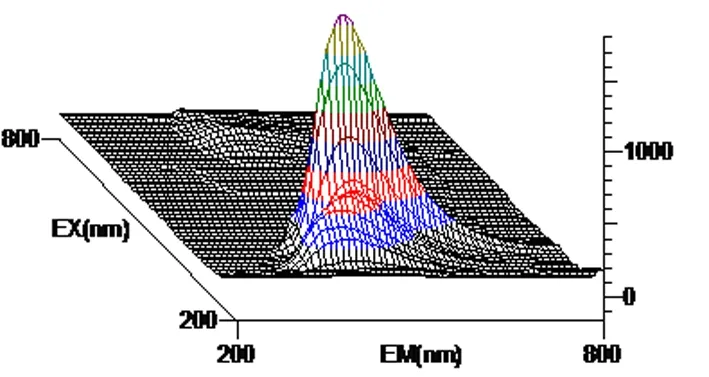
图5 花生芽瓣提取液三维荧光图谱

图6 花生芽子叶提取液三维荧光图谱
以激发波长(λex)为200~800 nm, 发射波长(λem)为200~800 nm范围, 白藜芦醇标准溶液、花生芽、根、茎、瓣、叶提取液所得到的三维荧光图谱显示, 均有较强的荧光活性,因此,花生芽中的白藜芦醇可以利用荧光光谱法进行测定。
2.2白藜芦醇的测定波长
1.λex=300 nm 2.λex=310 nm 3.λex=320 nm 4.λex=290 nm 5.λex=280 nm 6.λex=330nm 7.λex=270 nm
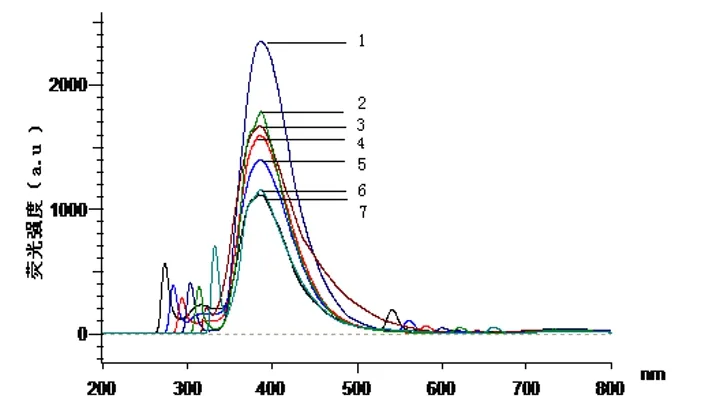
图7 不同激发波长时白藜芦醇产生的荧光光谱
从扫描图谱看,分别以激发波长λex270、280、290、300、310、320、330 nm激发, 均在λem388 nm处产生较强的发射光,所以λex270、280、290、300、310、320、330 nm波长都可以作为测定白藜芦醇的激发波长,但是其中以λex300激发时所产生的发射光强度最大。除此之外,在500~700 nm范围内还具有较弱的发射光谱,因强度太小已无法进行测定分析。
2.3样品测定波长选择情况
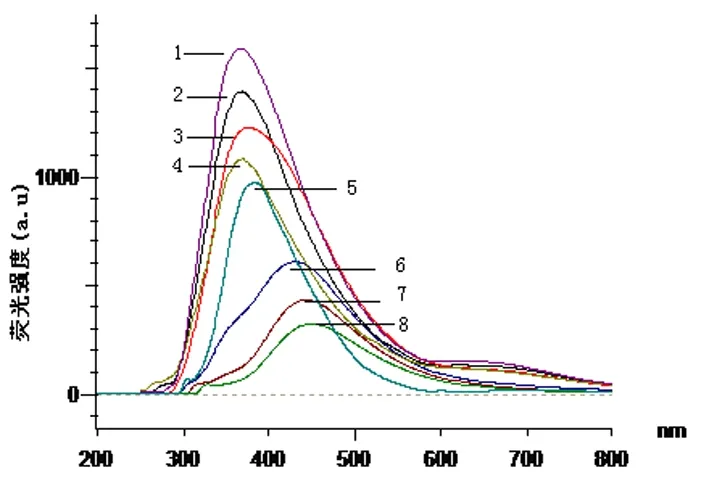
1.λex=280 nm;2.λex=270 nm;3.λex=290 nm;4.λex=260 nm;5.λex=300 nm;6.λex=310 nm;7.λex 320;8.λex=330 nm
图8 不同激发波长时花生芽的荧光光谱
由λex260、270、280、290、300、310、320、330nm为激发波长, 在λem200~800 nm范围,对花生芽提取液扫描图谱表明, 以λex260、270、280nm波长激发时,最大发射为λem368nm;以λex290nm激发时, 最大发射波长为λex378 nm; 以λex 300 nm波长激发时最大发射为λem388 nm;以λex 310 nm激发时最大发射为λem433 nm;以λex 320、330 nm波长激发时最大发射为λem444 nm。虽然λex260、270、280、290、300、310、320、330 nm波长分别激发时, 在λem200~800 nm范围波长激发时均能产生的较强的荧光,但是只有以激发波长300 nm激发花生芽提取液时,所产生的发射波长为388 nm,与标准白藜芦醇的最大发射波长一致,其他均不与标准白藜芦醇一致。 因此, 测定波长确定为激发波长 λex 300 nm; 发射波长λem388 nm。
2.4白藜芦醇标准工作曲线

图9 白藜芦醇标准工作曲线
由标准工作曲线可知,以激发波长λex=300 nm和发射波长λem=388 nm白藜芦醇含量在0~10 g/ml的浓度范围内具有良好的线性关系,R=0.9992, 完全满足定量分析的要求。
2.5样品白藜芦醇的含量及回收率实验结果

表1 花生芽中白藜芦醇含量
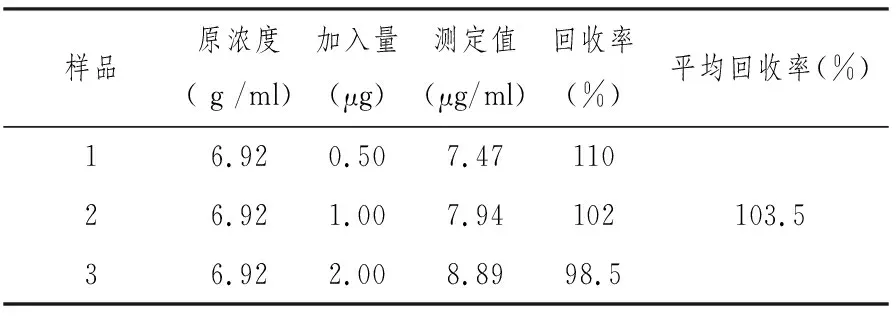
表2 花生芽溶液加标白藜芦醇回收率
回收率结果表明,按此条件测定花生芽中白藜芦醇的回收率在98.5%~110%,平均回收率为103.5%。
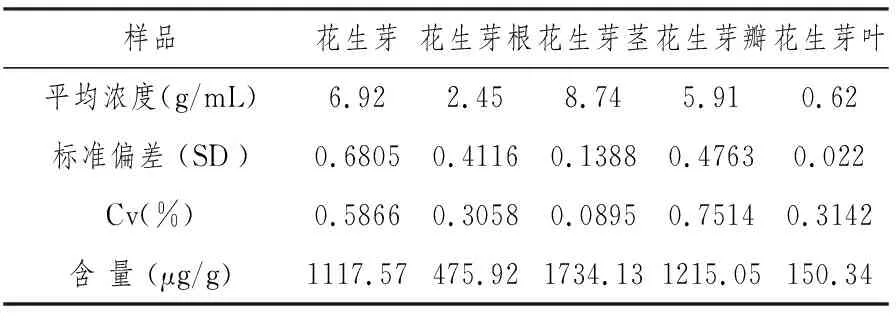
表3 花生芽不同部位白藜芦醇的含量
注: 平均浓度是5次读数平均值白藜芦醇的含量(μg /g):= Cx·V/m Cx测定浓度(g/ml); V样品体积(25mL); m样品质量(g)
3 结 论
从白藜芦醇标准溶液、花生芽、花生芽根、花生芽茎、花生芽瓣、花生芽叶提取溶液的三维荧光扫描图谱看,都具有显著的荧光活性。以λex=300 nm,λem在200~800 nm范围分别对标准白藜芦醇和花生芽溶液进行二维荧光扫描,标准白藜芦醇、花生芽、根、茎、瓣、叶的图谱形状一致, 符合定量分析的要求。 因此,可以利用激发波长λex=300nm和发射波长λem388 nm、狭缝5 nm、 PTV700的条件进行测定;白藜芦醇含量在0~10 μg/ml的浓度范围内具有良好的线性关系。 该方法较紫外光谱法光谱干扰小,选择性好;较高压液相色谱法等,更简便快速[14-20];因此可利用该方法直接进行花生芽、花生芽根、花生芽茎、花生芽瓣、花生芽叶中白藜芦醇的含量测定。经过测定花生芽中白藜芦醇的含量为1117.57 μg/g、花生芽根为475.92 μg/g、花生芽茎1734.13 μg/g、花生芽瓣为1215.05 μg/g、花生芽叶150.34 μg/g。实验结果表明在花生芽的不同部位白藜芦醇的含量明显不同,其中花生芽茎中的含量最高,达到1734.13 μg/g,其次是花生芽瓣1215.05 μg/g、花生芽叶中最低只有150.34 μg/g。 花生芽中白藜芦醇的含量高低除了与花生的品种有关以外,还与培植的温度、湿度、外界坏景条件等因素都有关。 在以后工作中将对花生芽的培植条件及提高花生芽白藜芦醇含量的技术方面的问题,作进一步的探讨研究。总之花生芽含有丰富的白藜芦醇、多种生物酶、多种维生素等营养成分,是一种优良的天然食品。可引导消费者可根据花生芽中白藜芦醇的分布情况合理食用;特别是在花生芽的根须中仍含有较多的白藜芦醇,所以在食用花生芽时,将花生芽的根同时食用不要废弃。
[1] 张初署,杨庆利,潘丽娟,等. 白藜芦醇的提取及分离纯化研究进展[J]. 食品工业科技,2008,29(8):289-291.
[2] Keskin N, Noyan T , Kunter B . Health from grape byresveratrol:Review[J]. Turkiye Klinikleri Tip Bilimleri Dergisi,2009,29(5):1273-1279.
[3] Neves A R, Lucio M, Lima J L C, et al. Resveratrol inmedicinal chemistry:A critical review of its pharmacokinetics,drug-delivery,and membrane interactions[J]. Current Medicinal Chemistry,2012,19(11):1663-1681.
[4] Smoliga J M, Baur J A, Hausenblas H A. Resveratrol andhealth - A comprehensive review of human clinical trials[J].Molecular Nutrition & Food Research,2011,55(8):1129-1141.
[5] 张效莉,吴景东。白藜芦醇抗衰老研究现状[J]. 辽宁中医药大学学报,2010,11(12):138-139.
[6] 韩晶晶, 刘炜, 毕玉平. 白藜芦醇的研究进展[J].生物工程学报, 2008, 24(11): 1851-1859.
[7] 季 华,综述,吴玉珍,等. 白藜芦醇的生理功能及其应用前景[J].中国现代医学杂志,2011,21(14):1625-1629.
[8] 毕海丹. 白藜芦醇保健医药专利研究进展[J].安徽农业科学,2011,39(2):795-796,801.
[9] 陈卫琼. 白藜芦醇抗肿瘤作用机制的研究进展[J].国际病理科学与临床杂志, 2008, 28(5): 403-407.
[10] 王琴飞, 李景明, 张如莲. 花生中白藜芦醇及其衍生物的研究进展[J].中国粮油学报, 2009, 24(10): 145-152.
[11] 张效莉,吴景东. 白藜芦醇抗衰老研究现状[J].辽宁中医药大学学报,2010, 12(11):138-139.
[12] 王建明,张良璞,周宏敏. 花生根茎白藜芦醇的开发研究[J].安徽农学通报, 2010, 16(7):34-36.
[13] 韩小丽,邵 鹏,李明静,等.薄层荧光扫描法测定花生茎中白藜芦醇的含量[J].天然产物研究与开发,2006,18(4):628-630.
[14] 吴向阳,王彩霞,笪祖林,等.HPLC法测定花生根茎叶中白藜芦醇的含量[J]. 食品科学,2009, 30(16): 240-242.
[15] 刘新荣,高丽萍,夏涛,等. 薄层层析-紫外分光光度法测定葡萄果皮中白藜芦醇及白藜芦醇苷[J].生物学杂志,2008,25(5):63-65.
[16] 叶秋雄,黄苇. 虎杖中白藜芦醇测定方法的比较研究[J]. 食品工业科技,2010,31(5):361-362.
[17] 顾秀英,鲍忠定,许荣年,等. 气相色谱法测定葡萄酒中的反式白藜芦醇[J]. 食品科技,2008,33(3):211-213,214.
[18] Du S X, Du Y F,Wu X L. Detection of dissolved organicmatter based on three - dimensional first - order derivativefluorescence spectrometry[J]. Spectroscopy And Spectral Analysis,2010,30(12):3268-3271.
[19] 盖云,1鲍成满,叶树明,等. 化学计量学方法在三维荧光光谱分析中的应用[J]. 光谱学与光谱分析,2011,31(7):1828-1833.

