脂肪酸通过固醇调节元件结合蛋白1诱导足细胞的损伤
仇丽茹,唐锦辉,周建华,Moshe Levi (.华中科技大学同济医学院附属同济医院儿科,湖北 武汉430030;.美国科罗拉多州大学医学院肾脏病研究中心,科罗拉多,奥罗拉80045,美国)
随着人们生活水平的改善,肥胖、胰岛素抵抗以及糖尿病的发生率呈上升状态。最近的研究显示中国肥胖人群位列世界第10位,而肥胖是2型糖尿病、胰岛素抵抗的重要原因[1]。糖尿病肾病随着肥胖和2型糖尿病发病率的提高已成为中国人群慢性肾脏病的重要原因[1]。2型糖尿病肾脏损伤由多因素所致[2-4],治疗手段包括控制血糖、血压,血管转化酶抑制剂等,但大多数患者仍然发展到肾脏损伤甚至终末期肾脏病[5-6],急需寻求阻止糖尿病肾损伤的更有效的治疗途径。
Moorhead[7]在1982年提出“在慢性进行性小球和小管间质疾病中的脂质肾毒性”,随后很多学者指出糖尿病肾损伤存在脂质代谢失调,脂质稳态失调导致肾脏毒性[8-9],目前肾脏脂质代谢失调已被认为是糖尿病肾病和肥胖肾病发病的重要原因[10]。
脂质沉积包括胆固醇、三酰甘油和脂肪酸,固醇调节元件结合蛋白(the sterol regulatory element binding proteins,SREBP)在脂质代谢中发挥重要的促进作用。SREBP转基因小鼠肾脏有明显脂质沉积、炎症反应增加、系膜区扩张和尿蛋白明显增加[11]。SREBP对足细胞的作用和其在糖尿病肾病、肥胖肾病中的作用机制仍不清楚,本研究利用体外培养人足细胞,研究SREBP在游离脂肪酸足细胞损伤模型中足细胞损伤中的作用,寻找糖尿病肾病和肥胖性肾病新的治疗靶标。
1 材料与方法
1.1 材料 CARS(相干反斯托克斯拉曼散射,Coherent Anti-Stokes Raman Scattering)显微镜成像技术:奥林巴斯Olympus FV1000 FCS/RICS成像系统。SREBP1抗体购自Santa Cruz Biotechnology,TLR4抗体购自R&D公司。人足细胞由Dr.Jeffrey Kopp馈赠,Dr.Moshe Levi转赠。
1.2 人足细胞 将人足细胞培养于含10%胎牛血清、1%ITS、100 U·mL-1青霉素、100μg·mL-1链霉素的RPMI 1640培养基中,使用100μg·mL-1的I型胶原预铺被的6孔板、10 cm培养皿培养。首先将足细胞置于33℃培养箱,然后置于37℃培养箱10 d等待细胞分化。实验前分化的足细胞使用1%血清同步化24 h。CARS检测使用3.5 cm玻璃底培养皿,接种2.5×104个细胞。分组如下:(1)对照组:无游离脂肪酸的等量BSA处理组;(2)FFA组:游离脂肪酸250μm处理组。试验重复3次。
1.3 质粒转染 SREBP1c质粒购自Addgene,使用QIAGEN公司Effectene®转染试剂进行转染,按照使用手册进行。
1.4 游离脂肪酸(FFA)准备 参考文献报道[12]100 mmol·L-1的Palmitic acid加入5 mol·L-1的NaOH蒸发后与1*PBS混合,60℃水浴10 min,与24%BSA以体积比1∶1混匀即500 mmol·L-1FFA,0.45μm 过滤消毒,-20℃保存。使用前37℃加热10 min后加入培养基。
1.5 足细胞凋亡检测 使用Caspase3/7 Assay Kit(AAT Bioquest)按照用户手册进行检测。
1.6 足细胞核蛋白抽提 使用Active Motif公司核蛋白提取试剂盒,按照说明书进行。
1.7 足细胞总的RNA抽提 使用ZYMO RESEARCH 公 司 的 Quick-RNATM MiniPrep columns,取200 ng总RNA使用QIAGEN公司的Omniscript Reverse Transcriptase Kit进行逆转录反应。使用QIAGEN公司的Quantitect SYBR Green PCR试剂盒合成cDNA,实时定量PCR使用Applied Biosystems公司的StepOne Plus Real-Time PCR System进行。引物见表1。

表1 RT-PCR引物Tab 1 RT-PCR primers
1.8 统计分析 结果使用±s表示。数据多重比较使用 ANOVA和Student-Newman-Keuls检验,2组间非配对比较使用Student'st检验。P<0.05提示差异有显著性。
2 结果
2.1 FFA诱导足细胞凋亡 分化成熟足细胞同步化后,使用250μm FFA处理足细胞,提取足细胞总蛋白使用ELISA方法检测活化Caspase3/7活性,250 μm FFA作用于成熟人足细胞24 h可见活化Caspase3/7升高,提示FFA诱导足细胞凋亡(图1)。

图1 足细胞活化的Caspase 3/7在FFA处理后24 h升高Fig 1 Cleaved Caspase3/7 of podocytes increased after FFA24 h treatment
2.2 FFA上调足细胞的SREBP1 65 kD部分的蛋白表达 足细胞培养于10 cm培养皿,250μm FFA加入足细胞培养基后置于37℃培养箱培养48 h,收集足细胞总蛋白提取核蛋白后进行 Western-Blot检测,活化的SREBP1蛋白65 kD部分明显增加(图2)。
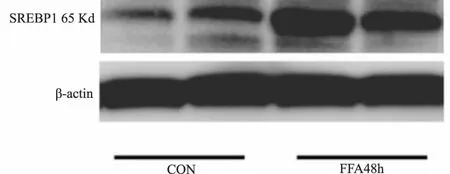
图2 FFA刺激足细胞SREBP1蛋白65 kD部分表达上调Fig 2 Activated part of SREBP1(65 kD)increased by the FFA treatment
2.3 FFA促进足细胞脂质聚集 250μm FFA处理足细胞后,使用奥林巴斯显微镜进行CARS脂滴检测,FFA处理足细胞48 h后可见明显脂滴聚集在细胞内(图3)。Oil Red O脂滴染色同样发现足细胞内中性脂明显增加(图4)。

图3 CARS成像显示FFA促进足细胞中性脂合成Fig 3 Podocytes lipids increased after the FFA treatment

图4 脂肪染色Oil Red O显示FFA促进足细胞脂质沉积Fig 4 Oil Red O showed the deposition of lipids in podocytes induced by the FFA
2.4 FFA上调 TLR2/TLR4的 mRNA和 TLR4蛋白表达 炎性因子IL-6mRNA表达增加足细胞培养于6孔板37℃培养10 d分化成熟后加入250 μm FFA处理24 h提取总RNA进行实时定量PCR检测,FFA组TLR2、TLR4和促炎因子IL-6的mRNA水平明显高于对照组(图5~图7)。250 μm FFA处理足细胞48 h,提取总蛋白进行 Western-Blot检测即发现TLR4蛋白表达明显高于对照组(图8)。

图5 FFA上调足细胞TLR2的mRNA表达Fig 5 FFA increased TLR2 mRNA

图6 FFA上调足细胞TLR4的mRNA表达Fig 6 FFA increased TLR4 mRNA

图7 FFA上调足细胞IL-6的mRNA表达Fig 7 FFA increased IL-6 mRNA

图8 FFA上调足细胞TLR4蛋白表达Fig 8 FFA increased TLR4 Protein
2.5 SREBP1c的基因转染增加足细胞脂质合成上调足细胞TLR4蛋白、IL-6mRNA表达 脂质体转染SREBP1c进入分化后的足细胞,SREBP1c的mRNA表达上调(图9),蛋白表达增加。检测转染后的足细胞,CARS成像显示转染组脂滴明显多于未转染组(图10)。提示SREBP1c的高表达促进足细胞内脂质合成,转染组TLR4的蛋白表达显著高于未转染组(图11),促炎因子IL-6的 mRNA的表达上调(图12),提示SREBP1C的高表达增加足细胞的脂质合成,而增高的脂质导致足细胞炎性因子活化。
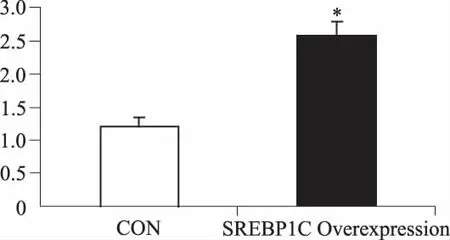
图9 SREBP1c转染足细胞Fig 9 Podocytes transfected by the SREBP1C

图10 CRAS成像显示SREBP1c的转染促进足细胞脂质合成Fig 10 CARS imaging showed SREBP1C transfection increased the lipid deposition of podocytes

图11 SREBP1c转染上调TLR4的蛋白表达Fig 11 TLR4 protein increased by SREBP1c transfection

图12 SREBP1c转染上调IL-6mRNA的表达Fig 12 IL-6 mRNAincreased by SREBP1c transfection
3 讨论
固醇调节元件结合蛋白(SREBP)信号传导途径是脂代谢信号传导主要途径之一,SREBP属于转录因子的基础螺旋-环-螺旋亮氨酸拉链家族(the basic-helix-loop-helix-leucine zipper (bHLHZip)),可直接激活30多个参与脂肪酸、三酰甘油和磷酸脂合成与摄取的基因表达。SREBP有3种亚型,分别为 SREBP1c、SREBP1α 以及 SREBP2。SREBP的前体是处于失活状态的120 kD的蛋白,其C端和SREBP裂解活化蛋白(SCAP)相连,通过胰岛素诱导基因(Insig)与内质网膜结合,抑制SREBP的活性。当细胞内胆固醇水平降低时,SCAP与Insig分离,从内质网膜将SREBP转运到高尔基体。在高尔基体被位点1蛋白酶(site-1 protease,S1P)和位点2蛋白酶(site-2 protease,S2P)分解,N端即为活性部分,相对分子质量为65 kD,活化的SREBP转位入核,与靶基因固醇调节原件(SRE)结合发挥促进脂质合成的作用[13]。
在对肾脏固有细胞的研究中发现高糖可以诱导系膜细胞[14]和肾脏近端肾小管细胞活化的SREBP1表达上调[15],上调的SREBP1促进系膜细胞TGF-β1表达增加,而TGF-β1的表达增加是糖尿病肾病发病的重要机制之一,提示SREBP1的活化在糖尿病肾脏损伤发挥了重要的作用。糖尿病肾脏病变时,足细胞被破坏导致凋亡丢失,是糖尿病肾损伤的重要表现[5],那么足细胞损伤过程是否存在脂质代谢失衡,作为调节脂代谢的重要转录因子SREBP1是否在足细胞损伤中是否发挥作用呢?
本试验即利用FFA足细胞损伤模型模拟2型糖尿病和肥胖肾病微环境,研究脂质代谢失衡在2型糖尿病和肥胖肾病足细胞损伤中的作用以及作为脂质代谢中重要转录因子的SREBP在足细胞损伤中的作用。
实验显示肾脏足细胞有SREBP1的表达。250 μm FFA作用于分化成熟的足细胞后24 h检测活化的Caspase3/7,FFA 处理组 Caspase3/7明显升高,诱导足细胞凋亡。有研究显示FFA可以通过诱导培养足细胞内质网应激导致足细胞凋亡[16],那么SREBP1是否在FFA诱导足细胞损伤凋亡过程中发挥作用呢?
我们检测FFA处理足细胞组活化的SREBP1的表达情况。由于SREBP1在高尔基体S1P和S2P的作用下,N端活性部分转位入核后与SRE结合发挥促进脂质合成作用,其活性部分位于核内。故我们抽提足细胞核蛋白检测有活性的SREBP1部分(nSREBP1),Western-Blot 显 示 FFA 处 理 组nSREBP1的表达明显升高。nSREBP1的表达与脂质合成密切相关,我们继而检测足细胞FFA处理后脂质沉积情况,CARS成像显示足细胞在FFA处理后细胞内脂滴明显增加,提示FFA处理足细胞后随着nSREBP1表达的提高,足细胞脂质聚集明显增加。
研究显示[17]脂质的代谢失衡和不适当的沉积会诱导固有细胞和免疫细胞分泌大量的炎性因子促进炎症通路活化,加重脏器的病理改变。高脂血症可以活化 Toll样受体(toll-like receptor,TLR)启动胞内信号最终激活核因子-Κb(NF-Κb),诱导单核/巨噬细胞产生炎症因子、趋化因子、共刺激因子、粘附因子等促进炎症反应的发生[18]。
足细胞表达多种TLR[19],我们继而检查是否增加的脂质沉积导致足细胞TLR的表达上调促进炎症发生。足细胞在FFA刺激后,TLR2和TLR4的mRNA水平明显升高,TLR4的蛋白表达明显升高。检测TLR下游的炎性细胞因子IL-6的mRNA,FFA处理组明显高于对照组。提示FFA作用于足细胞通过TLR2和TLR4的活化促进IL-6表达增加。
FFA作用下nSREBP1表达上调和FFA促进炎性因子分泌是否存在相关性?SREBP1在促进足细胞炎症反应中是否发挥作用呢?我们使用脂质体转染足细胞,提高SREBP1c在足细胞的表达。成功转染SREBP1c的足细胞脂质沉积明显高于对照空白转染组,而且检测其TLR4的蛋白表达明显高于对照组,IL-6的mRNA表达也显著高于对照组。提示SREBP1c高表达在足细胞产生类似FFA处理足细胞后的表现,足细胞脂质沉积明显增加,而且出现TLR4蛋白表达的上调,促炎症的细胞因子IL-6mRNA表达增加。故而得出结论,FFA损伤足细胞是通过增加活化SREBP1,增加TLR2/TLR4表达,促进炎性细胞因子分泌,从而在糖尿病肾病发病过程中起着重要的作用。
白桦脂醇(Betulin,lup-20(29)-ene-3β,28-diol)是从桦树皮提取出来的自然界大量存在的五环三萜,可以特异性诱导SCAP和Insig相互连接,减少SREBP向高尔基体的转位,减少活化的SREBP与核内SRE的相互作用,因而可以促进脂质的合成[20]。目前在对动脉粥样硬化[20]、药物性肝损伤[21]以及肿瘤[22]中的研究发现,白桦脂醇可以缓解上述病变的发生。
研究证实FFA作用于足细胞,促进足细胞脂质合成,过多的脂质沉积导致TLR2/TLR4活化,促进炎症反应的发生;在这一过程中SREBP发挥重要作用,为下一步利用白桦脂醇治疗糖尿病肾病、肥胖性肾损伤提供一个新的靶点和策略。
[1]Yang W,Lu J,Weng J,etal.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,25:362(12):1090-101.
[2]Bobulescu IA.Renal lipid metabolism and lipotoxicity[J].Curr Opin Nephrol Hypertens,2010,19:393-402.
[3]Forbes JM,Coughlan MT,Cooper ME.Oxidative stress as a major culprit in kidney disease in diabetes[J].Diabetes,2010,57,1146-1454.
[4]Hunley TE,Ma LJ,Kon V.Scope and mechanisms of obesity-related renal disease[J].Curr Opin Nephrol Hypertens,2010,19:227-34.
[5]de Boer IH,Rue TC,Hall YN,etal.Temporal trends in the prevalence of diabetic kidney disease in the United States[J].JAMA,2011,305:2532-2539.
[6]Rosolowsky ET,Skupien J,Smiles AM,etal.Risk for ESRD in type I diabetes remains high despite renoprotection[J].J Am Soc Nephrol,2011,22:545-553.
[7]Moorhead JF,Chan MK,El-Nahas M,etal.Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease[J].Lancet,1982,2(8311):1309-11.
[8]Wang XX,Jiang T,Shen Y,etal.Diabetic nephropathy is accelerated by farnesoid X receptor deficiency and inhibited by farnesoid X receptor activation in a type 1 diabetes model[J].Diabetes,2010,59(11):2916-27.
[9]Wang XX,Jiang T,Shen Y,etal.Vitamin D receptor agonist doxercalciferol modulates dietary fat-induced renal disease and renal lipid metabolism[J].Am J Physiol Renal Physiol,2011,300(3):F801-810.
[10]Gyebi L,Soltani Z,Reisin E.Lipid nephrotoxicity:new concept for an old disease[J].Curr Hypertens Rep,2012,14(2):177-81.
[11]Sun L,Halaihel N,Zhang W,etal.Role of sterol regulatory element-binding protein 1 in regulation of renal lipid metabolism and glomerulosclerosis in diabetes mellitus[J].J Biol Chem,2002,277(21):18919-27.
[12]Folch J M,Lees M,Stanley GHS.A simple method for the isolation and purification of total lipids from animal tissues[J].J Biol Chem,1957,226:497-509.
[13]Bengoechea-Alonso MT,Ericsson J.SREBP in signal transduction:cholesterol metabolism and beyond[J].Curr Opin Cell Biol,2007,19:215-222.
[14]Uttarwar L,Gao B,Ingram AJ,etal.SREBP-1 activation by glucose mediates TGF-βupregulation in mesangial cells[J].Am J Physiol Renal Physiol,2012,302(3):F329-41.
[15]Hao J,Zhu L,Zhao S,etal.PTEN ameliorates high glucoseinduced lipid deposits through regulating SREBP-1/FASN/ACC pathway in renal proximal tubular cells[J].Exp Cell Res,2011,317(11):1629-39.
[16]Sieber J,Lindenmeyer MT,Kampe K,etal.Regulation of podocyte survival and endoplasmic reticulum stress by fatty acids[J].Am J Physiol Renal Physiol,2010,299(4):F821-9.
[17]Maeve A,McArdle,Orla M,etal.Mechanisms of obesity-induced inflammation and insulin resistance:insights into the emerging role of nutritional strategies[J].Front Endocrinol(Lausanne),2013,10(4):52.
[18]Chen S,Lin G,Lei L,etal.Hyperlipidemia Modifies Innate Immune Responses to Lipopolysaccharide via the TLR-NF-κB Signaling Pathway[J].Inflammation,2013,36(4):968-976.
[19]Srivastava T,Sharma M,Yew KH,etal.LPS and PAN-induced podocyte injury in aninvitromodel of minimal change disease:changes in TLR profile[J].J Cell Commun Signal,2013,7(1):49-60.
[20]Tang JJ,Li JG,Qi W,etal.Inhibition of SREBP by a small molecule,betulin,improves hyperlipidemia and insulin resistance and reduces atherosclerotic plaques[J].Cell Metab,2011,13(1):44-56.
[21]Dehelean CA,Feflea S,Molnár J,etal.Betulin as an antitumor agent testedinvitroon A431,HeLa and MCF7,and as an angiogenic inhibitorinvivoin the CAM assay[J].Nat Prod Commun,2012,7(8):981-5.
[22]Zhukova NA,Semenov DE,BessergenevaEP,etal.Correction of drug-induced hepatotoxicity with new triterpene derivatives in transplanted RLS lymphoma[J].Bull ExpBiol Med,2013,154(3):370-374.

