腹腔镜下脾切除联合选择性贲门周围血管离断术
武步强 秦 君 栗彦琪 杨洁泉 何招才 晏 文 李韶霞 陈广斌
(山西省长治医学院附属和平医院普外科,长治 046000)
在我国,贲门周围血管断流术仍然是治疗门静脉高压症(portal hypertension,PHT)合并上消化道出血和脾功能亢进的常用术式。腹腔镜脾切除术(laparoscopic splenectomy,LS)是治疗血液病脾、脾肿瘤等的首选方法,但用于治疗PHT尚未达成共识[1~3]。究其原因,一方面与 PHT脾多巨大,质地更脆,常导致腹腔镜下视野更窄,手术操作空间更小,一旦触碰脾脏后更易破裂出血,使手术操作难度加大;另一方面,PHT患者存在的脾周围曲张脆弱的血管使正常的解剖关系变得复杂且难以辨认,一旦破裂出血则很难控制,常被迫中转开腹手术。因而,采用腹腔镜手术作为治疗PHT的手段需要进一步加以总结和完善。目前,尽管存在多种断流术式,但贲门周围血管离断术更为大多外科医生尤其是基层外科医生所采用。杨镇[4]倡导的脾切除联合选择性贲门周围血管离断手术因其易操作、断流精准且兼具分流和断流术的优点而逐渐为大多外科医生所接受并采用。近年来,采用腔镜技术进行断流手术逐渐增多[2,3,5],且预后在某些方面优于开腹手术。我们2011年3月~2012年3月连续为15例PHT实施腹腔镜下脾切除联合选择性贲门周围血管离断术(laparoscopic splenectomy combined with selective pericardial devascularization,LSPD),均获成功,现报道如下。
1 临床资料与方法
1.1 一般资料
本组15例,男6例,女9例。年龄35~58岁,中位数40岁。术前发生消化道大出血10例,2例严重全血细胞减少且内科治疗无效,3例脾脏极度肿大影响日常生活。有腹水4例。实验室检查:红细胞(2.07~5.22)×1012/L,平均3.73 ×1012/L;血红蛋白 61.80~163.50 g/L,平均 107.43 g/L;白细胞(1.20~8.90)×109/L,平均 3.76 ×109/L;血小板(30.0~289.0)×109/L,平均71.64 ×109/L。CT或胃镜检查提示食管静脉曲张中度2例,重度13例。均行上腹部B超、增强CT检查,均为中重度脾肿大,长径15~35 cm,中位数22 cm。合并胆囊结石1例。均为乙型肝炎后肝硬化,术前肝功能Child B级11例,C级4例。1例术前曾行食管静脉套扎,1例胃底组织胶注射。临床诊断均为肝硬化门脉高压症并食管胃底静脉曲张及脾功能亢进。
病例选择标准:①PHT合并上消化道出血;②PHT合并脾功能亢进,且内科治疗无效或病情继续恶化;③PHT性巨脾影响日常生活工作;④胃镜检查提示食管静脉曲张呈“红色征”;⑤无严重的心、肺、脑疾病,可耐受气腹手术。
1.2 方法
1.2.1 术前准备目标 术前末梢血象的参考目标:血红蛋白>70 g/L,白细胞 >2.5×109/L,血小板 >30.0×109/L。尽可能纠正肝功能为Child B级或A级,凝血功能改善。本组术前3例Child C级纠正到B级。具体措施:护肝治疗,应用利尿剂以消除腹水,输注白蛋白纠正低白蛋白血症,严重贫血和血小板减少者适当输注红细胞、血小板或新鲜全血,应用维生素K制剂纠正凝血功能障碍。术前常规上腹部增强CT检查以评估脾脏的大小、位置以及脾周和贲门周围血管的曲张情况。
1.2.2 手术方法 气管内插管全麻,脾区垫枕。常规深静脉穿刺置管。气腹压力12~14 mm Hg(1 mm Hg=0.133 kPa)。右斜位,右倾 45°~60°,头侧抬高约30°。术者立于患者右侧。于脐下方置10 mm trocar为观察孔,左侧肋缘下腋前线处置12 mm trocar作为主操作孔,剑突下2 cm略偏左、右上腹和左锁中线肋缘下2 cm置3枚5 mm trocar。主操作孔和右上腹trocar可根据脾脏大小进行相应的上下、内外调整。
进镜探查腹腔后将胃体向右后牵拉,托起脾脏下极,用超声刀切断脾下极血管和韧带,所遇曲张增粗的血管分离后用血管夹夹闭后切断或切割闭合器离断(图1,2)。切断脾结肠韧带,尽可能向上、向后分离切割脾肾、脾膈韧带(图3)。切开胃脾韧带显露小网膜囊,仔细切开小网膜囊后方近脾门处腹膜,直至脾门前方和上方组织完全离断,脾蒂充分松弛(图4)。经主操作孔trocar用线型切割器离断脾蒂(图5,6)。托起脾脏,进一步向上切断高位胃短韧带和脾膈韧带,完全切下脾脏(图7)。将脾脏装入塑料收集袋,暂不取出。脾脏巨大时可切开脾门,吸引器持续吸尽脾内积血以减少脾脏体积。
随后行选择性贲门周围血管离断术,左锁中线肋缘下穿刺孔为主操作孔。借助于其他穿刺孔内器械的牵拉挑拨作用,用超声刀贴近胃壁分离切割胃底和胃后壁的血管至贲门处食管下端。提起胃小弯区网膜,从胃角处开始贴近胃壁分前后两层向近端分离切割胃冠状血管向胃壁发出的曲张血管。注意胃左静脉不予切断。向上分离切断食管旁静脉向食管发出的穿支静脉和食管周围静脉,向下牵引食管,进一步游离食管下段约6~10 cm(图8)。扩大上腹部或肋缘下穿刺孔约3~5 cm取出脾脏组织(图9)。腹腔镜下仔细检查有无渗血,3000~5000 ml温盐水冲洗腹腔。于脾窝置入引流管,从左肋下穿刺孔引出。
2 结果
15例均顺利完成手术,无中转开腹。术中发现存在副脾2例,同时切除。1例因胆囊结石同时实施胆囊切除术。手术时间150~340 min,中位数230 min。术中出血量80~1600 ml,中位数450 ml,无手术并发症。术后排气时间60~84 h。术后第1天下床活动,第2天进流质饮食。术后3天复查血红细胞(2.29~5.04)×1012/L,平均 3.55 ×1012/L,血红蛋白72.00~154.90 g/L,平均 101.88 g/L,白细胞(6.00~12.40)×109/L,平均 8.66 ×109/L,血小板(105.00~1547.00)×109/L,平均 455.07 ×109/L。8例术后中等程度发热(37.5~38.5℃),对症治疗后缓解。无胰漏、胃漏、脾窝积液和脓肿、切口感染、肺部感染等并发症。腹腔引流管留置时间3~8 d,中位数5 d。术后住院时间7~15 d,中位数10 d。
术后15例由信息科进行电话随访,随访时间3个月~1年。15例均存活。2例发生便血,经保守治疗后病情稳定。
3 讨论
3.1 腹腔镜下脾切除联合选择性贲门周围血管离断术的可行性及安全性
伴随腔镜设备性能的改善和手术技术的提高,既往认为LS的禁忌证或相对禁忌证,有些已可采用腹腔镜技术完成。结合我们的经验,我们认为,对PHT患者,尽管门奇静脉的交通支迂曲扩张,但邻近食管下段和贲门周围的穿支静脉仍相对较细,并且在腔镜的视野放大作用下,利用超声刀等器械可以很精准地完成食管下段贲门周围穿支血管的离断。本组连续15例LSPD手术均由同一手术团队实施,住院期间未发生严重的并发症和死亡病例,且随访3个月~1年均存活。因此,我们认为,只要无上腹部手术和外伤史,无严重的心、肺、脑疾病,无严重肝功能不全(Child C级)和难以纠正的凝血功能障碍,均可选择LSPD。明显的脾周围炎及脾周围粘连和食管胃底周围血管显著迂曲扩张则为手术的相对禁忌证。应当强调,手术团队成员最好相对固定。术者的腔镜操作技术和临床经验至关重要,即使被认为是禁忌证的病例也可能随着术者技术的提高和经验积累使手术变得容易进行。助手应能够紧随术者的思路和习惯,优秀的助手能够及时提供合理的意见和帮助,当发生一些意想不到的情况如突然出血时,助手能够迅捷提供恰当的牵拉暴露和合适的器械协助术者加以处理。
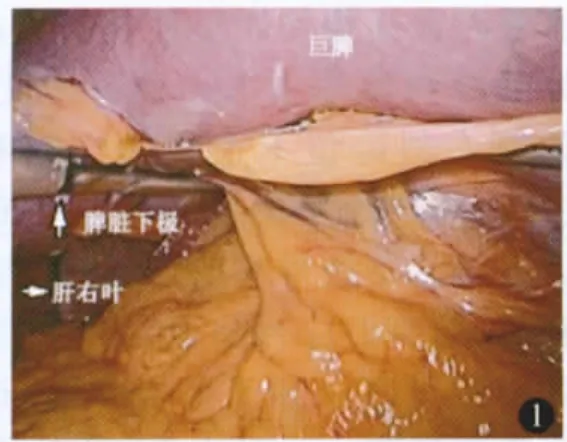
图1 游离延伸至右下腹部的脾脏下极
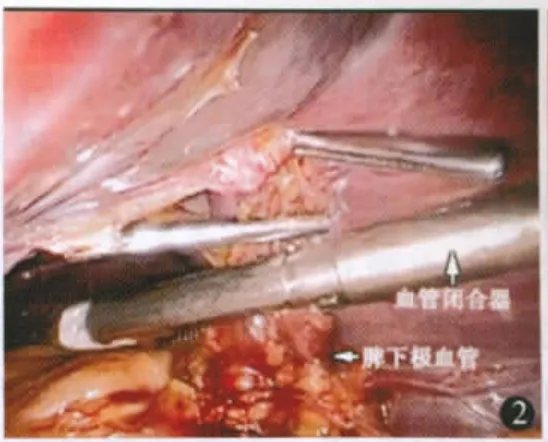
图2 血管闭合器离断脾下极血管
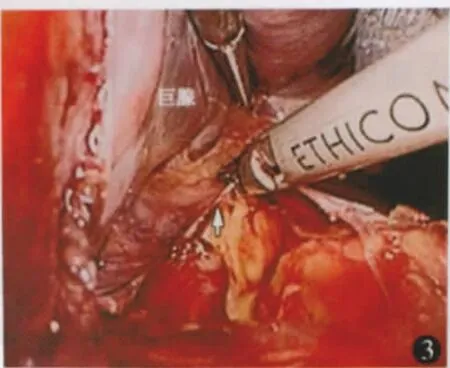
图3 游离切开巨脾侧后上方韧带
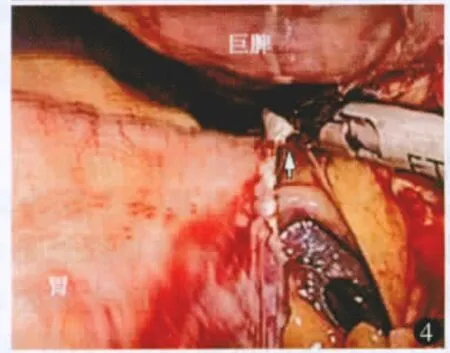
图4 离断脾胃韧带

图5 近脾门处脾被膜下血管呈蟹爪状迂曲扩张

图6 贴近脾脏离断脾门处血管

图7 游离脾胃韧带上极

图9 术后脾脏标本

图8 食管下端贲门周围血管离断
3.2 术前准备
充分的术前准备是顺利完成LSPD的先决条件。本组15例PHT均存在不同程度的全血细胞减少。我们制定了术前末梢血象的参考目标:血红蛋白 >70 g/L,白细胞 >2.5 ×109/L,血小板 >30.0 ×109/L。另外,术前采取各种措施尽可能使肝功能达到Child B级或以上,并同时积极纠正凝血功能不全。由于曲张血管是影响手术的重要因素,我们术前常规做上腹部增强CT检查,这不仅能够帮助我们评估脾脏的大小、位置,还有助于识别脾周和贲门周围血管的曲张情况,对评估手术风险和提示手术操作过程中重点注意的部位和环节有重要价值。
3.3 安全实施LSPD的技术体会
空间狭小和术中出血是影响LSPD安全实施的关键问题。显然,缩小巨脾的体积可腾出一定的空间,方便后续手术步骤的顺利进行。有研究[2,3]采用术前脾栓塞和术中结扎脾动脉伴或不伴远端注入含肾上腺素的生理盐水等方法来缩小巨脾体积。本组3例采取术中分离结扎脾动脉的方法,使巨脾体积略微缩小。然而,对大多数PHT患者,由于视野受限和解剖关系的变化,分离脾动脉常常变得艰难,并且一旦损伤大出血会使随后的操作难以顺利实施,因此,在尝试分离脾动脉不顺利的情况下,我们建议应及时放弃或不必常规进行分离结扎。另外,由于在LSPD过程中所见副脾的部位常常影响手术视野和占据随后涉及脾蒂的操作通道,故应常规先行切除。
诚然,术中出血是导致LSPD中转开腹的首要问题。结合我们的经验,我们认为LSPD术中出血源自三个环节,即不合理操作、脾蒂和胃脾韧带上极的离断以及食管下段右侧和胃小弯穿支血管的离断。
首先,在巨脾阻挡腔镜视野和挤满操作间隙的情况下,使用长杆形器械牵拉、固定、托举、挑拨和分离脾脏及脾周韧带时极易损伤脾脏;使用直线切割闭合器离断增粗增厚的脾蒂时,由于放置困难,采取反复调整的手法极易撕裂脾蒂和脾脏包膜导致大出血。出血发生后慌乱的操作又可能进一步加剧脾脏和邻近组织器官的损伤出血,常被迫中转开腹。因此,所有操作均应在腔镜观察下进行。使用器械应注意用力轻重适当,避免器械头端顶压脾脏。团队成员一定要将轻柔灵巧的操作、沉着冷静的应对、欲速则不达的心态贯穿于整个LSPD操作过程中。
在整个脾脏周围韧带的离断过程中,超声刀与脾脏要保持一种“若即若离”的手法,即贴近脾脏夹持组织,牵离脾脏切割组织。尤其在接近脾门处的游离时,过分贴近脾脏切割常常易损伤脾门处脾脏被膜下“蟹爪状”扩张的血管(图5),该处血管无弹性,压力大,出血汹涌,止血困难。过分远离脾脏分离切割又容易损伤脾周围已建立的侧支血管而出血。一旦发生脾被膜下血管损伤出血,我们认为最好垫以纱布团以肠钳压迫边止血边牵引,同时进行离断脾蒂的操作。
其次,离断脾蒂是LS过程中的关键步骤,也是手术中转的常见环节。通常,先常规离断脾下极有利于使用长杆形器械托举和挑拨脾脏,方便脾门的显露。本组病例,我们采用贯穿脾蒂后隧道的方式来建立离断脾蒂的通道。其关键技巧在于切开脾后外侧腹膜反折后可向前向右托举脾脏,进一步游离达胰尾和脾蒂后方。此时,不要急于游离脾蒂后方组织,而应将脾脏归于原位,离断脾胃韧带下半部分,进入小网膜囊,小心切开脾门处脾蒂前方的腹膜;随后再次向前向右托起脾脏,以吸引器尝试从脾蒂后上方向小网膜囊内钝性分离,常可顺利贯通离断脾蒂的隧道。从此隧道置入直线切割闭合器后贴近脾脏离断脾蒂。若夹闭不全或血管回缩而出血,则可以用肠钳控制脾蒂,施以钛夹局部止血。剩余的脾胃韧带和脾膈韧带可最后离断,此时要注意脾胃韧带上极,该处胃和脾最为接近,常常是继离断脾蒂后最容易出血的部位,可采用血管夹夹闭后切断,要避免使用钛夹止血。
第三,在LSPD过程中,离断食管下段右侧和胃小弯的穿支血管时最易损伤明显迂曲扩张的胃冠状静脉和食管旁静脉而致术中大出血。因此,操作中要能够准确识别右斜卧位下正常的空间和解剖关系,并能够灵巧运用各个穿刺孔内的器械的牵拉和挑拨作用加以显露。要使胃呈空虚状态,方便牵拉。离断穿支血管时,超声刀应当贴近胃和食管壁进行。可先离断胃后壁和胃底以利于牵引胃体,改善食管右侧壁和胃小弯的显露。一旦出血,可以钛夹止血。本组LSPD手术均在右斜位下顺利完成,术中不需更换体位。
3.4 标本的娩出技巧
脾脏尤其是巨脾的取出是一个较为棘手的问题。将脾脏放入取物袋内剪碎取出固然是理想的选择,但在一些巨脾的病例,取脾时间大多超过30 min甚至达到1 h左右。我们认为,对于PHT性巨脾,因其为淤血性肿大,可直接经腹壁切口取出。取脾时用抓钳牵扯脾门处血管结缔组织蒂将其拉至扩大的切口处,用2~3把卵圆钳钳夹脾脏包膜控制其在切口下方视野内,剪脾前于切口下方腹腔内垫衬数量不等的纱布块,直视下用剪刀和卵圆钳交替剪切脾脏成条块状取出,助手同时以吸引器吸去脾脏剪断面可能脱落的碎屑。脾脏取出后小心取出垫衬在腹腔内的纱布块。通过这种方法,我们未发现脾脏组织块在腹腔内残留,且多数在10 min内完成取脾。
总之,尽管LSPD是一风险很大的手术,只要认真进行充足的术前准备,遵循基本的操作流程,具备娴熟的腔镜技术和丰富的临床经验,以及训练一支默契、熟练的团队,采取LSPD是安全、可行的,值得临床进一步推广。
1 Habermalz B,Sauerland S,Decker G,et al.Laparoscopic splenectomy:the clinical practice guidelines of the European Association for Endoscopic Surgery(EAES).Surg Endosc,2008,22(4):821-848.
2 Zheng X,Liu Q,Yao Y. Laparoscopic splenectomy and esophagogastric devascularization is a safe,effective,minimally invasive alternative for the treatment of portal hypertension with refractory variceal bleeding.Surg Innov,2012 Mar 28.[Epub ahead of print]
3 Wang Y,Zhan X,Zhu Y,et al.Laparoscopic splenectomy in portal hypertension:a single-surgeon 13-year experience.Surg Endosc,2010,24(5):1164-1169.
4 杨 镇.选择性贲门周围血管离断术的发展与手术技巧.中国实用外科杂志,2009,29(5):450-451.
5 鲁发龙,陶凯雄,王国斌.腹腔镜脾切除联合贲门周围血管离断术的临床应用.中国微创外科杂志,2005,5(1):54-55.

