内镜超声和内镜黏膜下剥离诊治直肠类癌31例
阮荣蔚 王 实 刘永军 陶亚利 俞江平 朱舒文
(浙江省肿瘤医院内镜中心,杭州 310022)
直肠类癌是一种少见的、生长缓慢的上皮细胞肿瘤,组织结构像癌,具有恶变倾向,因早期缺乏特异性临床症状,诊断较为困难,且一直以外科治疗为主。近年来,随着肠镜及内镜超声(endoscopic ultrasonography,EUS)技术的普及,直肠类癌的早期检出率不断提高,内镜下治疗逐步成为当前的发展趋势。本文通过对我院2008年6月~2011年5月31例直肠类癌进行回顾性分析,探讨直肠类癌的EUS特征及其对内镜黏膜下剥离(endoscopic submucosal dissection,ESD)治疗的指导价值。
1 临床资料与方法
1.1 一般资料
本组31例,男18例,女13例。年龄17~84岁,平均48岁。27例有便血、便频、腹痛、腹泻、里急后重等非特异性症状,4例无明显临床症状,所有患者均无类癌综合征表现(如发作性皮肤潮红、腹泻、低血压、心率增快、呼吸困难、恶心呕吐等)。
EUS病例选择标准:对肠镜检查过程中发现表面黏膜正常的直肠隆起性病变均常规行EUS检查。ESD病例选择标准:根据EUS检查及深挖活检病理结果,对直径<1.5 cm、边界清晰、无肌层及周围血管侵犯、有内镜治疗意愿的直肠类癌患者行ESD。
1.2 方法
1.2.1 手术器械 Olympus CF-Q240电子肠镜;Olympus EU-M2000内镜超声系统;ERBE VIO 200S高频电发生器及ERBE APC2氩离子凝固器;Olympus UM-DP20-25R超声微探头,对应频率为20 MHz;Olympus KD-610L(IT刀),KD-620LR(Hook刀),KD-630L(Flex刀)高频电切刀;Olympus FD-1U-1热活检钳;Olympus NM-200U-0423注射针;Olympus HX-610-135型钛夹。
1.2.2 EUS检查方法 EUS扫描记录病变的起源层次、内部回声、大小、边界、有无肌层及周围血管浸润等情况(图1),并常规在EUS下行深挖活检。
1.2.3 ESD方法 术前静脉推注丙泊酚注射液40~50 mg及芬太尼注射液0.05~0.1 mg全身麻醉。常规取左侧卧位。操作过程:①用氩气刀在瘤体边缘5 mm处做环周标记(图2);②沿标记外缘分点向黏膜下注射甘油果糖和美蓝混合液,每点2 ml左右,多点重复注射,使病灶明显隆起;③取IT刀在标记点外侧缘对黏膜行环周切开(图3),Flex刀或Hook刀沿肌层对黏膜下层进行分离,剥离过程中需要反复行黏膜下注射,确保瘤体与肌层充分分离;④完整剥离瘤体后送病理活检,明确基底与切缘有无肿瘤组织残留;⑤术后处理创面,有效止血(图4)。
1.3 随访
术后1、3、6个月复查,然后每年随访一次,常规行肠镜及肝脏B超等检查。
2 结果
2.1 肠镜表现(图5)
瘤体距肛缘3~10 cm,直径0.5~2.5 cm,其中0.5~1.0 cm 25 例,1.1~2.0 cm 4 例,>2.0 cm 2例。肠镜下表现为凸向腔内的黏膜下肿块,广基或半球形,表面黏膜光滑完整,呈淡黄色或灰白色,触之质地较硬,活动度良好,其中2例直径>2.0 cm的肿瘤表面脐凹,基底较固定。
2.2 EUS表现及病理
EUS显示黏膜下层或黏膜深层的低回声占位影,内部回声欠均匀,其中黏膜下层18例,黏膜深层13例;29例与肌层分界清晰,2例直径>2.0 cm者与肌层分界模糊。31例均行深挖活检病理证实为类癌(图6)。
2.3 ESD 治疗
经ESD治疗19例,其中0.5~1.0 cm 17例,1.1~1.5 cm 2例,均完整剥离瘤体,术前常规行B超、CT等检查排除淋巴结及远处转移。1例在剥离过程中发生直肠小穿孔,成功行钛夹夹闭穿孔,术后预防性抗感染治疗2 d,无明显腹痛、发热等症状;1例术后第2天出现鲜血便,急诊肠镜检查见创面边缘小动脉搏动性出血,钛夹夹闭后成功止血。术后病理提示切除标本基底及边缘均无类癌组织残留。
2.4 转归
术后1个月复查肠镜,18例创面愈合良好,呈红色瘢痕样改变(图7),1例创面处形成一直径约2.5 cm左右的深凹溃疡,有大量坏死污苔,转手术治疗,切除后标本中未找到类癌细胞。19例随访1~4年,平均1.8年,无一例复发及远处转移。
3 讨论
直肠类癌是一种少见的低度恶性肿瘤,发病率约占所有直肠肿瘤的1.3%[1],目前居胃肠道类癌的首位[2],多见于40~60岁的中老年患者,男性多于女性,通常为单发,偶有多发。本组31例平均年龄48岁,男18例,女13例,且均为单发,与文献[3]报道相符。
直肠类癌缺乏特异性临床症状,多由直肠指检及肠镜检查发现。直肠类癌多位于距肛缘4~13 cm的肠段范围内,其中距肛缘8 cm以内者占89.5%~96.1%,在指检范围之内,如触及质地较硬、界限清晰的无痛性活动结节,应怀疑直肠类癌的可能,但对于直径 <0.5 cm的类癌,指检常易漏诊[4]。肠镜对病变的观察比较直观,直肠类癌典型的肠镜下表现为广基的半球形隆起,淡黄色或灰白色,表面黏膜覆盖完整且比较光滑,有时表面可有凹陷,呈圆盘状改变。但无论是肠镜还是指检,均不能准确判定直肠类癌的起源层次、侵犯深度、边界等情况,无法对治疗方案的选择做出正确的评估,EUS检查可弥补这方面的不足。EUS能清晰显示消化道管壁的层次结构,并依据病变起源层次及内部回声特点,初步明确其性质,是目前公认诊断消化道黏膜下病变的最佳方法[5],已被广泛应用于直肠类癌的诊治。本组31例直肠类癌行EUS扫描,典型表现为位于黏膜下层或黏膜深层的低回声占位影,内部回声欠均匀,与肌层分界清晰。值得一提的是,类癌虽属于上皮来源的肿瘤,但早期即可延伸至黏膜下生长,因此,EUS下常表现为位于黏膜下层的低回声占位影。王向东等[6]报道12例直肠类癌中,7例位于黏膜下层,5例位于黏膜层;本组31例中,18例位于黏膜下层,13例位于黏膜深层。

图1 EUS图像显示位于黏膜深层的低回声占位影,与黏膜下层分界清晰,具备ESD治疗指征

图2 用氩气刀沿病灶边缘做环周标记

图3 黏膜下分点注射甘油果糖和美蓝混合液,使病灶明显隆起,IT刀在标记点外侧缘对黏膜行环周切开

图4 完整剥离瘤体,氩气刀处理创面后,未见明显出血点及黏膜下血管显露,创面干净整洁
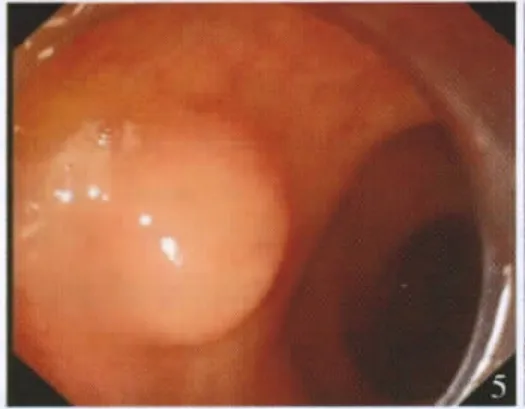
图5 直肠类癌肠镜下表现为黏膜下隆起病变,呈淡黄色,表面光滑

图6 病理示形态符合高分化神经内分泌肿瘤(类癌) HE染色×100
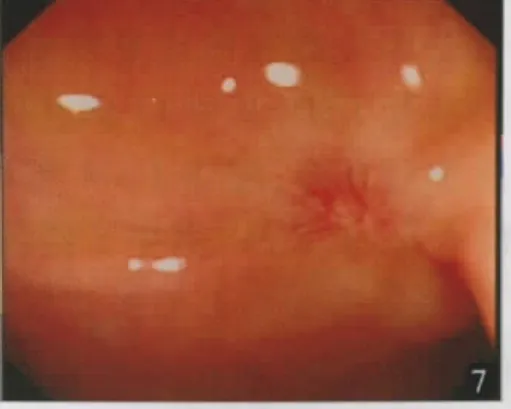
图7 ESD术后1个月复查肠镜示创面处形成一红色瘢痕,愈合良好
通过肠镜及EUS检查,可对直肠类癌做出初步诊断,但目前病理仍为诊断类癌的金标准[7]。严格来讲,直肠类癌属于上皮下肿瘤的范畴,因其表面光整,故普通活检的阳性率往往较低。本研究通过对EUS证实的位于黏膜深层及黏膜下层的实体肿瘤行单点深挖活检,31例直肠类癌全部得到病理证实,深挖活检的阳性率达100%。我们认为通过EUS指导下的深挖活检技术,既可以避免对黏膜下病变的盲目活检,导致出血、穿孔等不良后果,又可以显著提高对黏膜下肿瘤的诊断率,值得临床应用及推广。
在直肠类癌的治疗上,过去认为手术切除是唯一有效的方法。近年来,随着对其认识程度的不断加深,特别是内镜技术的迅猛发展,内镜下切除逐步成为当前的治疗热点[8]。直肠类癌的恶性程度主要取决于瘤体的大小、表面情况、浸润深度和组织学分化程度,其中以肿瘤大小和是否侵犯肌层最为重要。类癌的恶性程度与大小显著相关[9],当瘤体直径≥2.0cm 时有60%~80%发生转移,1.0~1.9 cm者有10%~15%转移,<1.0 cm者转移不足2%,临床上通常将肿瘤直径是否>2.0cm作为判断直肠类癌恶性度高低的关键性指标。在实际工作中,检出的直肠类癌瘤体大小绝大多数<1.0 cm,发生转移的可能性极低,因此,通过内镜下治疗是可行的。
在内镜治疗方法上,过去以标准息肉切除法及内镜黏膜切除术(endoscopic mucosal resection,EMR)为主,近年来,随着内镜治疗器械的不断革新,ESD应运而生,目前已被广泛应用于消化道早期癌及黏膜下肿瘤的治疗。与EMR相比较,ESD技术显示了其独特的治疗优势[10]:①ESD可切除的病变范围相对较大;②ESD可完整切除病灶,病变残留及复发的几率远较EMR低;③ESD切除深度可控,且视野相对较清晰,可避免EMR盲目切除造成的出血、穿孔等严重并发症,特别是对于黏膜下肿瘤的治疗更具优势;④ESD切除的病变完整,可行全面的病理学检查,结果更为可靠。对于直肠类癌行内镜下治疗需要符合以下标准:①瘤体直径<1.0 cm;②肿瘤未侵犯肌层;③肿瘤表面无溃疡或凹陷。目前,国内外绝大多数经内镜下治疗的直肠类癌遵循以上标准,但事实上对于直径>1.0 cm的类癌可否行内镜下切除一直存在争议。在日本,对直径>1.0 cm直肠类癌遵循与直肠腺癌同样的手术原则;但Jung等[11]认为对肿瘤直径<2.0 cm、浸润深度未超出黏膜下层、无远处转移的直肠类癌可行内镜下切除。近年来,对直径在1.0~2.0 cm的直肠类癌行内镜下切除的报道逐年增多,且绝大部分取得了良好的治疗效果,少部分因局部残留或复发而追加外科手术。本组19例接受ESD,其中17例直径<1.0 cm,经ESD切除后预后良好,随访1~4年均无复发及转移;2例直径1.0~1.5 cm,其中1例预后良好,另1例切除后1个月复查肠镜见创面处形成一直径约2.5 cm左右的深凹溃疡,考虑类癌组织残留可能,后追加外科手术治疗,但切除标本中未找到类癌细胞。因此,我们认为对于 <1.0 cm的直肠类癌行ESD治疗是安全可靠的,而对于瘤体直径在1.0~2.0 cm的直肠类癌,治疗上必须持谨慎态度,因为随着瘤体的增大,向黏膜下层浸润的深度增加,发生区域淋巴结转移的几率随之加大,文献[12,13]报道在17%~81%,因此,治疗前须严密评估,只有对EUS及CT检查未提示肌层及血管侵犯,无区域淋巴结及远处转移的患者,才可尝试行ESD治疗,且必须符合内镜下完全切除标准,即基底无类癌组织,各边缘0.2 cm以上非类癌组织。ESD术后需要密切随访,对怀疑残留及复发患者,及时转外科治疗。
ESD治疗的主要并发症为出血与穿孔,出血包括术中即时出血及术后迟发性出血两类。即时出血往往难以避免,本组19例ESD剥离过程中均有不同程度的出血,因出血会造成操作视野模糊,而盲目止血又可导致穿孔等并发症的发生,因此,术中如何确切止血,保持操作视野清晰显得尤为重要。迟发性出血的发生率一般比较低,本组1例术后第2天鲜血便,急诊肠镜检查发现创面边缘小动脉搏动性出血,考虑与小动脉残端焦痂脱落有关,经钛夹夹闭后成功止血。迟发性出血重在预防,ESD剥离瘤体后可用氩气刀对创面潜在的出血点及暴露的血管进行凝固处理,对较粗的血管残端可用钛夹夹闭。穿孔是ESD治疗的另一主要并发症,文献[14~16]报道发生率为 2.9%~5.0%,本组发生率为 5.3%(1/19),与报道基本一致。对直肠类癌而言,因其绝大部分位于距肛缘8 cm以下肠段,即通常位于腹膜反折以下,因此,即使发生穿孔,也不至于出现腹膜炎等严重并发症,一般用钛夹夹闭穿孔后结合静脉应用抗生素保守治疗即可,通常无须行修补术。
综上所述,我们认为EUS可明确直肠类癌的来源层次、大小、内部回声、边界、有无肌层及周围血管浸润等情况,并指导治疗方案的选择。对于直径<1.0 cm的直肠类癌,通过ESD治疗是安全可靠的,可避免不必要的外科手术。
1 Fahy BN,Tang LH,Klimstra D,etal.Carcinoid of the rectum risk stratification (CaRRS):a strategy for preoperative outcome assessment.Ann Surg Oncol,2007,14(2):396-404.
2 Kinoshita T,Kanehira E,Omura K,et al.Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor.Surg Endosc,2007,21(6):970-974.
3 程天明,秦和平.消化道类癌的诊治现状.现代消化及介入诊疗,2010,15(3):184-187.
4 李晓露,夏 璐.直肠类癌的诊断及治疗现状.胃肠病学和肝病学杂志,2011,20(6):495-497.
5 Shen EF,Aronott ID,Plevris J,etal.Endoscpic ultrasonography in the diagnosis and management of suspected upper gastrointestinal submucosal tumors.Br JSurg,2002,89(2):231-235.
6 王向东,王志强,黄启阳,等.直肠类癌的内镜超声图像特征.中华消化内镜杂志,2005,22(2):98-100.
7 袁海洪,张连郁.53例胃肠道类癌临床病理分析.中国肿瘤临床,2009,36(7):372-374.
8 周 环,汪 旭,孙明军,等.直肠类癌内镜诊断及治疗46例.世界华人消化杂志,2010,18(3):306-309.
9 Soga J.Early-stage carcinoids of the gastrointestinal tract:an analysis of 1914 reported cases.Cancer,2005,103(8):1587-1595.
10 Kiyonori K,Tomoe K,Shigeru Y,et al.Indications of endoscopic polypectomy for rectal carcinoid tumors and clinical usefulness of endoscopic ultrasonography.Dis Colon Rectum,2005,48(2):285-291.
11 Jung IS,Ryu CB,Kim JO,etal.Rectal carcinoid treated by EMR.Gastrointest Endosc,2003,58(2):253.
12 Kwaan MR,Goldberg JE,Bleday R.Rectal carcinoid tumors:review of results after endoscopic and surgical therapy.Arch Surg,2008,143(5):471-475.
13 Konishi T,Watanabe T,Kishimoto J,et al.Prognosis and risk factors of metastasis in colorectal carcinoids:results of a nationwide registry over 15 years.Gut,2007,56(6):863-868.
14 Moon SH,Hwang JH,Sohn DK,et al.Endoscopic submucosal dissection for rectal neuroendocrine (carcinoid) tumors.J Laparoendosc Adv Surg Tech A,2011,21(8):695-699.
15 Park HW,Byeon JS,Park YS,et al.Endoscopic submucosal dissection for treatment of rectal carcinoid tumors.Gastrointest Endosc,2010,72(1):143-149.
16 Zhou PH,Yao LQ,Qin XY,et al.Advantages of endoscopic submucosal dissection with needle-knife over endoscopic mucosal resection for small rectal carcinoid tumors:a retrospective study.Surg Endosc,2010,24(10):2607-2612.

