灰团网菌的生活史
史立平,李 玉
(1.沈阳师范大学实验中心,辽宁 沈阳 110034;
2.吉林农业大学菌物研究所,吉林 长春 130118)
灰团网菌的生活史
史立平1,李 玉2
(1.沈阳师范大学实验中心,辽宁 沈阳 110034;
2.吉林农业大学菌物研究所,吉林 长春 130118)
采用基物培养、燕麦-琼脂培养技术及扫描电镜技术对灰团网菌的个体发育过程进行了研究,在燕麦琼脂培养基上完成了从孢子到孢子的生活史.结果表明:灰团网菌生活史包括单核的黏变形体或游动胞、多核的营养体原质团以及孢子形成阶段.孢子球形,表面具疣突;孢子萌发为孔式,一个孢子可释放一个黏变形体.黏变形体常行变形运动,在有水的条件下,可转变为游动胞并具有游动的特性.合子形成原质团.成熟原质团白色,类型为显型,具有扇形网络状菌脉.琼脂培养基上获得的灰团网菌孢子与野生型相似,并具有可育性.
黏菌;燕麦琼脂培养;孢子形成;原质团
黏菌的生活史对于研究其营养方式的多样性以及系统发育等具有重要价值.目前国际上有近100个品种的黏菌已在培养基上完成了其生活史[1-4],而国内有关黏菌生活史的报道很少[5-11].灰团网菌属团网菌目、团网菌科、团网菌属.子实体为孢囊,散生、群生或2~20个柄相连成束,亚圆柱形或卵圆形,少为宽卵形;径可达0.8mm,高0.3~4.0mm.孢囊浅灰、黄褐至赭色;囊被薄、凋落,但常有残片附着在伸展的孢网上;柄细,同色或稍暗,有时近黑色,柄长0.2~2.0mm,常联合成束;孢丝同色,连着牢固,网眼密(见图1A).资料记载分布全球,原质团白色.
1 材料与方法
1.1 材料
1.1.1 供试菌种 供试菌种为2002年8月在吉林蛟河、长白山二道白河、吉林敦化采集到的灰团网菌的原质团及子实体.依据子实体及孢子等特征进行鉴定.
1.1.2 主要仪器 超净工作台、医用蒸汽消毒锅、离心机、真空干燥箱、人工气候箱;显微成像系统,日本Hitachis-570扫描电镜等.
1.2 方法
采用基物培养技术[12-14]、燕麦琼脂培养技术[6,15-16]及扫描电镜技术(SEM).
电镜观察:先在样台上粘贴双面胶,然后将成两个熟子实体牢固置于双面胶上.其中的一个子实体在解剖镜下剥开上半部囊被使孢子暴露,经离子溅射仪喷金后上镜观察,同时拍照.应用显微测微尺测量黏变形体和游动胞大小,测100个,计算其平均值.
2.1 孢子及其萌发
孢子成堆时呈浅灰或浅黄色,光镜下无色,球形.电镜下观察,囊被薄,孢子凹陷,直径6~8μm,有细小疣点和少量较大疣点(见图1B);孢丝细线形,成网状,具刺.孢子干燥时稍凹陷,遇水或营养提取液立即变为球圆形(见图1C).悬滴培养的孢子即将萌发时其原生质稍增大,并缓慢地运动.孢子悬浮6d后开裂,萌发类型为孔式.灰团网菌孢子萌发率很低,约30%.

图1 灰团网菌扫描电镜观察及野生子实体
2.2 黏变形体与游动胞
孢子壁开裂后可释放1~2个原生质.原生质在2%水琼脂表面形成黏变形体,近于无色透明,梨形;黏变形体中央区域有一较大的细胞核,核仁大,色深、明显.周围部分的原生质膜从不定区域向外突出,均质状原生质流入其中,形成伪足,其余部分的原生质随着细胞形态的改变不停流动.黏变形体连续分裂使细胞数目增至数十或上百个.在有水的条件下,黏变形体转变为游动胞.游动胞为逗点状、梨状至具鞭毛的变形虫状,前端尖后端钝圆,长14.3~18.2μm (平均16.5μm,n=100),宽5.2~7.8μm (平均6.5μm,n=100个),以旋转的方式并结合变形体的收缩运动快速游动.
2.3 合子及原质团的发育
黏变形体两两结合形成合子.合子比黏变形体大,为一圆形或近圆形结构,且细胞质浓厚,以此可区分单细胞的黏变形体与合子.在合子内部可观察到原生质的流动.合子经过核分裂后具有2核,再通过连续的核分裂很快发育为多核的变形体结构——幼原质团.灰团网菌原质团发育初期结构与已报道的针箍菌等绒泡菌目真菌的原质团[6]不同,未见蛞蝓形原质团,而是呈现不规则的网状结构,非常薄,菌脉细.幼原质团之间互相融合成为较大的极性原质团,且原质团在迁移的过程中始终保持这种极性.
当原质团达1mm大小时,肉眼仔细观察可见.从接种到出现肉眼可见的原质团约需10d.小原质团继续生长,并融合为几个较大的原质团,最终培养皿中的原质团完全融合为一个大原质团.原质团可依靠燕麦粉和水生长发育,大约10d左右,白色的原质团可长满整个培养皿(见图2A—C).
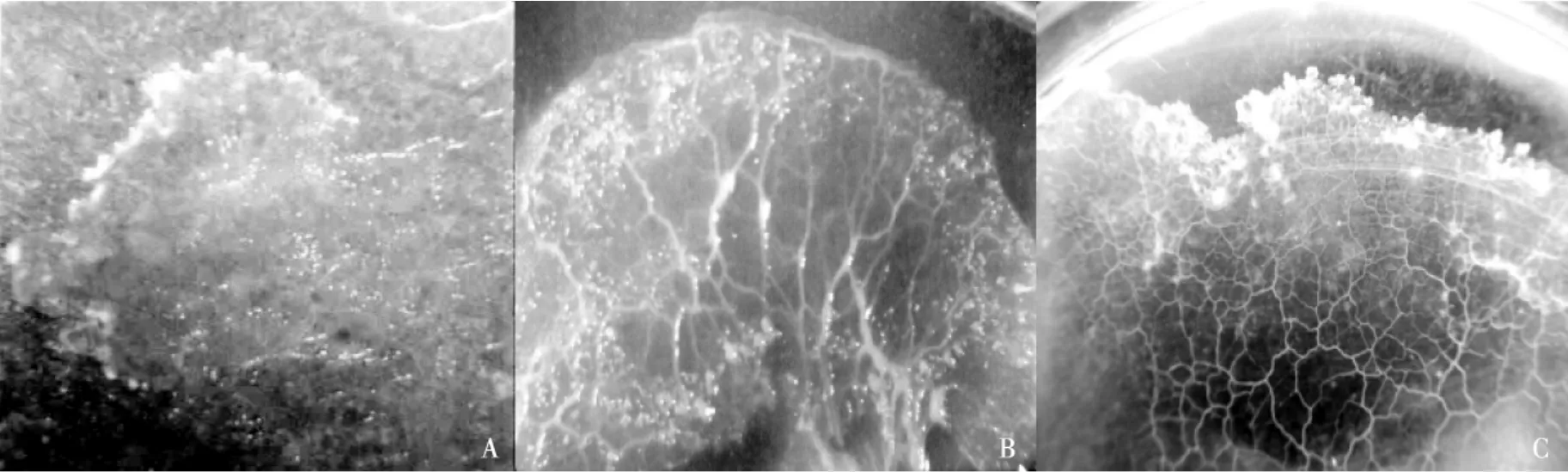
图2 灰团网菌原质团
2.4 原质团
营养体原质团成熟时具有较大的扇形结构,白色片状,很薄,存在于培养皿的表面,类似于显性原质团,具有迁移、融合和吞噬等特征.但原质团达不到显性原质团的厚度,原质团内部的颗粒物质不明显;芳香气味不明显,触摸时会变成不定型的斑块状,且易于黏着.菌脉比显性原质团菌脉细,直径不超过0.5mm.低倍显微镜下观察生长旺盛的原质团菌脉,可见菌脉内有许多的颗粒相互碰撞着并快速地向一个方向流动,单向流动时间为2~3min;接下来原生质的流动减慢,暂停片刻,然后开始向反方向流动.这种往返流动以一定的时间间隔重复进行,间隔时间为1~3s.
原质团的生长受酸度的影响.在pH=4~7的范围内,原质团生长良好,颜色正常;在pH<3时也能够生长,但生长缓慢.当pH=8时原质团可维持生存;当pH>9时,原质团变为浅棕色而死亡.通过燕麦水琼脂迁移技术,在水琼脂培养基上保存的营养体原质团达270d,原质团仍生长良好.
2.5 子实体形成
原质团经过营养生长,积累达到一定的量,才能形成子实体.若原质团量很少,例如在琼脂表面上的面积小于1cm2,则不能形成子实体.足够量的原质团经过光照和饥饿,于4~7d后开始在培养皿的琼脂表面、侧壁等处形成子实体.成熟的原质团不经过光照则不形成子实体.
成熟的原质团作为一个整体,全部参与子实体的形成.首先,培养皿中的原质团沿着原质团前缘和一些粗大的菌脉开始聚集,形成一些间距比较固定、沿菌脉分布的小团块.团块开始形成时比较扁平,形态不规则,团块与团块之间有菌脉相连,光镜下观察可见到菌脉内有原生质流动.接下来团块逐渐向上隆起,形成规则的白色球圆形突起(见图3A),直径0.5~0.8mm,突起间彼此距离为1~10mm.此时圆形突起之间的菌脉退化,菌脉内已无原生质流动,直至菌脉完全消失,圆形突起间彼此独立.此过程需要3~3.5h.多数圆球形突起继续向上生长,突起的上部由椭圆形变成圆柱状或卵圆状,下部逐渐变细长,发育成为菌柄.最终形成圆柱状具柄的白色幼子实体(见图3B),全高3~4mm.少数圆球形突起形成的菌柄很短,或2~10个菌柄融合在一起.此过程大约需要4h.孢囊的白色外表可一直保持4~6h,后逐渐变成黄色、棕黄、棕红、深棕至成熟的灰色(见图3C—F).菌柄最终变为浅黄色,内部有石灰质沉积.从原质团到子实体形成至少需要14h(见表1).
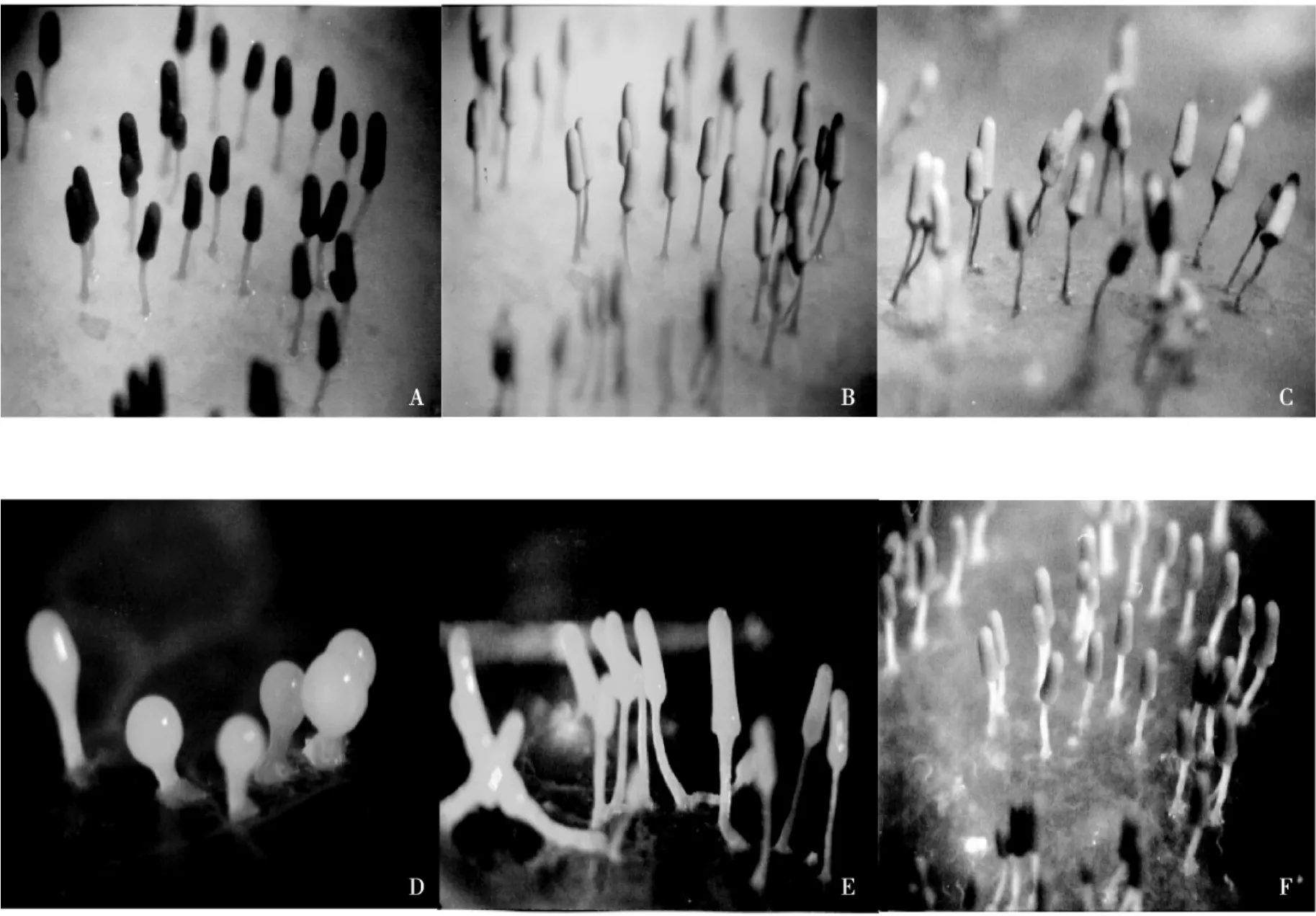
图3 灰团网菌子实体的形成过程

表1 灰团网菌子实体的形成过程
3 讨论
黏菌从孢子到孢子的培养由Lister在1901年首次报道,目前已有98个品种用培养的方法完成了其生活史[17].然而,“尽管有许多关于黏菌的研究,但只有一些种的全部生活史的详细情况是清楚的.普遍的生活史通常是建立在对多头绒泡菌PhysarumpolicephalumSchwein研究的基础之上的”[18].20世纪80年代国内学者开始采用基物培养的方法获得了一些黏菌[19],刘朴及王琦等用基物培养和燕麦-琼脂培养的方法对团毛菌目Trichales黏菌的主要属种及绒泡菌目Physarales的细弱绒泡菌Physarum tenerumRex的个体发育进行了初步研究[20-21],但关于灰团网菌的个体发育研究尚属首次.[22]
Gilbert曾对不同科黏菌的孢子萌发进行了比较研究,发现黏菌的萌发能力在不同的种属之间是有区别的;同期的Smith对5~25a的黏菌孢子进行了萌发实验研究,指出所用实验材料的年龄与萌发率之间并无相关性.后来Elliott利用胆盐的方法来促进孢子萌发,取得了很好的效果.本研究将胆盐的方法和纯水培养进行了比较,孢子萌发率并无明显差别,可能是由于灰团网菌孢子的萌发能力均比较弱所致.
早期的一些研究者已经注意到黏菌营养体阶段(原质团)发生在遮阴或光线暗的地方,而子实体通常发生在暴露的地方,这似乎表明了光对黏菌子实体形成的影响.其他影响黏菌子实体形成的可能的重要因素包括湿度、pH和营养.光能诱导子实体的形成,原质团产孢能力依赖于被照射的原质团的大小,即原质团必须有足够的尺寸才能产孢.小原质团不论在黑暗中饥饿多久都不形成子实体[16].本实验通过光照饥饿技术对灰团网菌限制光照及营养,在纯培养基上成功诱导形成了子实体.与已经纯培养成功的针箍菌Physarellaoblonga等相同,灰团网菌原质团对光照敏感,这与William的观察一致.[23]
本实验通过光照饥饿技术诱导形成子实体,共在30个培养皿中成功地诱导得到了灰团网菌子实体.生长在2%水琼脂表面的灰团网菌原质团,在一个培养皿中最多可形成100多个子实体.在子实体成熟3~5d后接种孢子即可萌发并能够长成原质团,表明在琼脂上培养成熟的灰团网菌孢子具有可育性.完成从孢子到孢子的过程至少需要20d.
[1] WILSON C M.Cytological study of the life cycle ofDictyostelium[J].American Journal of Botany,1953,40:714-718.
[2] KELLER H W,SCHOKNECHT J D.Life cycle of a new annulate-spored species ofDidymium[J].Mycologia,1989a,81:248-265.
[3] KELLER H W,SCHOKNECHT J D.Spore-to-spore cultivation ofPhysarumspinisporumand its transfer toBadhamia[J].Mycologia,1989b,81:631-636.
[4] KELLER H W,SCHOKNECHT J D.Spore-to-spore cultivation of a new wrinkled-reticulate-sporedBadhamia[J].Mycologia,1989c,81:783-789.
[5] 史立平,李玉.黏菌生物学研究进展[J].吉林农业大学学报,2003,25(1):49-53,61.
[6] 史立平,李玉.针箍菌的生活史[J].菌物学报,2004,23(3):381-387.
[7] 史立平,李玉.圈绒泡菌的生活史[J].菌物学报,2005,24(2):292-296.
[8] 史立平,王升厚,李玉.黄柄钙皮菌的生活史[J].菌物学报,2006,25(3):496-501.
[9] 史立平,李玉.细弱绒泡菌的生活史[J].菌物学报,2007,26(2):211-216.
[10] 史立平,李玉.扁绒泡菌的生活史[J].菌物学报,2008,27(6):718-726.
[11] 史立平,李玉.多头绒泡菌的生活史[J].东北师大学报:自然科学版,2010,42(4):106-110.
[12] EL-HAGE N,LITTLE CLARK J D.Biosystematics of theDidymiumsquamulosumcomplex[J].Mycologia,2000,92(1):54-64.
[13] SCHNITTLER M,NOVOZHILOV Y K.Myxomycetes of the winter-cold desert in western Kazakhstan[J].Mycotaxon,2000,74:267-285.
[14] SCHNITTLER M,STEPHENS S L.Myxomycete biodiversity in four different forest types in Costa Rica[J].Mycologia,2000,92(4):626-637.
[15] HOK A.Study of the nutrition of myxomycete plasmodia[J].American Journal of Botany,1954,41:792-799.
[16] HOSODA E.Sporulation of oat-culturedPhysarumpolycephalum[J].Mycologia,1981,73:689-696.
[17] CLARK J.Myxomycete reproductive systems:additional information[J].Mycologia,1995,87(6):779-786.
[18] KOEVENING J L.Studies on life cycle ofPhysarumgyrosumand other myxomycetes[J].Mycologia,1964,56:170-184.
[19] 周宗璜,张志澄,刘宗麟.从基物培养获得的几种黏菌[J].吉林农业大学学报,1981,3(2):1-9.
[20] 王琦,年淑清,李玉.团毛菌目黏菌主要属种个体发育研究初探[J].吉林农业大学学报,1998,25(1):31-40.
[21] 刘朴,王琦.细弱绒泡菌的培养及个体发育初探[J].菌物研究,2006,4(3):27-30.
[22] 史立平.绒泡菌目与团毛菌目一些黏菌生活循环的研究[D].长春:吉林农业大学,2003:113-120.
[23] WILLIAM G D.The effect of light on the fruiting of Myxomycete[J].American Journal of Botany,1938,25:511-522.
Life cycle ofArcyriacinerea
SHI Li-ping1,LI Yu2
(1.Experimental Centre,Shengyang Normal University,Shenyang 110034,China;
2.Mycological Institute,Jilin Agricultural University,Changchun 130118,China)
The life history of myxomycetes is of importance to study diversity of nutritive modes and phylogenesis of these organisms.Until now the reports concered were few.Moist chamber culture method,oat-agar culture method and scanning electron microscopy were used to study the process of the individual development ofArcyriacinerea.The life cycle of spore-to-spore were completed in agar culture in petridish.The result shows that the life cycle ofArcyriacinereacomprises a unicellular amoeboid or swarm cell stage,a multinucleate plasmodium stage and a sporulation stage.The spore ofArcyriacinereais globular and the spore surface is spiny.The spore germinates by means of a poriform open and releases a single myxamoeba.The myxamoeba can move by amoeboid motion.When free water is available,myxamoebae can transform into swarm cells and swim in the water.Zygote forms into plasmodium.The mature plasmodium is white.The plasmodial type is the phaneroplasmodium which appears as a fan-shaped network of veins.Spores developed on agar are fertile and resemble those on natural substrate.
Myxomycetes;oat-agar culture;sporulation;plasmodium
Q 949.32
180·6140
A
1000-1832(2012)01-0118-05
2011-08-23
国家自然科学基金资助项目(30770005).
史立平(1964—),女,博士,教授,主要从事菌物发育学研究;通讯作者:李玉(1944—),男,教授,博士研究生导师,中国工程院院士,主要从事真菌学研究.
方 林)

