莪术油配伍椒目仁油对小鼠移植性肿瘤的抑制作用
谢艳华,贺中民,杨 倩,缪 珊,毕琳琳,孙纪元,王四旺
莪术油配伍椒目仁油对小鼠移植性肿瘤的抑制作用
谢艳华,贺中民,杨 倩,缪 珊,毕琳琳,孙纪元,王四旺
目的 观察不同剂量莪术油配伍椒目仁油对小鼠移植性肿瘤S180的抑瘤作用,以及对人源性肝癌细胞株HepG2和大肠癌细胞株SW480的体外抑瘤作用。方法 72只二级昆明小鼠采用肿瘤移植法建立小鼠荷瘤动物模型;椒莪软胶囊灌胃给药,剂量分别为0.3、0.6、1.2 ml/kg;氟尿嘧啶22.5 mg/kg作为阳性对照药腹腔注射给药;连续给药15 d,观察药物对肿瘤生长的抑制作用。对人源性肝癌细胞株HepG2和大肠癌细胞株 SW480 进行传代培养后,制备不同剂量(椒莪软胶囊0. 015625、0. 03125、0. 0625、0.125、0.25、0.5、1、2、4 mg/ml)含药血清、氟尿嘧啶阳性药血清和肿瘤移植模型不用药对照血清,作用于人源性肝癌细胞株HepG2和大肠癌细胞株SW480,四甲基偶氮唑蓝比色法观察血清对两种细胞的抑制作用。椒莪软胶囊0.0、6.25、12.5、25.0 μg/ml给药15 h后,经流式细胞仪测定对人源性肝癌细胞株HepG2细胞凋亡的影响。结果 ①椒莪软胶囊0.3、0.6、1.2 ml/kg肿瘤抑制率分别为19.73%、32.22%和46.68%。随着给药剂量的增加,坏死的肿瘤细胞所占比例也相应增加,生长活跃的肿瘤细胞逐渐减少。②抑制作用随剂量升高而作用增强,对人源性肝癌细胞株HepG2体外最低药物物浓度为0. 0625 mg/ml,对大肠癌细胞株SW480体外最低药物浓度为0.125 mg/ml。③椒莪软胶囊可明显促进人源性肝癌细胞株HepG2的细胞凋亡。结论 椒莪软胶囊对小鼠移植性肿瘤有明显的抑制作用,对人源性肝癌细胞株HepG2和大肠癌细胞株SW480有明显的抑制作用。椒莪软胶囊在临床具有广阔的应用前景。
椒莪软胶囊;抗肿瘤;人肝癌HepG2细胞;人大肠癌SW480细胞;细胞凋亡
椒莪软胶囊的主要成分为莪术油和椒目仁油组成。国内外文献报道,这两种药油中都含有一定的抗肿瘤活性成分,如莪术油中含有β-榄香烯,而椒目仁油中则含有α-亚麻酸等,作为中药制剂用来治疗肿瘤可能具有其独特的优势。如果对给药剂型及给药剂量进行深层次研究或优化配方,以降低其不良反应,进一步增强抗肿瘤作用,可能使椒莪软胶囊具有更加可靠的临床应用价值。为进一步阐明其药效作用,观察不同剂量莪术油配伍椒目仁油对小鼠移植性肿瘤S180的抑瘤作用,以及对人源性肝癌细胞株HepG2和大肠癌细胞株SW480的体外抑瘤作用。
1 材料与方法
1.1 材料
1.1.1 药品 椒莪软胶囊内容物,由第四军医大学药物研究所制剂室提供,批号20111206;临用前用色拉油配成不同浓度备用。
1.1.2 阳性对照药 氟尿嘧啶注射液(规格:0.25 g/10 ml),上海旭东海普药业有限公司,批号:201108031,批准文号:国药准字H31020593。
1.1.3 试剂 吐温80购自天津市化学试剂厂三分厂;液体RPMI-1640购自Gibco公司;小牛血清购自杭州四季青生物工程公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma公司;四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]购自Sigma公司;磷酸缓冲液(phosphoric acid buffer,PBS)为实验室自配;96孔培养板购自Costa公司;0.22 μm针式滤器购自Pall公司。1.1.4 仪器 独立通气笼具(individually ventilated cages,IVC)饲养系统(上海绍丰实验动物设备有限公司);德国Sartorius电子天平(感量0.1 mg);德国Axioskop 40蔡司显微镜(Carl Zeiss Far East Co.Ltd);DT-2000型电子天平(常熟市衡器厂);BIO-RAD Model 680全自动酶标仪,Gibco公司;ELITE ESP型流式细胞仪,Beckman-Coulter公司。
1.1.5 动物 二级昆明小鼠72只,雌雄各半,体质量18~22 g,6~8周龄,由第四军医大学实验动物中心提供,生产合格证号:scxk(军)字第2007-007号。1.1.6 瘤株 鼠源性小鼠荷瘤S180,人源性肝癌细胞株HepG2和大肠癌细胞株SW480,由第四军医大学实验动物中心提供。
1.2 方法
1.2.1 体内抑瘤实验
1.2.1.1 造模方法 二级昆明种小鼠72只,雄雌各半,体质量18~22 g,6~8周龄。取荷S180瘤株的小鼠腹水制成瘤细胞混悬液,细胞浓度为2×107个/ml。除正常组12只小鼠,其余60只用0.25 ml注射器吸取瘤细胞混悬液0.2 ml于小鼠腘窝皮下注射[1-2]。
1.2.1.2 动物分组及给药 将60只接种小鼠随机分为5组,每组12只,雌雄各半,分别为:模型组,阳性组(22.5 mg/kg,氟尿嘧啶),椒莪软胶囊小剂量组(0.3 ml/kg)、中剂量组(0.6 ml/kg)、大剂量组(1.2 ml/kg)。给药组在造模当天分别灌胃上述药物,正常组及模型组灌胃等容量色拉油,每日1次。
在给药2周后,完整取出小鼠肿瘤,脾和胸腺组织,并用电子天平(感量0.1 mg)即时称重,计算瘤重,肿瘤抑制率和胸腺/脾脏指数。抑制率(%)=(模型组平均瘤质量一给药组平均瘤质量)/模型组平均瘤质量×100%。胸腺(脾脏)指数=[胸腺(脾脏)质量/体质量]×100。同时取小鼠部分肿瘤组织,固定于10%福尔马林液中,常规脱水、透明、浸蜡、包埋、切片,苏本素和伊红染色(hematoxylin and eosin,HE),DPX封片后在光学显微镜下进行组织形态学观察。
1.2.2 体外抑瘤实验(MTT法)
1.2.2.1 细胞培养 从液氮罐中取出保存HepG2和SW480细胞的冻存管,迅速放入37℃恒温水浴箱中,不时摇动令其尽快融化。取出冻存管,用吸管吸取细胞悬液,注入离心管并滴加10倍体积含10%新生牛血清的RMPI 1640培养基(含有双抗),混合后低速离心 1000 r/min,去除上清液,再重复用培养液清洗1次。用培养基适当释稀后,接种于75 ml玻璃培养瓶中,放在37℃,50 ml/L CO2孵箱静置培养,24 h后更换液体,以后2~3 d更换1次培养液,长满80%后离心10 min× 1000 r/min后弃去上清液加入10倍体积含10%新生牛血清的RMPI 1640培养基(含有双抗)后按1∶2~1∶6传代,于细胞对数生长期进行实验[3-6]。根据实验需要时间终止细胞培养,吸弃培养液,每孔加入MTT溶液20 μl(5 mg/ml),37℃孵育4 h,小心吸弃孔内培养液。每孔加入DMSO 150 μl,振荡10 min,使紫色结晶物充分溶解。全自动酶标仪测每组的吸光度A490值。
1.2.2.2 细胞接种及药物处理 椒莪软胶囊为0. 015625、0. 03125、0. 0625、0.125、0.25、0.5、1、2、4 mg/ml等剂量组,同时设阳性组为加入22.5 mg/kg氟尿嘧啶、对照组(不加抗癌药)和基质组(只加培养液),每组设8个复孔。各组继续培养至加药后15 h。低速离心 1000 r/min后弃去上清液
用培养液吹打成单细胞悬液,培养细胞,1×106个/孔接种于96孔培养板,37℃、50 ml/L CO2孵箱培养12 h,细胞贴壁后弃去培养液,根据不同的实验分组加入使其含不同浓度药物。根据8孔吸光度值A490的光密度(optical density,OD)值计算肿瘤细胞抑制率(inhibition ratio,IR),计算公式:IR=1-(用药组平均OD值-基质组平均OD值)/(对照组平均OD值-基质组平均OD值)×100%。IR标准采用1978年全国抗癌药物会议制定的《抗肿瘤药物通用指标》:IR<30%为不敏感,归阴性;IR≥30%为敏感,归阳性。
1.2.2.3 细胞凋亡检测 根据 MTT结果,将HepG2细胞用培养基适当释稀后,接种于75 ml玻璃培养瓶中,放在37℃,50 ml/L CO2孵箱静置培养,24 h后更换液体,以后2~3 d更换1次培养液,长满80%后离心10 min× 1000 r/min后弃去上清液加入10倍体积含10%新生牛血清的RMPI 1640培养基(含有双抗)后按 1∶2~1∶6传代,于细胞对数生长期进行实验。椒莪软胶囊0.0、6.25、12.5、25.0 μg/ml共4组,加药15 h;对照组不加抗肿瘤药。①收集细胞:收集细胞到10 ml的离心管中,1000 r/min离心5 min,每样本细胞数为1×106,弃去培养液;②用孵育缓冲液洗1次,1000 r/min离心5 min;③用100 μl的标记溶液重悬细胞,室温下避光孵育10~15 min;④ 1000 r/min离心5 min沉淀细胞,孵育缓冲液洗1次;⑤重复步骤③、④2次;⑥将细胞重悬于200 μl Binding Buffer(连接缓冲液);⑦加入10 μl Annexin V-FITC(细胞凋亡双染标记物)和5 μl PI(碘化吡啶核酸染料),轻轻混匀,避光室温反应15 min或4℃反应30 min;⑧加入300 μl Binding Buffer,在1 h内上流式细胞仪检测。利用流式细胞仪进行双参数分析,将凋亡细胞(Annexin V+)与继发性坏死细胞(Annexin V+/PI+)区分开,计算凋亡细胞的百分率。
1.3 统计学处理 采用SPSS 12.0统计软件处理,所得数据以均数±标准差(¯x±s)表示,组间比较采用t检验,P<0.05为有统计学意义。
2 结果
2.1 给药各组的瘤重、肿瘤抑制率和胸腺/脾脏指数 阳性组与小、中、大剂量组的瘤重分别为(0.78±0.31)g与(1.22±0.29)、(1.03±0.25)、(0.81±0.28)g,其肿瘤抑制率分别达48.71%、19.73%、32.22%、46.68%,阳性药物和椒莪软胶囊大剂量对小鼠S180荷瘤的抑制与对照组比较差异有统计学意义(P<0.01),中剂量和小剂量与对照组比较差异也有统计学意义P<0.05)。阳性组、大剂量组小鼠的胸腺/脾脏指数与模型组相比差异有统计学意义(P<0.05),中、小剂量组小鼠的胸腺指数/脾脏差异无统计学意义(P>0.05)。
2.2 不同剂量对小鼠肿瘤细胞病理形态的影响
对各组瘤块进行常规病理学检查显示:模型组为典型多形性细胞型横纹肌肉瘤;阳性组为成熟横纹肌,肌间见大量炎症细胞,周围为90%的肿瘤性坏死组织,在坏死组织中可见小量散在横纹肌肉瘤细胞;小剂量组70%~80%肿瘤细胞活跃生长,20%左右为肿瘤性坏死伴急性炎症;中剂量组40%~50%肿瘤细胞活跃生长,50%左右为肿瘤性坏死伴急性炎症;大剂量组20%~30%肿瘤细胞活跃生长,80%左右为肿瘤性坏死伴急性炎症。随着给药剂量的增加,坏死的肿瘤细胞所占比例也相应增加,生长活跃的肿瘤细胞逐渐减少(图1~5)。
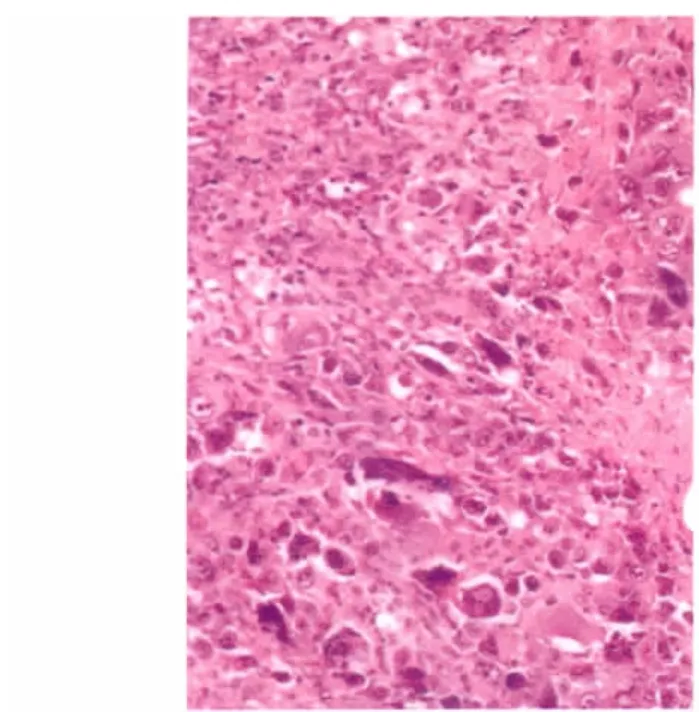
图1 模型组(HE×100)
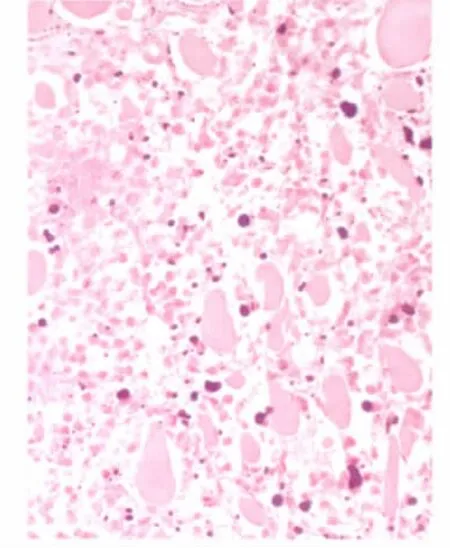
图2 阳性组(HE×100)

图3 小剂量组(HE×100)

图4 中剂量组(HE×100)
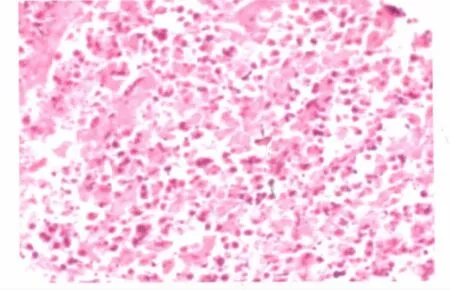
图5 大剂量组(HE×100)
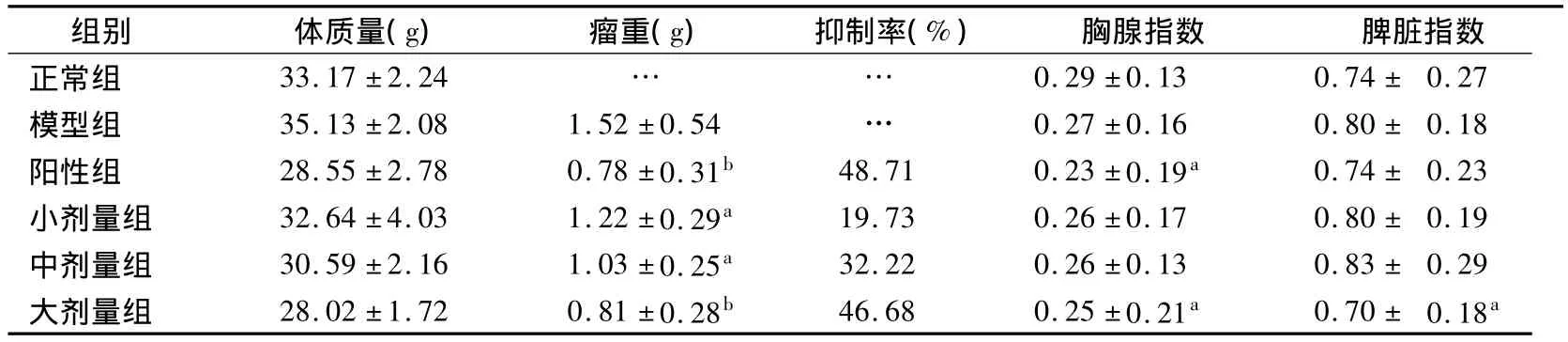
表1 不同浓度椒莪软胶囊对小鼠S180瘤株的影响(n=12,¯x±s)
2.3 体外抑瘤结果 人源性肝癌细胞株HepG2和大肠癌细胞株SW480对椒莪软胶囊敏感,椒莪软胶囊在0.125~4 mg/ml浓度范围内细胞有明显的抑制作用,抑制作用随剂量升高而作用增强。对人源性肝癌细胞株HepG2体外最低抑瘤浓度为0. 0625 mg/ml,浓度低于0. 0625 mg/ml几乎无抑瘤作用;对大肠癌细胞株SW480细胞体外最低抑瘤浓度为0.125 mg/ml,浓度低于0.125 mg/ml几乎无抑瘤作用(表2)。

表2 不同浓度椒莪软胶囊作用HepG2和SW480细胞15 h后MTT法检测结果(n=8,¯x±s,IR,%)
2.4 细胞凋亡 细胞凋亡及凋亡后死亡数量随着给药剂量的增加而增加。不同浓度的椒莪软胶囊(0.0、6.25、12.5、25.0 μg/ml)作用下,人源性肝癌细胞株HepG2凋亡细胞所占比例分别为3.5%、5.6%、12.3%和26.9%,死亡细胞所占比例分别为1.8%、1.8%、7.7%和13.2%(图6 ~9)。
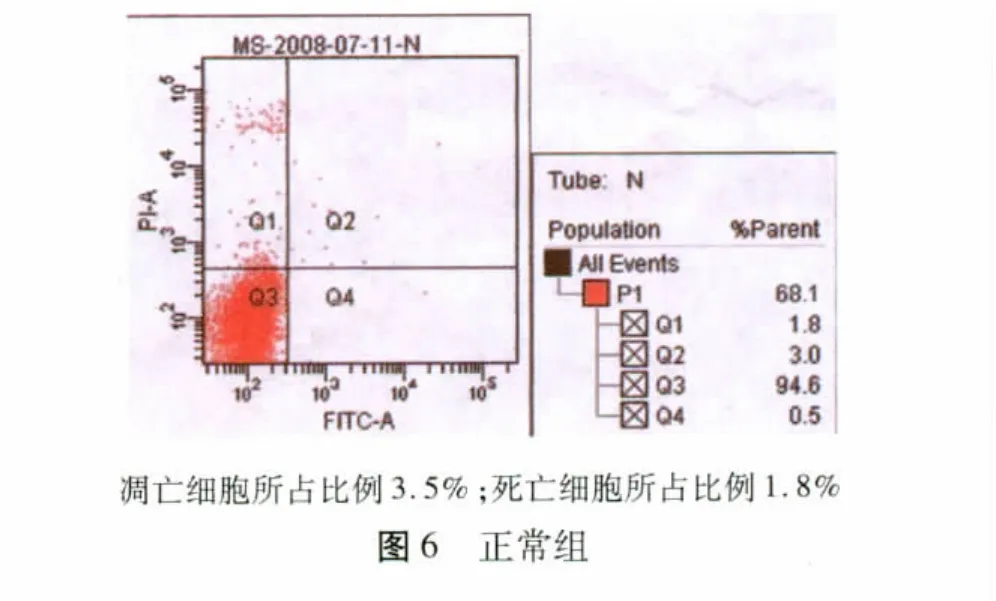
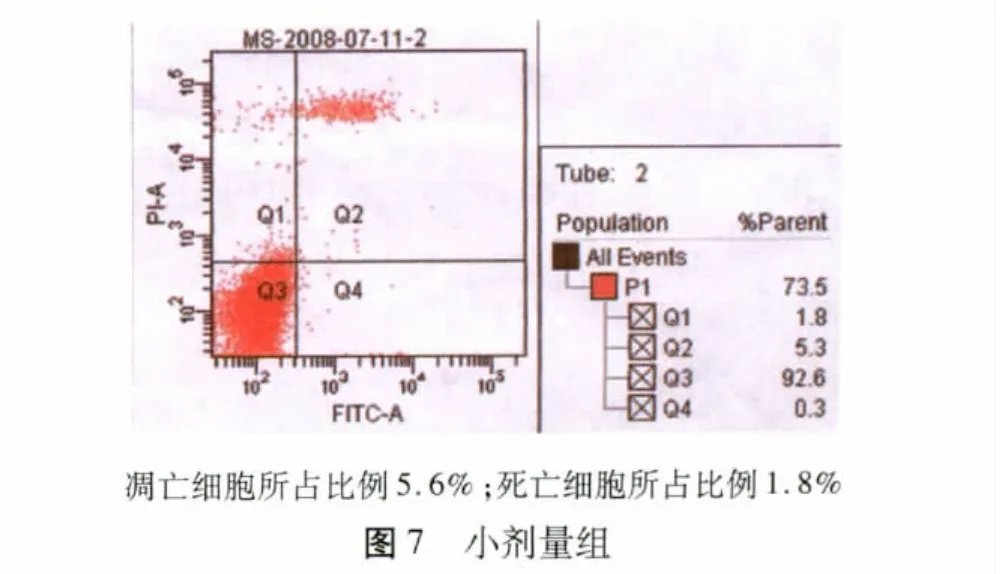
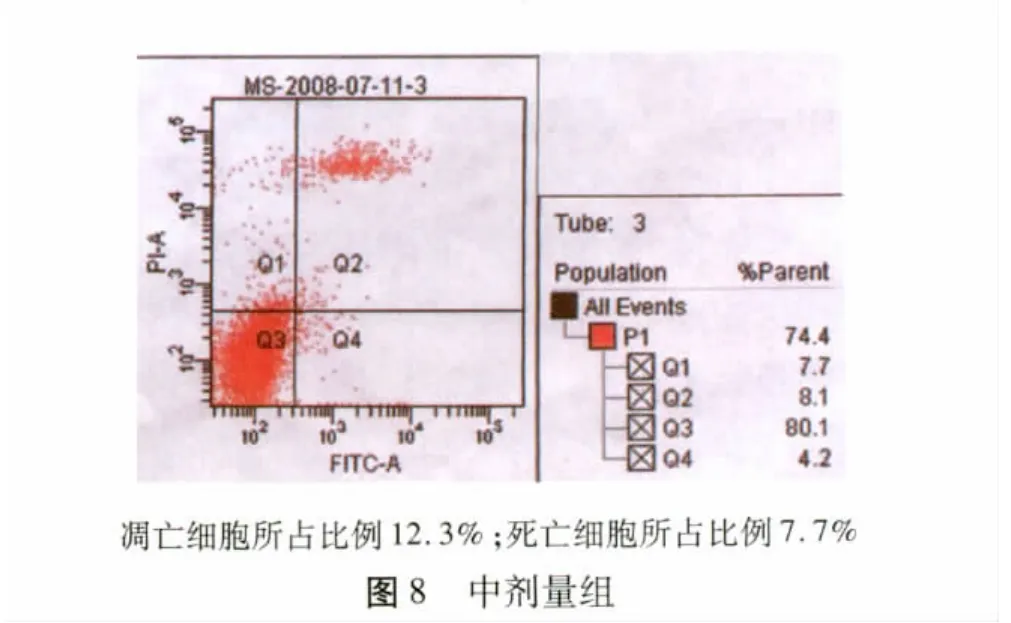
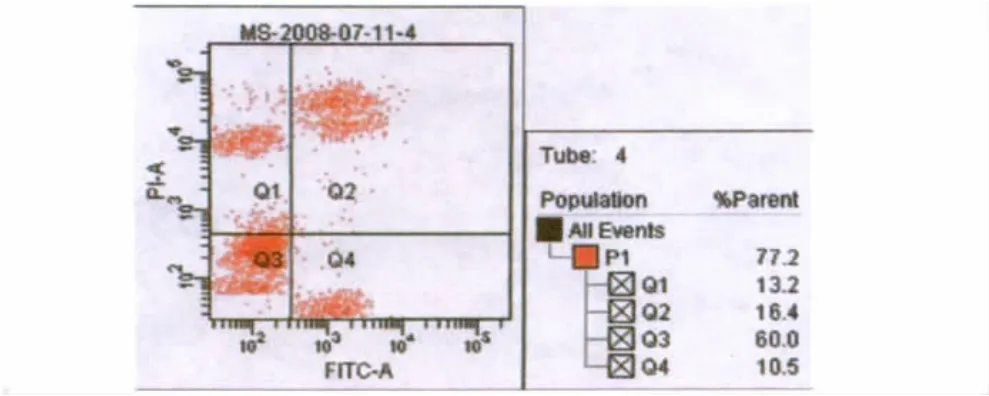
图9 大剂量组
3 讨论
在体内椒莪软胶囊对小鼠移植性肿瘤S180的生长有显著抑制作用,阳性组与小、中、大剂量组的瘤重分别为(0.78±0.31)g与(1.22±0.29)、(1.03±0.25)、(0.81 ±0.28)g,其肿瘤抑制率分别达48.71%、19.73%、32.22%、46.68%,与模型组相比有统计学意义(P<0.01),同剂量呈正相关;病理图片所示与上述实验结果基本相符,随着给药剂量的增加,坏死的肿瘤细胞所占比例也相应增加,生长活跃的肿瘤细胞逐渐减少,给药剂量与活跃肿瘤细胞成反比例关系,阳性药、椒莪软胶囊中、大剂量组作用效果十分明显。同时,各剂量组小鼠的体质量没有明显的下降,说明在给药剂量范围内椒莪软胶囊还未能抑制荷瘤小鼠体质量降低。由于周期较短,仅为15 d,故未能观察小鼠生存时间。
抑制作用随剂量升高而作用增强,对人源性肝癌细胞株HepG2,体外最低药物物浓度为0. 0625 ng/ml;对大肠癌细胞株SW480,体外最低药物浓度为0.125 mg/ml。椒莪软胶囊抑制肿瘤细胞生长效应与其浓度呈线性关系,只有保持一定的血药浓度,才能更好地发挥抗瘤作用。椒莪软胶囊可明显促进人源性肝癌细胞株HepG2细胞凋亡。实验条件对结果有很大影响,实验中控制好实验条件尤为重要。
国内外文献报道,莪术油和椒目仁油都含有一定的抗肿瘤活性成分,如莪术油中含有β-榄香烯,而椒目仁油中则含有α-亚麻酸等,其各自成分的作用将是今后一个重点研究方向。在实验的基础上,可设计莪术油组,椒目仁油组,不同比例混合油组等进行药效学研究,并对比治疗效果,找出两种药油之间的关系,达到优化处方的目的。
综上所述,椒莪软胶囊具有较强的体内和体外抗肿瘤作用的活性,其作为中药制剂用来治疗肿瘤可能具有其独特的优势。如果对给药剂型及给药剂量进行深层次研究或优化配方,可以降低其不良反应,进一步增强抗肿瘤作用,可能使椒莪软胶囊具有更加可靠的临床应用价值。
[1]徐海燕,林能明,徐利,等.芍药软肝方对 H22肝癌、S180肉瘤荷瘤小鼠抑瘤作用研究[J].中国肿瘤,2011,20(11):850-854.
[2]冯刚,黄涛,卢宏达,等.莪术油注射液对小鼠移植性S180肉瘤血管形成的抑制作用[J].肿瘤研究与临床,2005,17(4):233-235.
[3]李仪奎.中药血清药理学实验方法的若干问题[J].中药新药与临床药理,1999,10(2):95-98.
[4]赵婷秀,陈振发.中药血清药理学方法的研究现状[J].湖北中医学院学报,2003,5(3):45-46.
[5]范敏,徐畅,李彦,等.重组人胰岛素样生长因子1的原核可溶性表达及活性鉴定[J].生物技术通讯,2011,22(6):827-830.
[6]孙卫国,王芳,刘农乐,等.MTT实验检测重组人角质细胞生长因子-2诱导不同细胞系增殖的差异[J].生物技术通讯,2011,22(2):225-228.
The inhibition effect of transplanted mice tumor with curcuma oil compatibility from Seed oil
XIE Yan-hua,HE Zhong-min,YANG Qian,MIAO Shan,BI Lin-lin,SUN Ji-yuan,WANG Si-wang
(Department of Natural Medicine,School of Medicine,Fourth Military Medical University,Xi’an 710032,China)
ObjectiveTo observe the inhibitory effect of different doses of Curcuma oil compatibility from Seed oil in mice transplanted tumor S180,as well as the in vitro inhibitory effect of human-derived HepG2 cells and colon carcinoma cell line SW480.MethodsSeventy two Kunming mice with tumor xenografts established mouse tumor-bearing animal models.Jiaoe soft capsules administered orally at doses of 0.3,0.6 and 1.2 ml/kg,fluorouracil with 22.5 mg/kg abdominal injection as positive control,administration for 15 days to observe the inhibitory effect of drugs on tumor growth.The preparation of different doses of pepper to Curcuma soft capsules(0. 015625,0. 03125,0. 0625,0.125,0.25,0.5,1,2,4 mg/ml)containing fluorouracil-positive serum and tumor transplantation control group without serum,to observe role of serum inhibition in human derived hepatoma cell line HepG2 and colon cancer cell line SW480 by tetrazolium bromide colorimetric.Jiaoe soft capsules administered 15 h after the impact of human-derived HepG2 at doses of 0.0,6.25,12.5,25.0 μg/ml,cell apoptosis measured by flow cytometry.Results①Jiaoe soft capsules at doses of 0.3,0.6,1.2 ml/kg,the tumor inhibition rates were 19.73%,32.22%and 46.68%respectively.With the increase of the dose,the proportion of the tumor necrosis increased and the active tumor cells decreased gradually.②The inhibition role increased with the doses raising.In vitro minimum drug concentration for by human-derived hepatoma cell line HepG2 was 0. 0625 mg/ml,for strains of SW480 colon cancer cells it was 0.125 mg/ml.③The Jiaoe soft capsule can significantly promote apoptosis of human-derived HepG2 cells.ConclusionJiaoe soft capsule significantly inhibits the mice transplanted tumors by human-derived HepG2 cells and colon carcinoma cell line SW480.Jiaoe soft capsules in clinical practice has broad application prospects.
Jiaoe soft capsule;Anti-tumor;Human hepatoma HepG2 cells;Colorectal carcinoma SW480 cells;Apoptosis
R73;R285.5;R730.52
A
2095-3097(2012)01-0008-05
10.3969/j.issn.2095-3097.2012.01.003
陕西省科学技术研究发展计划项目(2008k10-02)
710032陕西西安,第四军医大学药学院天然药物学教研室(谢艳华,贺中民,杨 倩,缪 珊,毕琳琳,孙纪元,王四旺)
王四旺,E-mail:wangsiw@fmmu.edu.cn
2012-03-31 本文编辑:徐海琴)

