CT引导下髓核钳取技术制备犬椎间盘退变模型的实验研究
石志远,顾 韬,张 超,王德利,阮狄克
CT引导下髓核钳取技术制备犬椎间盘退变模型的实验研究
石志远,顾 韬,张 超,王德利,阮狄克
目的 探索CT引导下使用活检枪髓核钳取技术构建犬椎间盘退变模型可行性,比较不同型号活检枪制备犬椎间盘退变模型效力。方法 选取6只1岁龄雌性杂种犬。将犬腰1-2、腰3-4及腰5-6椎间盘纳入退变模型制备实验研究,并行随机分组。A组使用18号活检枪;B组使用20号活检枪;C组使用24号活检枪。行经皮椎间盘穿刺。术后4周及12周分别行核磁及数字平片检查,评估各组椎间盘高度变化及髓核含水量状态;术后12周处死动物,行组织学分析。结果 每组取出髓核组织量A组(3.0±0.53)mg、B组(2.01±0.34)mg和C组(3.0±0.53)mg。平均操作时间为1.4 h;出血量为5~10 ml。术前椎间盘高度数测量做为基线,3组间高度比较无明显差别(P>0.05)。术后3组椎间盘高度均有不同程度降低,但组内差异及同一时间点组间差异无统计学意义(P>0.05)。3组中,MRI相对信号强度均出现下降,与术前对比无统计学差别(P>0.05)。术后第12周,A组MRI相对信号强度出现明显下降,与B组和C组相比下降程度具有统计学意义(P>0.05);与术前相比,术后第12周A组和B组降低程度均有统计学意义(P<0.05)。结论 CT引导下活检枪髓核钳取技术可用于犬椎间盘退变模型制备;20号活检枪制备的退变模型在12周观察期内显示出较为缓和、重复性高、可信性强的退变进程,适用于椎间盘退变生物治疗研究。
椎间盘退变;相对灰度指数;动物模型
椎间盘退行性疾病在世界各国发病率均较高,加重各国医疗经济负担,减少社会平均劳动时间并降低患者生活质量。尽管已有多种治疗策略应用于该疾病及相关疾病的治疗,但其疗效仍然有限[1-2]。随着新的治疗策略的不断开发,适合于检验新治疗方法疗效的椎间盘退行性疾病动物模型的开发也势在必行。目前,纤维环损伤诱导椎间盘退变的动物模型被广大的研究机构及学者所接受[3-5]。然而,模型制备方式多选择开放手术直视下损伤纤维环结构引发椎间盘退变,这种方式不仅增加了实验动物死亡风险、延长术后康复时间,而且存在椎间盘髓核急性突出及严重退变的可能。CT引导下经皮穿刺活检术作为一种安全、可靠、成熟的临床应用技术已广泛应用于临床病理诊断[6]。因此我们设想采用该技术,通过CT三维定位,经皮穿刺进入髓核组织,钳取一定量的髓核组织,以此来诱导椎间盘退变进程的发生,从而探索髓核钳取技术制备椎间盘退变动物模型的可行性。
1 材料和方法
1.1 实验材料 杂种犬6只(海军总医院动物实验中心),电子计算机X射线断层扫描机(Philips,美国),盐酸氯胺酮注射液(江苏恒瑞,中国),咪达唑仑注射液(宜昌人福,中国),活检枪(Quickcore,美国),电子天平(上海天平仪器,中国),数字X线成像仪(Siemens,德国),核磁共振扫描仪(Signa Horizon,美国),福尔马林(4%甲醛配置),EDTA脱钙液(舜百,中国),倒置相差显微镜(Olympus,日本)。
1.2 动物选取 6只1岁龄雌性杂种犬,体质量10~12 kg,由海军总医院动物实验中心提供,并在制备椎间盘退变模型前隔离检疫10 d。实验前行核磁及数字平片检测,剔除脊柱结构异常及已发生的椎间盘退变的实验动物。动物实验经伦理委员会核准[SYXK(军)2002-011],实施于海军总医院动物实验中心。
1.3 CT引导下制备犬椎间盘退变模型 将犬腰1-2(L1-2)、腰3-4(L3-4)及腰5-6(L5-6)椎间盘纳入退变模型制备实验研究,并行随机分组。A组使用18号活检枪;B组使用20号活检枪;C组使用24号活检枪。
使用氯胺酮(10 mg/kg)和咪达唑仑(0.5 mg/kg)对实验动物进行麻醉诱导后,对犬左侧腰背部皮肤进行备皮,显露皮肤面积30 cm×15 cm,并放置定位线,行犬腰椎薄层 CT扫描(层厚0.625 mm),三维重建显示犬腰1椎体至腰7椎体。确定L1-2、L3-4及L5-6椎间盘平面后,根据定位线位置确定入针角度、深度及入针点。定位完成后,退出检查床,移除定位线,于入针点周围5 cm×5 cm区域内行碘伏消毒(3次),铺洞巾,根据已确定入针点、入针角度及深度,使用活检枪行经皮椎间盘穿刺。出现突破感后,停止穿刺,CT扫描确定活检枪位置位于椎间盘内后,撤出活检枪1 cm,同时推出活检取材针芯,钳取椎间盘髓核组织,电子天平称重。以此方法分别使用不同型号活检针对各组间盘进行穿刺钳取髓核组织操作。失血量、操作时间、钳取髓核组织重量及术中、术后并发症均详细记录。6只动物均在同一实验条件下进行穿刺。
术后4周及12周分别行核磁及数字平片检查,评估各组椎间盘高度变化及髓核含水量状态;于术后12周处死动物,收集各组样本行组织学分析。
1.4 影像学分析 基于数字X线影像学技术,椎间盘高度变化使用“三中线法”进行测定[7]。于犬腰椎侧位数码X线片上确定实验节段,确定包含实验椎间盘的最上端及最下端椎体,本实验为腰1椎体至腰6椎体,设定腰1椎体最上端前缘及后缘及腰椎体最下端前缘及后缘为标志点,分别于椎体前后缘绘制平行直线 (图1)。将2条平行线的之间距离等分3份,分别另行绘制直线A、B和C。3条直线分别于椎间盘上下缘与椎体交汇,形成D、E和F线段,通过电脑软件(Photoshop 7.0,Adobe)对线段D、E和F进行测量,取平均值(D+E+F)/3。

图1 三中线法测量椎间盘高度
MRI中,T2加权像可反映组织中的水化状态,在本实验中,用于连续、无创观察髓核含水量的变化,间接反映椎间盘退变程度。使用Photoshop软件工具,获得T2相椎间盘灰度值,与相同节段水平脑脊液线灰度进行对比,获得标准化相对灰度指数(relative grayscale index,RGI)[8]。数据测量由经验丰富的2名独立观察人员完成,并分别记录。
1.5 组织学分析 实验动物于术后观察3个月。
到达观察期后,实验动物在麻醉状态下处死,获得各组椎间盘样本,包括髓核、纤维环、上下软骨终板和少量终板下骨。样本组织浸泡于福尔马林溶液(4%甲醛)1周后,放入脱钙液(20%EDTA)中进行脱钙处理1个月。终板下骨软化后,进行脱水、石蜡包埋。于石蜡切片机上,切去6 μm厚组织切片行苏木素和伊红染色(hematoxylin and eosin,HE),分别显示细胞构成及蛋白多糖含量变化。
1.6 统计学处理 统计分析采用SPSS 16.0软件。计量资料以均数±标准差(¯x±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 实验动物术后基本情况 在椎间盘退变模型制备过程中,每组取出髓核组织量分别为A组(3.0±0.53)mg、B组(2.01±0.34)mg和 C组(3.0±0.53)mg;平均操作时间为1.4 h;出血量为5~10 ml。有2只动物在术中及术后均出现程度不一的神经损害征象,显示左侧后肢跛行。其中,1只动物跛行状态在术后2周后逐渐缓解;另1只动物于观察期满后,跛行状态仍未见明显改善。术后无明显感染迹象发生。经过3个月的观察期,实验动物于麻醉状态下处死,每组获得实验样本6个(表1)。

表1 样本数量分布
2.2 椎间盘高度 数字X线数据采集于术前、术后4周及术后12周,共3个时间点(图2)。术前椎间盘高度数测量做为基线,3组间高度无明显差别(P>0.05)。术后3组椎间盘高度均有不同程度降低,但组内差异及同一时间点组间差异无统计学意义(P>0.05)。
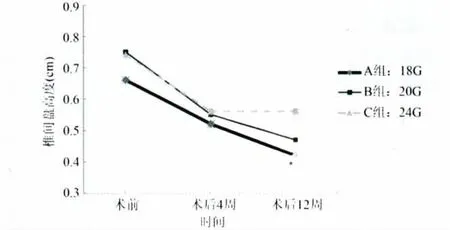
图2 椎间盘高度变化
2.3 椎间盘相对灰度指数 矢状位髓核中心MRI资料采集于术前、术后4周及术后12周,共3个时间点(图3)。术后第4周,3组中,RGI与术前对比,不具有统计学差别(P>0.05)。术后第12周,A组RGI出现明显下降,与B组和C组相比,下降程度具有统计学意义(P<0.05);B组与C组间,RGI下降程度无明显统计学差异(P>0.05)。与术前相比,术后第12周A组和B组降低程度均有统计学意义(P<0.05);而C组RGI降低程度无统计学意义(P>0.05)。结合改良Pfirrmann分级,在第12周时,A组椎间盘髓核信号明显降低,椎间盘高度降低接近30%,可归为5~6级;B组椎间盘髓核信号虽有降低,但明显高于椎间盘纤维环外层信号强度,可归为3~4级;C组椎间盘髓核信号无明显改变,接近脑脊液强度,高度亦无改变,归为1级。
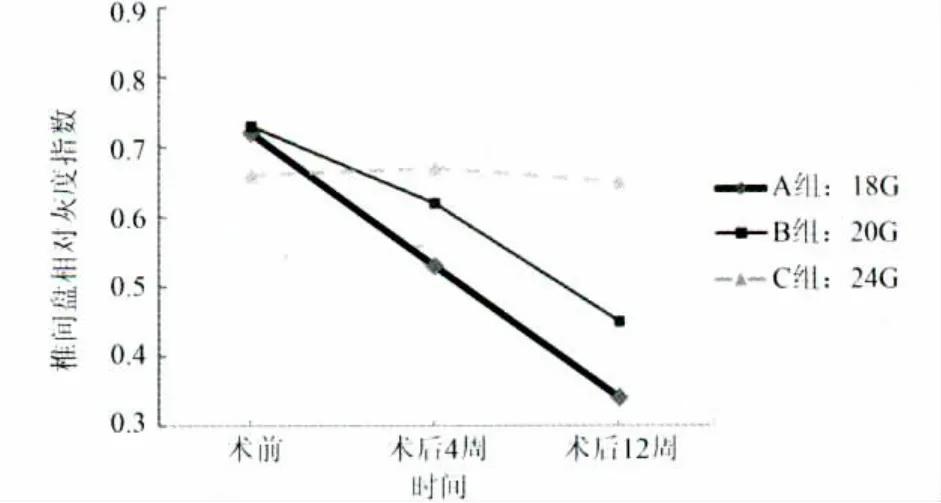
图3 椎间盘相对灰度指数
2.4 组织病理学检查 术后12周,获取椎间盘组织样本行组织学染色及分析。HE染色显示,A组内终板结构较为完好,但髓核含量下降,类软骨样髓核细胞明显减少,取而代之的是体积较小、基质分泌功能低下的软骨细胞。且内层纤维环结构松散,髓核基质中蛋白多糖含量下降,终板与髓核组织交接区域可见纤维结缔组织形成(图4A),退变程度处于ThompsonⅢ级。B组椎间盘髓核含量无明显改变,HE染色显示深蓝色,髓核内蛋白多糖成分含量较高。HE染色显示髓核内细胞数量较多,体积大;终板结构完整,终板内软骨细胞无明显增生;但终板组织延伸入纤维环结构及髓核组织内,椎间盘结构开始改变(图4B),退变程度处于ThompsonⅡ级。C组内髓核组织、纤维环及终板结构完整,类软骨样髓核细胞数量较多,细胞外基质蛋白多糖含量丰富,无明显椎间盘退行性改变(图4C)。

图4 组织学分析(上图×10,下图×40)
3 讨论
实验结果表明,CT引导下经皮髓核钳取技术可诱导犬椎间盘退变的出现。经过影像学及组织学分析,20号活检枪可适合于制备退变较为缓和、重复性高的椎间盘退变模型。尽管18号活检枪亦可诱发椎间盘退变,并且无急性髓核突出,但椎间盘退变速度较快,程度较为严重。经过18号活检枪处理后,椎间盘在术后3个月内,髓核MRI T2信号降低超过50%,同时终板结构也有改变,改良Pfirrmann分级至5~6级,可归为中晚期退变,不适用于椎间盘退行性疾病治疗方法的模型,尤其不适用于生物治疗。与之相反,在24号活检枪组中,椎间盘内结构、细胞组成均无明显异常改变,这可能需要较长的观察期,故亦不是良好的椎间盘退变模型。
由学者Lipson等[9-10]描述的经典纤维环损伤模型,是使用11号刀片对纤维环进行全层损伤。在损伤后4周,髓核组织即被纤维软骨样组织所替代。这可能是由于损伤后,应力作用使髓核组织的通过损伤通道发生急性突出,周围软骨细胞、纤维环细胞增生修复形成纤维软骨样组织[11-13]。本实验中,虽然各组移除髓核组织质量不同,但在术后4周复查核磁可见各组间髓核组织水合程度无明显差异。可能有以下3点原因:①髓核钳取量较少,MRI无法检测;②髓核钳取区域并非位于椎间盘中央矢状位平面;③术后无明显急性椎间盘髓核突出发生。尽管如此,在A组中,位于纤维环内通向髓核的活检枪通道,在大体标本中仍清晰可见,其间由纤维结缔组织填充。提示在纤维环损伤模型中,椎间盘髓核组织有可能会发生慢性突出。在一项关于猪的退变椎间盘体外生物力学研究中,Wang等[13]发现当穿刺针型号超出22号,椎间盘髓核出现不可控的泄漏概率明显增加。在本研究中18号和20号活检枪实验组髓核泄漏发生率较低,可能是由于:①髓核钳取后,椎间盘内压力降低;②样本数量较少;③物种间的差异。
CT导航技术在制备椎间盘退变的应用中,可有效降低主观偏倚引发的椎间盘节段定位错误。开放性手术中,椎间盘节段定位多利用下端的髂骨翼和(或)上端的末节肋椎关节解剖结构[14]。物种内差异或各体变异可增加此种定位方式失败概率;使用较大的手术切口充分显露上、下端的解剖结构,增加胸膜损伤及大出血的风险,也会延长动物术后康复时间。另外,侧卧位时,动物呈弓形状态,各节段椎间盘并非平行排列,借助CT导航技术,穿刺入针点,入针角度及深度均可以得到保障,而避免不必要的损伤;直视下,操作者需要根据经验提供相对正确的穿刺通道,保证穿刺针垂直进入纤维环,而不伤及终板组织。在本研究中,A组有1例发生椎间盘终板损伤,提示除了髓核泄漏,穿刺针的型号过大还可增加终板损伤概率。
在本研究中我们提出一项较为直观、可量化的指标——髓核钳取质量,用于预测和评估椎间盘退变进程,增强动物模型制备的可重复性。该研究中,在制备椎间盘退变模型时,将钳取出的髓核组织进行称重,分别为A组(3.00±0.53)mg、B组(2.01±0.34)mg和C组(3.00±0.53)mg。将其与模型制备后12周时的MRI对信号强度进行相关性分析,得出两者成负相关的结果(r=-0.766)。虽然活检枪的直径对椎间盘退变进程也存在一定的影响,但是这一结果为我们进一步探讨椎间盘退变可控性动物模型制备提供了新的思路。但是钳取髓核治疗指标也存在不足之处,不同动物间及相同动物不同节段间,髓核含量均不相同,钳取相同的髓核量也可导致不同程度的退变。钳取髓核治疗与间盘整体髓核质量之比可能是更好的指标,但是目前仍无有效手段可对活体内椎间盘髓核质量进行无创化测定。
目前,常用的纤维环损伤模型多是通过控制穿刺深度或穿刺后真空抽吸时间来保证椎间盘退变动物模型制备的可靠性及可重复性。分析认为:纤维环针刺退变模型的制备需要的穿刺针直径应大于40%椎间盘高度[15]。在一项关于大鼠椎间盘退变模型研究中[16],21号皮下注射针被用于制作纤维环损伤,并且控制损伤深度于5 mm,避免椎间盘的结构急性改变及由此引发的创伤性椎间盘退变。但是大型号的穿刺针可增加髓核泄漏及终板损伤概率,因此需要在诱发椎间盘退变与更为合理的穿刺针型号选择中寻求平衡。本研究中使用的活检枪型号由18~24号,口径为1.2 mm至0.55 mm,占犬椎间盘高度的8%~17%。尽管口径尚未达到椎间盘高度40%,在A组的1例样本中仍出现了髓核泄漏现象。Sakai等[17]在探索制备兔椎间盘退变针刺模型研究中,使用21号针头,连接10 ml注射器,在针头穿刺进入椎间盘髓核组织后,在一定时间内保持注射器内负压状态,对髓核组织进行抽吸。然而随后的实验研究证明,这种髓核抽吸方式引发的椎间盘退变速度过快,程度过于严重[7]。本研究使用活检枪钳取少量的髓核组织,实验组B组,使用20号活检枪,在术后第12周,影像学显示MRI T2信号轻度降低;组织学显示椎间盘内结构基本完整,内侧纤维环结构发生改变,髓核内蛋白多糖含量无明显降低。我们认为该组椎间盘基本处于退变早中期,更适合于椎间盘退变模型制备。
椎间盘退变的生物治疗需要处于早中期退变的动物模型。在本研究中,虽然A组的椎间盘高度在3个月的观察期内未有明显降低,但其MRI T2信号提示该组椎间盘退变处于中晚期改变。我们考虑,影像学结果差异可能是由于犬脊柱受力方式不同于人类,犬的脊柱很少受到轴向压力,使得椎间盘高度变化滞后于髓核含水量的变化。由于A组椎间盘上下终板出现异常改变,提示椎间盘营养通道受损,可能严重干扰生物治疗实验结果。因此,18号活检枪不适于犬椎间盘退变模型的制备。
CT导航下髓核钳取技术仅适用于体型较大的哺乳动物(犬、羊)。因为在活检枪穿刺进入椎间盘后需要保证活检针芯完全进入髓核组织区域,以保证每次钳取髓核质量保持一致。另外,由于犬可分为软骨缺陷型及非软骨缺陷型两类,1岁龄的两种犬内具有不同髓核结构及细胞成分,钳取髓核组织不具有可比性,因此本研究均使用非软骨缺陷型杂种犬。另外,本研究选取间隔节段间盘为实验对象,以避免相邻间盘退变诱发的“临椎效应”。学者Sobajima等[18],在椎间盘退变研究中发现,在退变节段的相邻节段椎间盘亦出现核磁信号的降低。该现象并未在本研究中出现,可能归结于:①较短的观察期;②间隔节段退变,分散应力分布。
虽然该技术降低了出血风险及术中术后并发症,但该技术受到定位准确性、操作技术的限制,操作时间与开放手术有明显差异。犬的皮肤与皮下组织结合较为疏松,在穿刺时可能活检枪在进入皮下组织后可能出现偏移,影响穿刺准确性,并延长穿刺时间,增加终板损伤概率,需要在实验前进行预实验,提高操作技术完成学习曲线。此外,CT扫描对实验人员及实验动物的损害作用,需要在操作时做好防护工作。
4 结论
本研究通过CT三维定位,经皮穿刺进入髓核组织,钳取髓核组织,诱导椎间盘退变进程的发生。研究证实在CT导航下可使用活检枪制备犬椎间盘退变模型,并通过影像学及组织学分析证明20号活检枪是制备犬椎间盘退变模型的理想选择,为探索新的椎间盘退变生物治疗治疗方法奠定基础。
[1]Hwang SL,Hwang YF,Lieu AS,et al.Outcome analyses of interbody titanium cage fusion used in the anterior discectomy for cervical degenerative disc disease[J].J Spinal Disord Tech,2005,18(4):326-331.
[2]Chan DD,Khan SN,Ye X,et al.Mechanical deformation and glycosaminoglycan content changes in a rabbit annular puncture disc degeneration model[J].Spine(Phila Pa 1976),2011,36(18):1438-1445.
[3]Mwale F,Masuda K,Pichika R,et al.The efficacy of Link N as a mediator of repair in a rabbit model of intervertebral disc degeneration[J].Arthritis Res Ther,2011,13(4):R120.
[4]Masuda K,Aota Y,Muehleman C,et al.A novel rabbit model of mild,reproducible disc degeneration by an annulus needle puncture:correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J].Spine(Phila Pa 1976),2005,30(1):5-14.
[5]Wei A,Williams LA,Bhargav D,et al.BMP13 prevents the effects of annular injury in an ovine model[J].Int J Biol Sci,2009,5(5):388-396.
[6]Pombo F,Rodriguez E,Martin R,et al.CT-guided coreneedle biopsy in omental pathology[J].Acta Radiol,1997,38(6):978-81.
[7]Kim KS,Yoon ST,Li J,et al.Disc degeneration in the rabbit:a biochemical and radiological comparison between four disc injury models[J].Spine(Phila Pa 1976),2005,30(1):33-37.
[8]Ruan D,He Q,Ding Y,et al.Intervertebral disc transplantation in the treatment of degenerative spine disease:a preliminary study[J].Lancet,2007,369(9566):993-999.
[9]Lipson SJ,Muir H.1980 Volvo award in basic science.Proteoglycans in experimental intervertebral disc degeneration[J].Spine(Phila Pa 1976),1981,6(3):194-210.
[10]Lipson SJ,Muir H.Vertebral osteophyte formation in experimental disc degeneration.Morphologic and proteoglycan changes over time[J].Arthritis Rheum,1980,23(3):319-324.
[11]Sheikh H,Zakharian K,De La Torre RP,et al.In vivo intervertebral disc regeneration using stem cell-derived chondroprogenitors[J].J Neurosurg Spine,2009,10:265-272.
[12]Urban PG,Roberts S,Ralphs JR.The nucleus of the intervertebral disc from development to degeneration[J].Am Zool,2000,40:53-61.
[13]Wang JL,Tsai YC,Wang YH.The leakage pathway and effect of needle gauge on degree of disc injury post anular puncture:a comparative study using aged human and adolescent porcine discs[J].Spine(Phila Pa 1976),2007,32(17):1809-1815.
[14]Kong MH,Do DH,Miyazaki M,et al.Rabbit Model for in vivo Study of Intervertebral Disc Degeneration and Regeneration[J].J Korean Neurosurg Soc,2008,44(5):327-333.
[15]Elliott DM,Yerramalli CS,Beckstein JC,et al.The effect of relative needle diameter in puncture and sham injection animal models of degeneration[J].Spine(Phila Pa 1976),2008,33(6):588-596.
[16]Zhang H,Yang S,Wang L,et al.Time course investigation of intervertebral disc degeneration produced by needlestab injury of the rat caudal spine:oaboratory investigation[J].J Neurosurg Spine,2011,15(4):404-413.
[17]Sakai D,Mochida J,Iwashina T,et al.Differentiation of mesenchymal stem cells transplanted to a rabbit degenerative disc model:potential and limitations for stem cell therapy in disc regeneration[J].Spine(Phila Pa 1976),2005,30(21):2379-2387.
[18]Sobajima S,Kompel JF,Kim JS,et al.A slowly progressive and reproducible animal model of intervertebral disc degeneration characterized by MRI,X-ray,and histology[J].Spine(Phila Pa 1976),2005,30(1):15-24.
Computed tomography guided nucleus pulposus biopsy for canine intervertebral disc degeneration preparation:a radiology and histology
SHI Zhi-yuan,GU Tao,ZHANG Chao,WANG De-li,RUAN Di-ke
(Department of Orthopedics,Navy General Hospital,Beijing 100048,China)
ObjectiveTo apply a minimal invasive method in disc degenerative disease animal model preparation with biopsy gun assisted with CT scan,and evaluate the accuracy,efficiency of this process with radiology and histology analysis.MethodsThe canine intervertebral disc of lumbar 1-2,lumbar 3-4,and lumbar 5-6 was divided into 3 groups randomly.Group A:18 Gauge of biopsy gun,Group B:20 Gauge of biopsy gun,Group C:24 Gauge of biopsy gun.After the lumbar spine scanned with CT,a certain volume of nucleus pulposus tissue was removed by the biopsy gun.Radiology examination was carried out at preoperation,4 weeks and 12 weeks postoperation.Each sample was harvested at 12 weeks postoperation for histology evaluation.ResultsIn the percutaneous biopsy procedure,the weight of NP tissue was removed:(3.0±0.53)mg in Group A,(2.01±0.34)mg in Group B,and(0.99)±0.12 mg in Group C.During the observation period,no significant differences in disc height were found between groups at each time point(P>0.05).The signal intensity of MRI was reduced significantly(P<0.05)in Group A when compared with Group C at 12 weeks,and decreased content of nucleus pulposus,the number of nucleus pulposus cells and the loose of annulus fibrous at the inner area was observed at both HE and Saforini-O staining in Group A at 12 weeks.ConclusionCT-guided percutaneous biopsy could be applied in intervertebral disc degeneration preparation of canine model.20 G biopsy gun would be the optimal choice in this procedure.
Disc degeneration;Relative grayscale index;Animal model
R681.5-332;R814.42
A
2095-3097(2012)01-0017-05
10.3969/j.issn.2095-3097.2012.01.005
100048北京,海军总医院(石志远,顾 韬,张 超,王德利,阮狄克)
阮狄克,E-mail:ruandike@yahoo.com.cn
2012-06-12 本文编辑:冯 博)

