二氧化铅粉末多孔电极处理氨氮废水的研究
朱艳,汪家权* ,陈少华,徐建华,胡洁
1.合肥工业大学资源与环境工程学院,安徽 合肥 230009
2.南京大学环境学院,污染控制与资源化国家重点实验室,江苏 南京 210046
近年来,由于氨氮废水的无组织排放,加剧了湖泊、河流、水库等的水体富营养化,水生生态环境屡遭破坏,水质恶化,居民的饮水安全屡受威胁。目前,氨氮废水的处理方法主要包括离子交换法、氨吹脱法、电化学法、活性污泥法、生物膜法等[1]。其中,电化学法是一种高效的污水处理方法,由于其占地少、操作简单、不出现二次污染等特点,备受各国学者关注[2-5]。在所研究的电极材料中,PbO2电极具有氧化能力强、导电性好、耐腐蚀性好、价格低廉等优点,因而是一种良好的电催化材料。
目前,PbO2电极的制备方法主要有电沉积法、高压塑片法、涂膏法等。大多学者致力于电沉积制备的条件、基底的材料以及掺杂改性等方面的研究,目的是进一步提高PbO2电极的活性及稳定性[6-8]。笔者采用高压塑片法制备掺杂石墨+活性炭混合粉体的PbO2粉末多孔电极,并以氨氮模拟废水为处理对象进行试验,探究该改性电极的催化活性和电催化降解氨氮废水的工艺条件及相关机理。
1 材料与方法
1.1 材料
试验所用仪器包括YAW-4206微机控制全自动压力机(上海新三思计量仪器制造有限公司);HF-2压片模具(天津天光光学仪器厂);KXN-1003D直流稳压电源(深圳兆信电子仪器设备厂);722E型分光光度计(上海精密科学仪器有限公司);FA/JA电子天平(上海精密科学仪器有限公司);DELTA-320pH〔计梅特勒-托利多仪器(上海)有限公司〕;CHI-660C电化学工作站(上海辰华电化学仪器厂);Sirion200扫描电镜(FEI)等。试验所用试剂包括 Pb(Ac)2,NaClO,无水 Na2SO4,(NH4)2SO4,NaCl,NaOH,H2SO4,聚四氟乙烯乳液(浓度60%),石墨粉,粉状活性炭粉等,均为分析纯试剂。
1.2 试验方法
1.2.1 电极制备
PbO2粉末的制备:将10 g的Pb(Ac)2溶于20 mL水中,用NaOH调节pH为9.0~10.0,待溶解完全后加入80 mL NaClO,并搅拌均匀。在90℃条件下反应约6 h后,过滤、洗涤、干燥,所得沉淀即为深棕色的 β -PbO2粉末[9]。
PbO2电极的制备:称取一定质量的上述PbO2粉末,在其中分别掺入适量石墨+活性炭混合粉体(质量比为1)和黏合剂(聚四氟乙烯乳液),混合均匀略加风干后装入压片模具,置于20 MPa全自动压力机上保持2 min,即可制成PbO2粉末多孔电极;同时按上述步骤制备纯PbO2电极(无掺杂材料)。
1.2.2 电解试验
向自制的聚四氟乙烯电解槽中加入40 mL预先配制的氨氮模拟废水[10],以自制的直径为4 cm的圆形片状PbO2粉末多孔电极或纯PbO2电极为阳极,相同面积的不锈钢片为阴极进行电催化试验,电极间距为1 cm,其装置如图1所示。
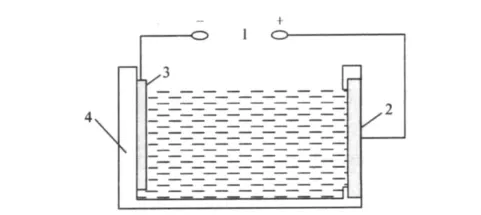
图1 电解装置Fig.1 Design of electrolysis device
1.3 分析方法
·OH浓度采用孔雀石绿光度法测定[11-12]:于50 mL具塞比色管中加入10 mL浓度为1.0×10-4mol/L的孔雀石绿溶液,5 mL pH为4.0的磷酸氢二钠-柠檬酸缓冲液和20 mL二次蒸馏水,加入5 mL电解液并摇匀,放置60 min后于620 nm处测定吸光度(A1);同时在其他条件相同,不加电解液而加入5 mL二次蒸馏水并摇匀,放置60 min后于620 nm处测定吸光度(A0)作空白,计算ΔA,通过标准曲线得出相应的·OH浓度。氨氮浓度采用纳氏试剂光度法测定。硝酸盐氮浓度采用紫外分光光度法测定。亚硝酸盐氮浓度采用N-(1-萘基)-乙二胺光度法测定。游离氯浓度采用甲基红分光光度法测定[13]。
2 结果与讨论
2.1 电极的性能表征
2.1.1 电极表面形貌
试验中两种电极的表面形貌如图2和图3所示。从图2可以看出,纯PbO2电极表面较为光滑细密,但由于加入了聚四氟乙烯乳液黏合剂使得电极表面发生了团聚,致使PbO2晶体(暗色部分)不能均匀分布;从图3可以看出,PbO2粉末多孔电极加入混合粉体后,黏合剂多与混合粉体团聚,使得PbO2晶体能够均匀分布,并且混合粉体的存在使得电极表面较为松散,提高了电极的多孔性,增加了电极的有效面积,强化了污染物在电极表面的吸附转化[14]。


2.1.2 循环伏安曲线
循环伏安曲线的绘制在CHI-660C电化学工作站上进行。分别以两种自制电极为工作电极(暴露面积0.5 cm2),铂片电极为辅助电极,饱和甘汞电极为参比电极,构成三电极体系;电解液溶液中氨氮浓度为50 mg/L,Na2SO4浓度为0.05 mol/L,扫描速度为50 mV/s,扫描范围为-1~1 V,绘制循环伏安曲线(图4)。
由图4可以看出,两种电极均未出现氧化峰,说明氨氮在两种电极表面上的氧化不是直接的,而是被产生的强氧化性物质间接氧化[15]。同时可以看出PbO2粉末多孔电极的电流值略高于纯PbO2电极,这可能是由于石墨+活性炭混合粉体的掺入使电极具有更高的导电性及电催化活性。
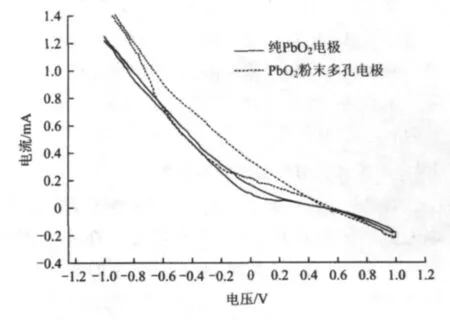
图4 电极循环伏安曲线Fig.4 Cyclic voltammetry curves
2.2 混合粉体的掺杂量对氨氮去除的影响
在电流密度为40 mA/cm2,氨氮初始浓度为50 mg/L,pH为5.6,电解液为0.05 mol/L的Na2SO4条件下,石墨+活性炭混合粉体(质量比为1)掺杂量分别为0%,10%,15%,20%,25%和30%时,考察混合粉体掺杂量对氨氮模拟废水的电催化性能的影响,结果如图5所示。
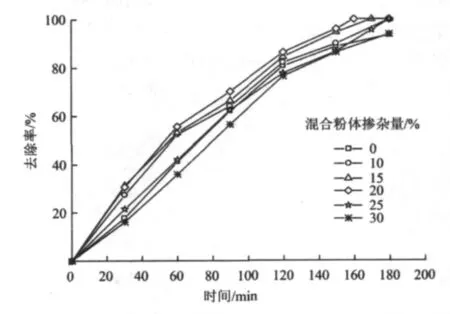
图5 混合粉体掺杂量对PbO2粉末多孔电极催化性能的影响Fig.5 The effect of mixed powders percentage on electrocatalytic activity of PbO2 powder porous electrode
由图5可知,当混合粉体掺杂量为15%~20%时,制得的PbO2粉末多孔电极具有较高的催化活性;当掺杂量大于20%时,电极的催化活性下降。其原因在于PbO2粉末中掺杂适量的石墨及活性炭制成的PbO2粉末多孔电极(图3),一方面可以增强电极的导电性能,另一方面活性炭具有较强的吸附性能,可以提高PbO2电极表面的活性点,更多地吸附溶液中能产生强氧化作用的分子或离子,进而有效强化了电极的电催化氧化。但当掺杂量超出一定范围后,PbO2的相对浓度降低,其催化活性便会下降。综合考虑,以20%掺杂量作为最佳的复配参数。
2.3 电流密度对氨氮去除的影响
氨氮的去除效率受电流密度的影响显著。在低电流密度下,随着电流密度的增大,电子在溶液中的迁移及转化速率随之加快,而由此产生的强氧化性物质增多,从而使得氨氮氧化速率显著提升(图6)。随着电流密度的增大,其·OH浓度也随之增大,·OH的产生及其氧化氨氮的反应如式(1)和式(2)所示。即使电流密度超过40 mA/cm2,·OH浓度的增幅依然没有减弱的迹象(图7)。但当电流密度大于40 mA/cm2时,氨氮氧化速率的增幅却明显减弱。主要归因于氨氮浓度一定,如果强氧化性物质的量超出氨氮氧化所需要的有效范围,那么超出部分就以闲置状态停留在溶液中,不参与氨氮的氧化反应,这样既耗费电能,又大大缩短了电极的使用寿命。因此,综合考虑以上因素,选择以40 mA/cm2作为试验的电流密度参数。
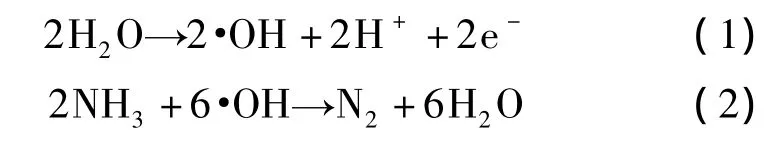
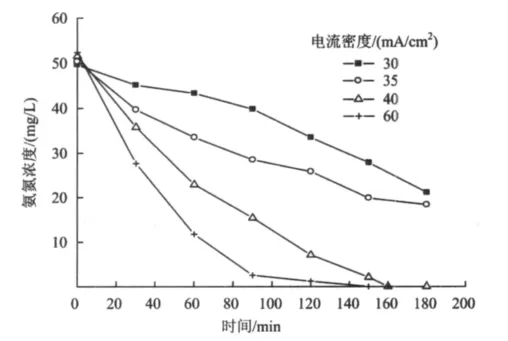
图6 电流密度对氨氮去除的影响Fig.6 The effect of current density on ammonia removal
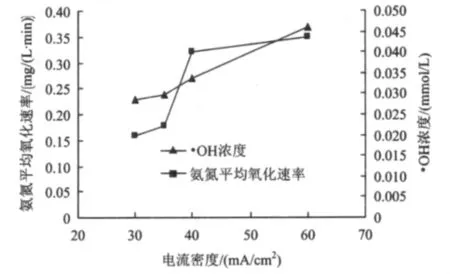
图7 不同电流密度下氨氮平均氧化速率和·OH浓度Fig.7 The average oxidation rate of ammonia and concentration of hydroxyl radical under different current densities
2.4 初始pH对氨氮去除的影响
在电流密度为40 mA/cm2,氨氮初始浓度为50 mg/L,电解液中Na2SO4浓度为0.05 mol/L的条件下,用NaOH和H2SO4稀溶液调电解液的pH,使溶液的初始 pH 分别为 3.0,7.0,9.0,10.0,11.0 和 12.0,所配氨氮原液的pH为5.6,氨氮的电催化降解试验结果如图8所示。由图8可以看出,在初始pH为3.0~10.0时,氨氮的去除率随着初始pH的升高而降低,这表明初始pH较低有利于氨氮的氧化。
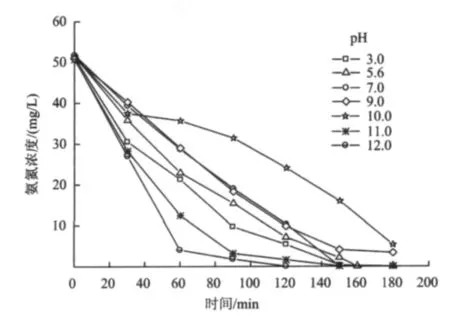
图8 初始pH对氨氮去除的影响Fig.8 The effect of initial pH on ammonia nitrogen removal
图9为不同初始pH条件下测得的·OH浓度。由图9可知,在初始pH为3.0~10.0时,·OH浓度随初始pH的升高呈降低的趋势,并且当初始pH为11.0时·OH浓度达到最大值。其与图8所示的氨氮去除情况相一致,说明氨氮去除主要依赖于·OH的强氧化作用。
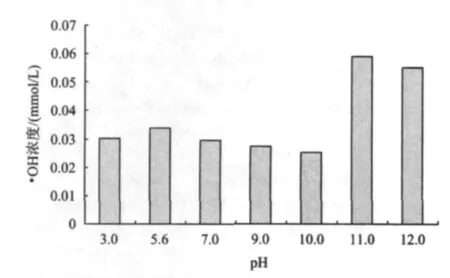
图9 不同初始pH下·OH浓度Fig.9 The concentration of hydroxyl radical under different initial pH
当初始pH为11.0~12.0时,氨氮的去除率随着初始pH的升高而升高,而·OH浓度的变化趋势却恰恰相反。说明高pH溶液中氨氮的去除,不仅包括·OH的强氧化作用,还可能与不同pH下氨氮的存在形态有关。当pH>11.0时,溶液中的氨氮几乎全部以分子态NH3存在[16-17],一方面分子态NH3更容易被氧化[17],另一方面分子态NH3容易被吹脱出溶液,从而降低溶液中的氨氮浓度[16]。
2.5 氯离子浓度对氨氮去除的影响
在电流密度为40 mA/cm2,氨氮初始浓度为50 mg/L,pH为 5.6,电解液中 Na2SO4浓度为 0.05 mol/L的条件下,向电解液中加入NaCl,使溶液中的氯离子浓度分别为 400,500,600,700 和 800 mg/L,进行氨氮的电催化降解试验,结果如图10所示。
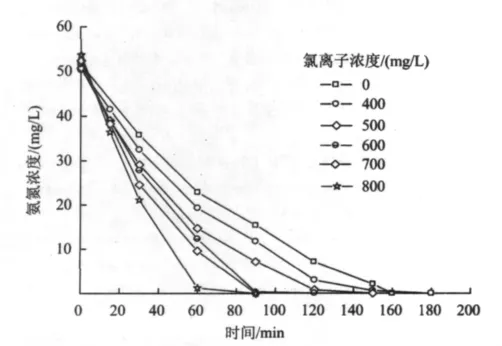
图10 氯离子浓度对氨氮去除的影响Fig.10 The effect of chloride ion concentration on ammonia nitrogen removal
由图10可知,氨氮的去除率随着氯离子浓度的增加而增大。这是由于加入氯离子后,氨氮溶液中有强氧化性物质HClO和ClO-生成〔(式(3)和式(4)〕,其对氨氮起着间接氧化作用〔(式(5)和式(6)〕[17]。
电催化过程中游离氯的生成情况如图11所示。由图11可知,反应前60 min,游离氯浓度随电催化时间的增加而增大,之后随时间的增加游离氯浓度略有下降,但总体趋于平稳状态。试验发现,在无氨氮的电解液中游离氯浓度在60 min达到最大值,说明在含氨氮的废水中虽然溶液中产生的游离氯一部分用于对氨氮的强氧化,但游离氯的消耗反过来会促进其本身的再生成;另一方面随着氨氮被氧化为N2,溶液的pH呈增大趋势,这有利于阳极生成氯气的溶解,进而有利于游离氯的产生〔式(4)〕[18-19]。
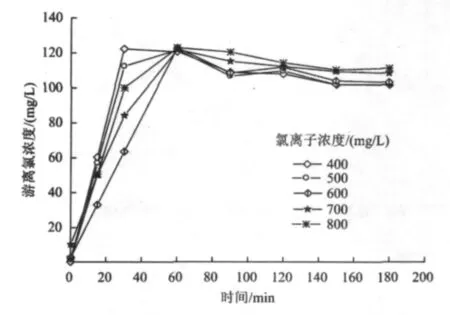
图11 氨氮去除过程中游离氯的产生Fig.11 The generation of free chlorine in the process of ammonia removal
60 min以后游离氯浓度略有下降,主要由于随着反应的进行,溶液逐渐达到强碱环境。碱性条件虽然有利于阳极产生的Cl2在溶液中的溶解〔式(4)〕,但产生的HClO发生一系列的反应〔式(7)~式(9)〕,在阳极产生ClO3-[18-20],使得游离氯浓度呈下降趋势。此外,在碱性条件下,析氯的副反应容易析氧〔式(10)〕,这对游离氯的生成也具有阻碍作用。
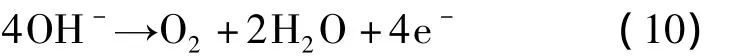
2.6 氨氮氧化产物的分析
分别测定了初始pH为3.0,7.0,9.0和11.0的氨氮溶液在电催化过程中产生的硝酸盐氮浓度(图12)。氨氮在去除过程中总会伴有一定的硝酸盐氮产生,总体趋势是随着反应时间的延长产生量增加,且碱性条件下的产生量较高。由产生的硝酸盐氮浓度可看出,氨氮的氧化只有很少一部分转化成了硝酸盐氮。在试验中测定了亚硝酸盐氮浓度,结果发现其浓度可忽略不计。由此可见,氨氮主要氧化为含氮的气体。试验过程中并没有闻到刺激性的气味,故这些气体应以N2为主,同时也有可能含有微量的 NOx,但其浓度很小,可忽略[16]。
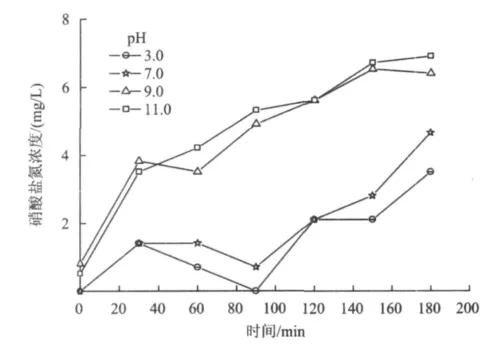
图12 不同初始pH下产生的硝酸盐氮Fig.12 The generation of nitrate nitrogen under different initial pH
3 结论
(1)掺杂石墨+活性炭混合粉体制成的PbO2粉末多孔电极,当掺杂量为15%~20%时,具有较高的导电性及电催化活性。
(2)氨氮的去除效率随电流密度的增大而增加,当电流密度超过40 mA/cm2后,氨氮氧化速率的增幅明显减弱。
(3)初始pH为3.0~10.0时,氨氮的去除率随着初始pH的升高而降低,当初始pH为11.0~12.0时,氨氮的去除率随着初始pH的升高而升高。
(4)氨氮的去除率随着氯离子浓度的增加而增大,在反应前60 min,游离氯浓度随电催化时间的增加而增大,之后有下降的趋势,但总体趋于平稳状态。
(5)PbO2粉末多孔电极电催化降解氨氮废水,主要产物是以N2为主的含氮气体以及少量的硝酸盐氮。
[1]李平,张永利,吕先林,等.UASB处理低浓度城市污水的生产性研究[J].中国给水排水,2007,23(11):67-73.
[2]KAPALKA A,JOSS L,ANGLADA A,et al.Direct and mediated electrochemical oxidation of ammonia on boron-doped diamond electrode[J].Electrochemistry Communications,2010,12(12):1714-1717.
[3]徐丽丽,施汉昌,陈金銮.Ti/RuO2-TiO2-IrO2-SnO2电极电解氧化含氨氮废水[J].环境科学,2007,28(9):2009-2013.
[4]刘淼,钱美荣,苏荣梅,等.羟基自由基氧化处理垃圾渗滤液中高浓度氨氮[J].水处理技术,2007,33(11):79-88.
[5]KIM K W,KIM Y J,KIM I T,et al.Electrochemical conversion characteristics of ammonia to nitrogen[J].Water Res,2006,40:1431-1441.
[6]MARSEN J.Electrochemical oxidation of oxalate in alkaline solutions[J].The Canadian of Journal of Chemical Engineering,1993,71(2):218-225.
[7]温青,张宝宏,李旭辉.铁掺杂PbO2/Ti阳极电催化氧化对硝基苯酚研究[J].中国给水排水,2006,13(7):85-89.
[8]邵春雷,顾丁红,陆晶,等.新型二氧化铅电极处理硝基苯废水[J].环境科学研究,2006,19(4):65-69.
[9]庄京,邓兆祥.β-PbO2纳米棒及Pb3O4纳米晶的制备与表征[J].高等学校化学学报,2002,23(7):1223-1226.
[10]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:279-280.
[11]吴春笃,田芳,周建军.孔雀石绿光度法检测羟基自由基[J].人民长江,2008,39(16):17-19.
[12]BERBERIDOU C,POULIOS I,XEKOUKOULOTAKIS N P,etal.Sonolytic,photocatalytic and sonophotocatalytic degradation of malachite green in aqueous solutions[J].Applied Catalysis B:Environmental,2007,74:63-72.
[13]江艳,曹永琳,张振辉.甲基红分光光度法测定水中余氯[J].环境监测管理与技术,2004,16(3):23-24.
[14]KONG J T,SHI S Y,KONG L C,et al.Preparation and characterization of PbO2electrodes doped with different rare earth oxides[J].Electrochim Acta,2007,53:2048-2054.
[15]徐莺,朱承驻,董文博,等.新型二氧化铅电极处理有机染料废水的研究[J].环境污染治理技术与设备,2006,7(5):124-128.
[16]KIM K W,KIM Y J,KIM I T,et al.Electrolytic decomposition mechanism of ammonia to nitrogen at IrO2anode[J].Electrochim Acta,2005,50(22):4356-4364.
[17]CANDIDO L,ANTONIO J C,GOMES P.Evaluation of anode materials for the electro-oxidation of ammonia and ammonium ions[J].Materials Chemistry and Physics,2011,129(3):1146-1151.
[18]陈金銮,施汉昌,徐丽丽.pH值对氨氮电化学氧化产物与氧化途径的影响[J].环境科学,2008,29(8):2277-2281.
[19]胡俊生,谢添,任雪冬,等.电生成活性氯的影响因素及其在有机废水处理中的应用[J].辽宁化工,2008,37(9):598-601.
[20]HERNLEM B J.Electrolytic destruction of urea in dilute chloride solution using DSA electrodes in a recycled batch cell[J].Water Res,2005,39:2245-2252. ○

