炼焦煤尾煤热解特性及富氢气体析出研究
刘海兵,惠贺龙,付兴民,柳树成,贾晋炜,舒新前* ,顾军
1.中国矿业大学(北京)化学与环境工程学院,北京 100083
2.北京建筑材料科学研究总院有限公司,固废资源化利用与节能建材国家重点实验室,北京 100041
煤炭约占我国一次能源消费的70%,随着煤炭工业和选煤工业的迅速发展,煤炭洗选废弃物处理已成为制约选煤工业可持续性发展的重大难题。目前平均原煤入洗率已达50.9%,据测尾煤产生量约占入洗量的2.5%~3%。按2010年煤炭开采量32.4亿t计,年产生尾煤量约4000万~4800万t,以49%灰分计算,折合标煤为近1800万t[1-4]。
氢气不仅是化学工业的基础原料也是一种清洁的燃料。常规制氢技术的成本较高,通过废弃物热解技术制备氢气[5-7]可以降低成本。尾煤的转化和洁净利用是推动选煤工业发展的重要动力,探索尾煤的高效利用技术研究对煤矿废弃物处置和环境保护具有特别重要的意义。尾煤的常规处理方法是将其掺到煤中燃烧,该方法不但产生二次污染,且对尾煤的形态、输送、燃烧装置等技术要求也较高[8-10]。Finney等[10]对尾煤进行热处理比较研究,热解得到一定的低热值产品,气化试验结果不理想。Krevelen等[11]研究认为,煤热解中氢气在低加热速率下生成温度范围较宽,主要是因为大量重叠的一阶反应结合导致;热解初期产品中氢气是由脂环族脱氢形成,在高温阶段,热解产品中的氢来源于缩聚反应和其他反应中的脱氢环化。Samaras等[12-13]已证实,在煤热解转化过程中,煤中的无机矿物和有机物转化存在一定联系。Slaghuis等[14]对高灰煤进行的热解认为,无机矿物对煤热解有一定催化作用。我国一些学者[15-16]研究认为,煤中矿物质对热解过程有抑制作用,该种作用随矿物质增加而增加。
尾煤热解不仅关系到燃烧设备的设计和可靠运行,也是煤系废弃物资源化利用的重要补充。笔者结合热重分析和固定床管式炉热解装置,对尾煤热解特性和产物析出进行了研究,重点探讨了富氢气体的析出特性、产量及分布特性。
1 试验
1.1 原料
以山西某煤矿炼焦煤的尾煤为试验原料,其工业分析与元素分析如表1所示,尾煤灰成分分析如表2所示。
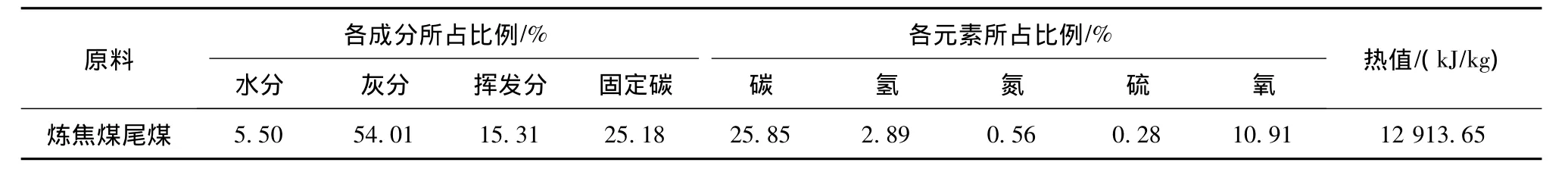
表1 尾煤的成分与元素分析Table 1 Proximate and ultimate analysis of tailings

表2 尾煤灰成分分析Table 2 Ash composition of tailings
由表1和表2可见,尾煤具有高灰、低硫、低H/C和低热值特点,灰成分中 SiO2、Al2O3的比例较高。
1.2 仪器
热重分析采用北京恒久HCT-2型热重分析仪测定。热解采用电加热固定床管式炉装置(天津中环实验电炉有限公司)测定,该装置由一根直径为30 mm,长1200 mm的石英管及带程序温控仪的电加热装置和D07-11C累积积分质量流量计(北京七星华创电子股分有限公司)组成。热解气采用GC-2014C型气相色谱仪(日本岛津公司)测定。原料的工业分析采用XL-1型箱式电阻炉(天津中环实验电炉有限公司)和DHG-9707A型电热恒温鼓风干燥箱(天津中环实验电炉有限公司)测定。
1.3 方法
热重分析在热天平上进行,将(30.0±0.1)mg尾煤或焦煤粉试样放入差热天平坩埚内,并通入流量为60 mL/min的氮气,分别以10,20和40℃/min的升温速率对尾煤加热到950℃,焦煤以10℃/min的升温速率加热到950℃。热解试验在固定床管式炉上进行,试验装置如图1所示。
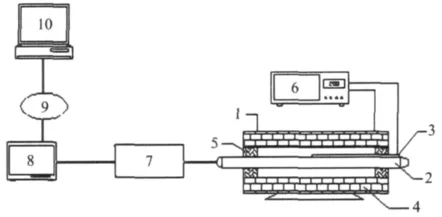
图1 尾煤热解固定床装置Fig.1 The pyrolysis process of tailings in the fix-bed equipment
将30 g原料放在热解炉恒温段热解,终温控制为800,850,900和950℃,记录质量流量计的瞬时产率和累计流量。当温度升至所设温度后,流量计的流量显示数值接近0即可认为热解结束。热解气体经一级水冷凝收集热解油,气体产物经过盛有CaCl2的干燥装置,用集气袋收集后进行气相色谱分析。试验中测得的固态、液态产物的质量与原料质量比即为其产率,混合气的产率=(原料质量-固态物质量-液态物质量)/原料质量。
2 结果与讨论
2.1 升温速率对尾煤热解过程的影响
在升温速率分别为10,20和40℃/min的条件下,对尾煤的失重量(TG)和失重速率(DTG)进行热重分析,结果如图2所示。
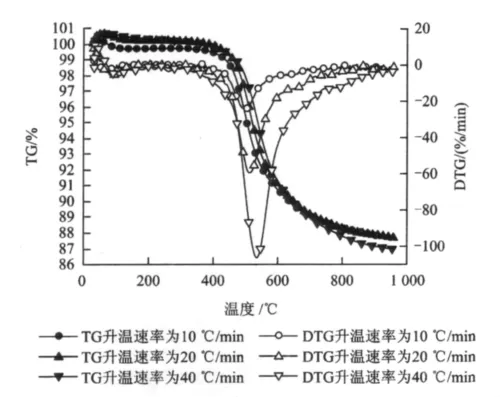
图2 不同升温速率下尾煤TG/DTG分析Fig.2 TG/DTG analysis of tailings at different heating rates
由图2可以看出,尾煤的线性升温热解可以分为四个阶段。
第一阶段为室温~200℃。该阶段主要进行尾煤的脱水、脱除吸附气体以及脱羧基反应等,其失重量大致占总失重的5%左右。由于尾煤中含水量较少,所以脱水过程不是很明显。
第二阶段为200~400℃。该阶段主要是一次挥发分析出。从TG曲线看,升温速率对挥发分析出影响很小,可能与尾煤中高灰分有关,由于矿物质热容大,影响了热传递;DTG曲线在该阶段比较平缓,曲线均接近水平直线,失重速率无明显变化。
第三阶段为400~650℃。该阶段是活泼热解阶段。TG曲线明显下降,DTG曲线迅速下降后又迅速上升出现峰值,其最大失重速率所对应的温度约为500℃,失重量占总失重的80%,该阶段为尾煤的热解阶段,尾煤在热解聚成胶体之后,迅速分解析出高分子有机物,即焦油。结果与西部煤热解该阶段的DTG曲线最大失重速率对应温度基本吻合[17],但失重速率有所增加。造成尾煤该阶段峰温延迟的原因可能是尾煤中高浓度的矿物质阻碍了热传导过程,并阻碍了挥发分的析出过程[18-19]。
第四阶段为650~900℃。该阶段属于热解后期阶段。TG曲线缓慢下降,DTG曲线缓慢上升,失重速率在15%/min左右,该过程主要是半焦的缩聚反应,半焦缩聚成焦炭,并放出以H2和CH4为主的低分子量气体。
从图2可知,升温速率对尾煤最终失重速率的影响较小。但是,随着升温速率增大,样品的最大失重速率逐渐增大,并且样品的初始热解温度、热解终温、最大失重速率所对应的温度均向高温区推移。当升温速率由10℃/min升高到40℃/min,尾煤的最大失重速率所对应的温度增加38.4℃(表3),随着升温速率逐渐增大,样品最大失重速率所对应的温度间隔逐渐增大。其原因是尾煤的热解是吸热反应,特别是尾煤中含有很高的矿物质成分,导热性能和传热的差异,使样品内部和外表的温度差较大,导致尾煤中有机分子的分解过程延缓、挥发物的析出阻力增大。随着升温速率增大,原料在低温区的停留时间缩短,整个热解体系会被迅速加热到高温区域,导致尾煤中的有机组成在高温区域迅速分解、聚合并析出。同时,挥发分的快速析出会导致物料搅动,提高了热解体系的热传导和对流效果,促进尾煤进一步热解,导致热失重速率增大。但是由于升温速率增大导致停留时间缩短,整个热解过程随着热解时间延续而向高温区推移。
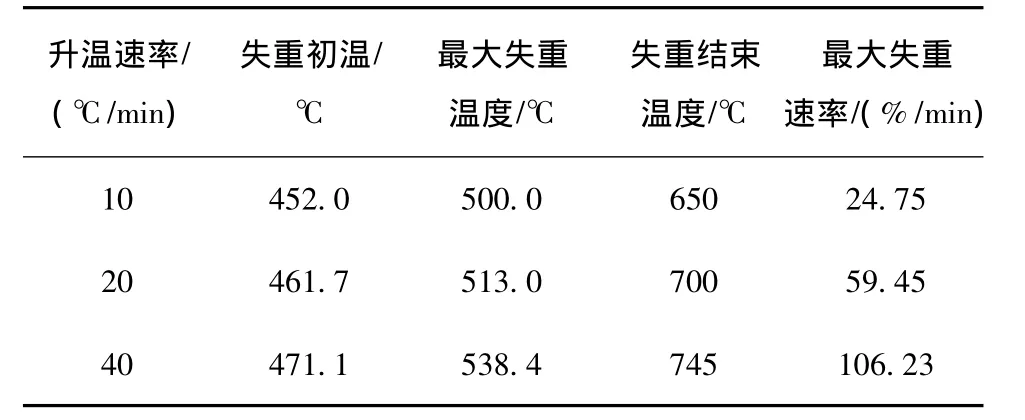
表3 尾煤热解特性参数Table 3 Parameters of pyrolysis of tailings
2.2 尾煤热解动力学分析
为了更好地描述尾煤的热解失重特性,构建尾煤热解的表观动力学模型,采用Coats-Redfern积分法进行拟合运算[20-21],求解了尾煤热解的动力学参数。通过离变量,积分整理并取近似值可以得到:
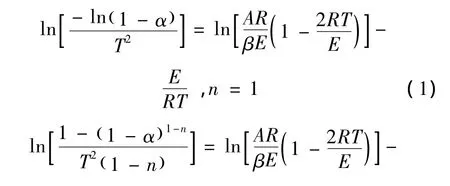

式中,R为影响因子;T为热解温度,℃;当2RT/E≪1,则接近常数,设Y=,则可以得直线方程Y=a+bX,求解a和b值,就可得到尾煤热解反应的活化能(E)和频率因子(A)。经过模拟演算,得出尾煤的热解反应为二级反应,其动力学参数如表4所示。
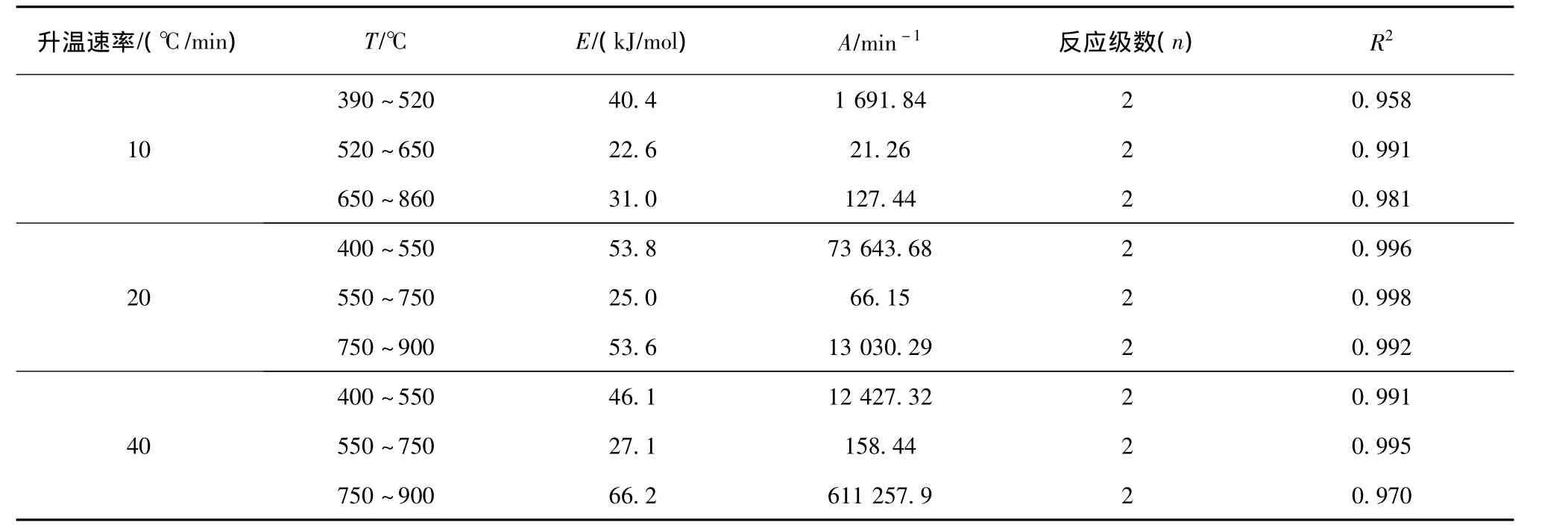
表4 尾煤热解动力学参数Table 4 Kinetics parameters of tailings pyrolysis
由表4可知,尾煤热解反应的活化能为22.6~66.2 kJ/mol,热解反应用三个二级反应过程描述。随着升温速率增大,热解活化能呈现出先降低后增加的现象。原因是尾煤热解第一阶段大致相当于半焦形成前胶体的塑性阶段[22],主要发生大分子键断裂,需要提供较高的能量,使得其表观活化能较高。随着温度的升高,胶体迅速分解,大量挥发分析出。当温度高于最大热失重速率所对应的温度时,由于挥发分快速析出导致热解体系不稳定,活化能降低。第三阶段是在第二阶段剧烈反应的基础上发生缩聚和半焦的固化反应,所需的能量相应高于第二阶段。
2.3 固定床热解试验分析
2.3.1 终温对尾煤热解过程影响
分别选择800,850,900和950℃作为热解终温,进行尾煤热解过程探讨,结果如图3,表5和图4所示。
由图3可以看出,随着热解温度升高,热解焦(固相)的产率逐渐降低;气相析出呈递增态势,产率逐渐升高;液相在850℃前产率呈递增趋势,850℃时达到最大值(6%),随着温度升高焦油二次分解,液相产率逐渐减少。热值也逐渐增大。
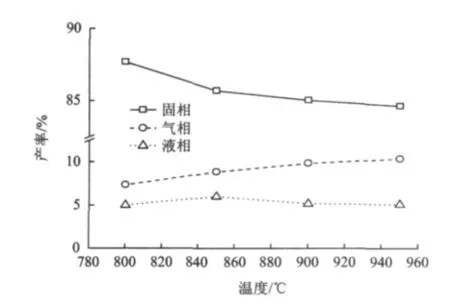
图3 尾煤热解产物分布特性Fig.3 Distributions of pyrolysis products of tailings
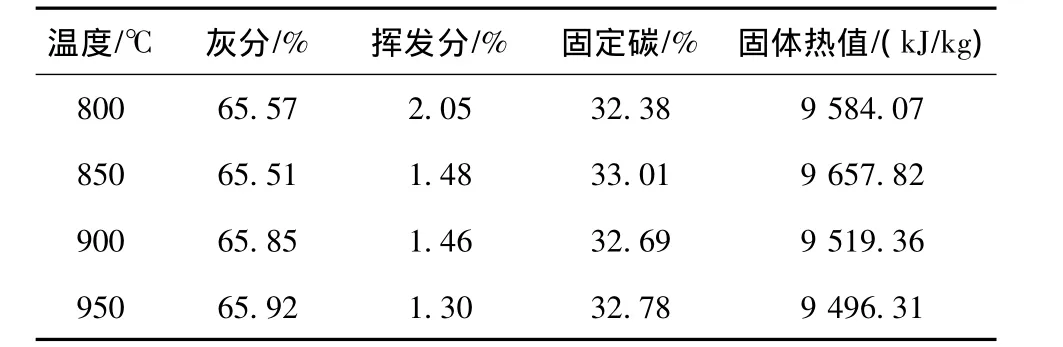
表5 尾煤热解焦工业分析Table 5 Proximate analysis of pyrolysis coke of tailings
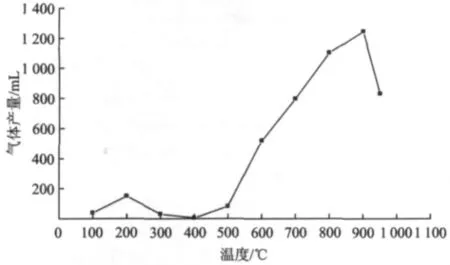
图4 尾煤热解不同温度的气体产量Fig.4 Gas production of different temperatures of tailings pyrolysis
结合尾煤热解焦的工业分析结果(表5)表明,随着温度升高,热解焦的挥发分逐渐降低,终温是影响尾煤热解的重要参数,高温为尾煤中化学键断裂提供了更高能量,有利于促进尾煤中高分子有机组分裂解和挥发分析出,最终决定了尾煤热解反应的进程。
由图4可以看出,整个气体析出曲线由200℃左右和900℃左右两个析出峰组成。随着温度升高,气体产量不是线性增加。200℃左右出现一个析出峰,是物理吸附状态存在的水和气体的析出引起的,收集到的气体基本是水蒸汽。随着温度升高瞬时产量下降,到400℃左右收集到的气体产量达到最小。这与TG分析基本吻合。之后随着温度升高,气体产量增加。在800℃左右瞬时气体产量达到最大,之后瞬时气体产量下降,在900℃左右气体析出基本停止。
2.3.2 气体分布及产氢特性
尾煤热解过程中的气相组成以H2,CH4和CO为主,同时含有少量的CO2。气体产量及热值如表6所示,气体析出曲线如图5所示。
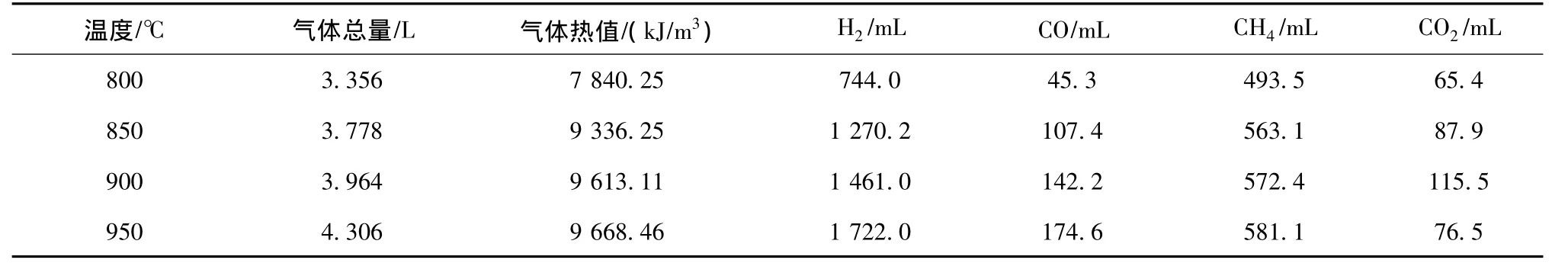
表6 不同温度下的气体产量及热值Table 6 Gaseous yield distribution and caloric value at different temperatures
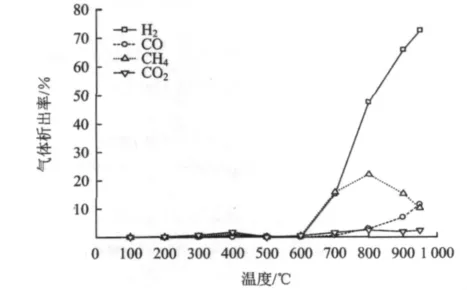
图5 尾煤热解气体组分析出特性Fig.5 Evolution characteristics of gas components during pyrolysis
从图5可以看出,当温度低于600℃时,气相产物很少,当温度超过600℃后,各气体组分析出明显。氢气和一氧化碳随着温度升高保持增加趋势,伴随整个反应过程。甲烷和二氧化碳先增加后减少。氢气在600℃前析出很少,400℃前后有少许变化但不明显,在600~700℃时析出突然增加,达到15%,比典型煤热解在500℃后大量析出推迟近100℃;此时H2的来源多由煤热解的一次产物受到二次热解作用和煤结构单元中芳香部分的进一步缩聚反应生成[23],随着温度升高,H2浓度迅速升高,析出峰出现在900℃左右,高于正常煤热解氢气析出峰温度,氢气浓度最高可达72.61%。认为是由于热解后期缩聚反应造成的[21],由环数较小的芳环变成环数更大的芳环,同时伴随着氢气的释放。由表6也可看出,随着温度升高氢气浓度递增,热值也递增。
煤热解过程中CO的主要来源有醚键、羟基和含氧杂环的断裂、分解,所以煤中的氧浓度高,CO的释放量大。CO在600℃前基本收集不到,随着温度升高其浓度缓慢升高,在900℃左右达到高析出峰,最高可达11.51%。低温时CH4主要由煤热解过程中脂肪侧链断裂而生成,CH4的产率与煤中脂肪的甲基官能团的数量有关,随着脂肪甲基浓度的增加CH4的产率也增加。试验中CH4在200℃前有微量生成,600℃前随温度升高生成缓慢。600℃后浓度增加迅速,800℃出现最大析出峰,最高值为22.09%;此后随温度升高呈下降趋势。CO2在整个热解过程中浓度一直较低,在600~800℃的变化趋势与CH4相同。造成该现象的原因是在600℃之前,尾煤中的矿物处于欠活化状态,阻碍了热传导过程,抑制了气相成分析出;当温度高于600℃,矿物质开始活化,促进了尾煤中有机成分裂解、聚合以及挥发分的析出过程。
3 结论
(1)尾煤的热解分为四个阶段,活泼热解主要发生在650~850℃。通过Coats-Red fern公式拟合计算,尾煤热解的活化能为22.6~66.2 kJ/mol,热解过程用三个二级反应过程进行描述。升温速率主要通过影响尾煤热解反应的活化能和频率因子起作用。
(2)尾煤热解过程中H2最大析出峰出现在900℃左右。甲烷生成量随温度升高先增后减,在750~800℃达最大;CO析出随温度升高而升高;CO2随温度升高先增后减,最大析出峰集中在800℃左右。950℃时热解产富氢气体为4.306 L,氢气产量为1.722 L,具有较高产率和利用价值。
[1]YANG Y,SUN W,LI S F.Tailings dam stability analysis of the process of recovery[J].Procedia Engineering,2011,26:1782-1787.
[2]FOURIE A.Preventing catastrophic failures and mitigating environmental impacts of tailings storage facilities[J].Procedia Earth and Planetary Science,2009,1(1):1067-1071.
[3]ZHENG X,XU X H,XU K.Study on the risk assessment of the tailings dam break [J].Procedia Engineering,2011,26:2261-2269.
[4]DUONG C,CHONG J,XU Z J,et al.A novel process for recovering clean coal and water from coal tailings[J].Minerals Engineering,2000,13(2):173-181.
[5]张磊.煤泥水热解制氢及相关催化剂的研究[D].北京:中国矿业大学,2009:9-12.
[6]KIDENA K,MURATA S,NOMURA M.Studies on the chemical structural change during carbonization process[J].Energy and Fuels,1996,10(3):672-678.
[7]UCAR S,KARAGOZ S,YANIK J,etal.Copyrolysis of scrap tires with waste lubricant oil[J].Fuel Processing Technology,2005,87(1):53-58.
[8]FINNEY K N,SHARIFY V N,SWITHENBANK J.Combustion of spent mushroom compost and coal tailing pellets in a fluidisedbed[J].Renewable Energy,2009,34(3):860-868.
[9]ANTHONY E J.Fluidized bed combustion of alternative solid fuels,status,successes and problems of the technology[J].Progress in Energy and Combustion Science,1995,21(3):239-268.
[10]FINNEY K N,CHANGKOOK R,SHARIFI V N,et al.The reuse of spent mushroom compost and coal tailings for energy recovery:comparison of thermal treatment technologies[J].Bioresource Technology,2009,100(1):310-315.
[11]van KREVELEN D W.Coal[M].3rd ed.Amsterdam:Elsevier,1993:979.
[12]SAMARAS P,DIAMADOPOULOS E,SAKEKKAROPOULOS G P.The effect of mineral matter and pyrolysis conditions on the gasification of greek lignite by carbon dioxide[J].Fuel,1996,75(9):1108-1114.
[13]FRANKLIN H D,PETER W A,HOWARD J B.Mineral matter effects on the rapid pyrolysis and hydropyrolysis of a bituminous coal:2.effects of yields of C3-C8hydrocarbons[J].Fuel,1982,61(12):1213-1217.
[14]SLAGHUIS J H,FERREIRA L C,JUDD M R.Volatile materialin coal:effect of inherent mineral matter[J].Fuel,1991,70(3):471-473.
[15]李凡,张永发,谢克昌.矿物质对煤显微组分热解的影响[J].燃料化学学报,1992,20(3):300-306.
[16]朱金波.煤中矿物质对热解过程的影响研究[J].选煤技术,2005(6):10-13.
[17]王俊宏,常丽萍,谢克昌,等.西部煤的热解特性及动力学研究[J].煤炭转化,2009,32(3):1-5.
[18]OZTAS N A,YURUM Y.Pyrolysis of Turkish Zonguldak bituminous coal:part1.effect of mineral matter[J].Fuel,2000,79(10):1221-1227.
[19]LIU Q R,HU H Q,ZHOU Q,et al.Effect of inorganic matter on reactivity and kinetics of coal pyrolysis[J].Fuel,2004,83(6):713-718.
[20]LÁZARO M J,MOLINER R,SUELVES I.Non-isothermal versus isothermal technique to evaluate kinetic parameters of coal pyrolysis[J].J Analytical and Applied Pyrolysis,1998,47(2):111-125.
[21]赵云鹏.西部弱还原性煤热解特性研究[D].大连:大连理工大学,2010:4-6.
[22]CHRISTIANSEN J V,FELDTHUS A,CARLSEN L.Flash pyrolysis of coals:temperature-dependent product distribution[J].Anal Appl Pyroly,1995,32(3):51-63.
[23]郭崇涛.煤化学[M].北京:化学工业出版社,1996:90-92.○

