宽叶羌活不同部位有效成分的分布特征
刘卫根,王亮生,周国英 ,徐文华,杨路存,宋文珠
1中国科学院高原生物适应与进化重点实验室,西宁810008;2 中国科学院植物研究所植物园,北京100093;3 中国科学院研究生院,北京100049
羌活原植物为伞形科羌活属植物羌活(Notopterygium incisum Ting ex H.T.Chang)和宽叶羌活(N.forbesii H. Boiss.),以其干燥根茎和根入药[1],为历版药典收载,主要分布于青海、四川、甘肃和云南一带[2]。羌活是中、藏、羌医药体系中的常用药材,其药用历史悠久,药理作用广泛,具有抗炎、镇痛、散寒、祛风、除湿等多种功效,对心血管疾病、消化系统疾病也具有一定的疗效[3]。除药典中规定的上述两种植物外,产自陕西的下延棱子芩(Pleurospermum decurrens)[4]、云南的心叶棱子芩(Pleurospermum rivulorum)[5]和翼羽轮芩(Pterocyclus rivulorum)[4]、四川的大前胡(Angelica sylvestris)[4]和紫伞芹(Melauosciadium pimpinelloideum Boissieu)[6]、东北的朝鲜羌活(Angelica koreana)[4]、新疆的林当归(Angelica silvestris L.)[7]和灰绿叶 当 归(Angelica glauca Edgew.)[8]等品种在市场上往往被用作羌活的混用品或地方习用品,它们与羌活性味相差甚远,均不能充当羌活应用。
羌活中含有挥发油、有机酸和香豆素等多类活性成分,目前关于羌活和宽叶羌活根部活性成分的提取分离、含量测定方面的研究已有大量文献报道[9-11],也有学者对羌活的混用品和地方习用品进行了相关研究[5,8]。胡敏燕[12]等和王小仙[13]等分别对不同时间采收的和不同时间采购的羌活根部挥发油的含量进行了比较。目前关于宽叶羌活不同部位中有机酸和香豆素类化合物含量测定方面的研究尚未报道。因此,本实验采用HPLC-DAD 法同时测定宽叶羌活的根(包括根和根茎,以下简称根)、茎、叶片、叶柄和种子5 个部位中绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇和异欧前胡素的含量,探究宽叶羌活中这些常见的有机酸和香豆素类化合物的含量和分布特征,并和羌活进行比较,以期为羌活资源的合理开发利用提供科学依据。
1 材料和方法
1.1 植物材料
宽叶羌活于2010 年8 月采自青海省门源县和乐都县,经中国科学院西北高原生物研究所周国英副研究员鉴定为伞形科植物宽叶羌活(N.forbesii H.Boiss.)。将各部位样品(根、茎、叶、叶柄、种子)仔细分拣,自然阴干,称重,粉碎至100 目左右备用。
1.2 仪器与试剂
仪器:戴安(Dionex)HPLC-DAD 分析系统,包括P680 泵、UltiMate 3000 自动进样器、TCC-100 柱温箱、PDA-100 光电二极管阵列检测器及Chromeleon(6.60 版本)变色龙色谱工作站。色谱柱为C18TSK gel ODS-80Ts QA(250 mm × 4. 6 mm,i. d. 5 μm,Tosoh Co.Ltd.,日本)。
试剂:有机溶剂包括分析纯甲醇、冰醋酸(北京化工厂,中国);色谱纯甲醇和乙腈(MREDA TECHNOLOGY INC.,USA),HPLC 级超纯水由Milli-Q 超纯水系统(Millipore,Billerica,MA,USA)制备。对照品阿魏酸(批号:110773-201012)和欧前胡素(批号:110826-201013)购自中国食品药品检定研究院;补骨脂素(批号:110322)和佛手柑内酯(批号:110215)购自上海顺勃生物工程有限公司;绿原酸(批号:ps08072303 )、紫花前胡苷(批号:ps11032301)、异欧前胡素(批号:ps08040301)、羌活醇(批号:ps11050601)购自成都普斯生物科技有限公司,各标准品纯度均在98%以上。
1.3 色谱分析方法
采用高效液相色谱-二极管阵列检测法(HPLCDAD)测定宽叶羌活不同部位中8 种活性成分的含量(含量测定方法由本课题组建立,另文报道,文章已接收[14])。
1.3.1 色谱条件
流动相A 相为纯甲醇,B 相为0.3%的冰醋酸水溶液,梯度洗脱程序为:0~15 min,25%~38%A;15~17 min,38%~38%A;17~45 min,38%~50%A;45~55 min,50%~75%A;55~70 min,75%~85%A;70~75 min,85%~25%A,75~80 min,25%~25% A。流速:0. 6 mL/min,进样量:10 μL。柱温:30 ℃;检测波长:336 nm(紫花前胡苷),325 nm(绿原酸和阿魏酸),310 nm(佛手柑内酯、羌活醇、异欧前胡素、欧前胡素),295 nm(补骨脂素)。对照品和乐都宽叶羌活不同部位样品的色谱图见图1。
1.3.2 对照品溶液的制备
精密称取对照品绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇、异欧前胡素各适量,以甲醇溶解,摇匀并定容,制成含绿原酸(408.00 μg·mL-1)、阿魏酸(400.00 μg·mL-1)、紫花前胡苷(400.00 μg·mL-1)、补骨脂素(405.00 μg·mL-1)、佛手柑内酯(404.00 μg·mL-1)、欧前胡素(403.00 μg·mL-1)、羌活醇(400.00 μg·mL-1)、异欧前胡素(400.00 μg·mL-1)混合对照品储备液。
1.3.3 供试品溶液的制备
取分离后各部位样品粉末各约0.4 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定重量,超声处理(功率250 W,频率50 kHz)30 分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,过0.45 μm 微孔滤膜,即得。
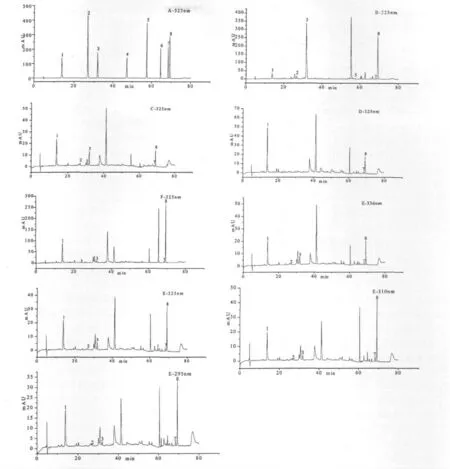
图1 混合对照品(A,325 nm)、乐都宽叶羌活根(B,325 nm)、茎(C,325 nm)、叶片(D,325 nm)、叶柄(E,336,325,310,295 nm)、种子(F,325 nm)的高效液相色谱图1.绿原酸;2.阿魏酸;3.紫花前胡苷;4.补骨脂素;5.佛手柑内酯;6.欧前胡素;7.羌活醇;8.异欧前胡素Fig.1 HPLC chromatograms of the mixed reference compounds (A,325 nm),root and rhizome (B,325 nm),stem (C,325 nm),leaf(D,325 nm),petiole (E,336,325,310,295 nm)and seed (F,325 nm)of N. forbesii collected from Ledu.1. chlorogenic acid;2.ferulic acid;3.nodakenin;4.psoralen;5.bergapten;6.imperatorin;7.notopterol;8.isoimperatorin.
1.3.4 线性关系考察
精密量取“1.3.2”项下的混合对照品母液5,2.5,2 mL,分别置10 mL 量瓶中,加甲醇稀释至刻度,摇匀,然后采用逐级稀释的方法,用甲醇将上述不同浓度的混标(包括母液)分别稀释10n倍(n =1,2,3),得到一系列不同浓度的混合对照品溶液。每个浓度平行进样3 针,进样量为10 μL,以对照品浓度(X)为横坐标,平均峰面积(Y)为纵坐标,绘制标准曲线,得到各对照品的回归方程。各对照品的线性回归方程分别为:绿原酸(Y = 540.7X –1.142,R2= 0.9999,线性范围2.04~102.00 μg·mL-1);阿魏酸(Y = 1591.2X + 0.5318,R2= 0.9999,线性范围0.40~40.00 μg·mL-1);紫花前胡苷(Y =808.4X-1.0392,R2= 0.9992,线性范围0.80~400. 00 μg·mL-1);补骨脂 素(Y = 1058. 6X-0.0759,R2= 0.9997,线性范围0.20~40.50 μg·mL-1);佛手柑内酯(Y = 1137.5X-0.0486,R2=0.9998,线性范围0.20~40.40 μg·mL-1);欧前胡素(Y = 845.4X + 0.1112,R2= 0.9995,线性范围2.01~40.30 μg·mL-1);羌活醇(Y = 663.7X-0.2378,R2= 0.9999,线性范围0.40~400.00 μg·mL-1);异欧前胡素(Y = 955.9X + 0.9342,R2= 0.9996,线性范围0.20~400.00 μg·mL-1)。1.3.5 精密度试验
对同一对照品溶液,在同一色谱条件下,连续进样5 次,得绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇、异欧前胡素浓度的RSD 值分别 为1. 62%、0. 49%、3. 39%、0. 27%、0.12%、3.33%、0.34%、1.05%。
1.3.6 重复性试验
取同一样品,称取6 份,各约0.4 g,精密称定,分别制备供试品溶液,并进行测定,结果表明,绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇、异欧前胡素6 次测定值的RSD 分别为2.36%、2.17%、3.19%、未知、1.78%、未知、1.32%、1.56%。
1.3.7 稳定性试验
取同一对照品溶液,根据上述色谱条件分别在0、2、4、8、16、24 h 进样分析,根据峰面积计算混合储备液中绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇和异欧前胡素的浓度,RSD 分 别 为1. 97%、0. 52%、1. 86%、1. 71%、0.64%、2.22%、1.01%、1.51%,表明24 h 内8 个对照品稳定性良好。
1.3.8 回收率试验
采用加样回收法,精密吸取已知含量的羌活根粉末0.1 g,分别精密加入已知量高、中、低3 种质量浓度的对照储备液,按供试品溶液制备方法进行操作,并按2.1 项色谱条件进样分析,计算回收率。结果表明,绿原酸、阿魏酸、紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇、异欧前胡素的回收率分别 为96. 27%、97. 81%、102. 44%、99. 10%、96.63%、99.57%、101.04%、102.37%,RSD 值分别为1. 58%、2. 94%、4. 14%、1. 75%、3. 02%、2.53%、2.30%、1.21%。
1.3.9 样品测定
精密称取不同部位样品粉末各约0. 4 g,按1.3.3 项方法制备供试液,按照1.3.1 项下色谱条件注入液相色谱仪,每批平行测定3 次,记录色谱峰面积,用标准曲线计算含量。
2 结果与分析
2.1 绿原酸和阿魏酸的含量测定结果
绿原酸和阿魏酸是羌活中两种含量较高的有机酸,其测定结果见表1。由表1 可知,门源产宽叶羌活不同部位中绿原酸的含量由高到低依次为根(6.139 mg·g-1)>种子(5. 343 mg·g-1)>叶柄(3.377 mg·g-1)>叶片(3. 216 mg·g-1)>茎(2.615 mg·g-1),乐都产宽叶羌活不同部位中绿原酸的含量由高到低依次为种子(7.199 mg·g-1)>根(6. 479 mg·g-1)>叶片(3. 652 mg·g-1)>茎(2.127 mg·g-1)>叶柄(1.988 mg·g-1)。门源产宽叶羌活根中绿原酸含量最高,其次为种子,茎中绿原酸含量最低;乐都产宽叶羌活种子中绿原酸含量最高,其次为根,叶柄中绿原酸含量最低。
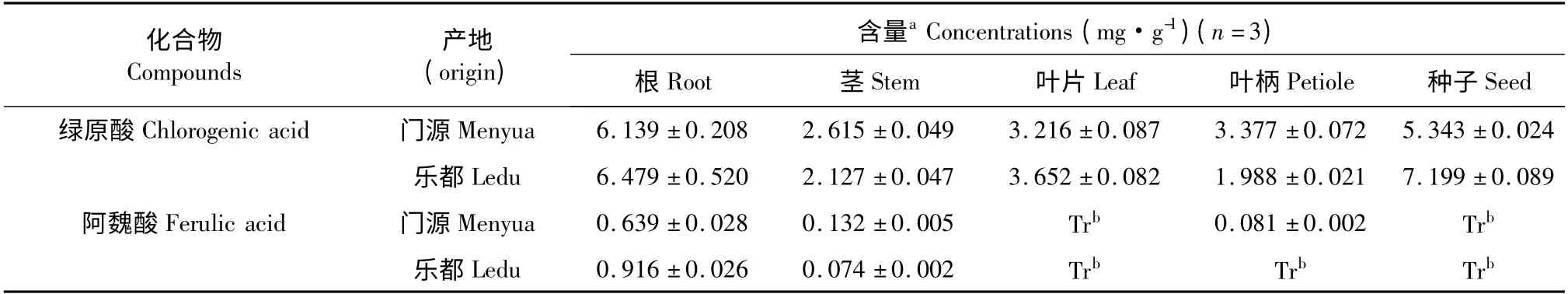
表1 宽叶羌活不同部位中绿原酸和阿魏酸的含量测定结果Table 1 Concentrations of chlorogenic acid and ferulic acid detected in different parts of N.forbesii collected from Menyuan and Ledu
门源和乐都产宽叶羌活阿魏酸含量最高的部位均为根(含量分别为0.639 mg·g-1和0.916 mg·g-1),其次均为茎(0.132 mg·g-1和0.074 mg·g-1),门源和乐都产宽叶羌活的叶片和种子以及乐都产宽叶羌活的叶柄中阿魏酸含量因低于定量限而未定量。两种产地宽叶羌活根中阿魏酸的含量均显著高于其他部位,茎中活性成分总含量虽较低,但其阿魏酸的含量高于地上部分其他部位。
2.2 紫花前胡苷、补骨脂素、佛手柑内酯和欧前胡素的测定结果
紫花前胡苷、补骨脂素、佛手柑内酯、欧前胡素、羌活醇和异欧前胡素等均为羌活的有效成分[15,16],这些活性成分的测定对于评价羌活药材的品质具有重要意义。
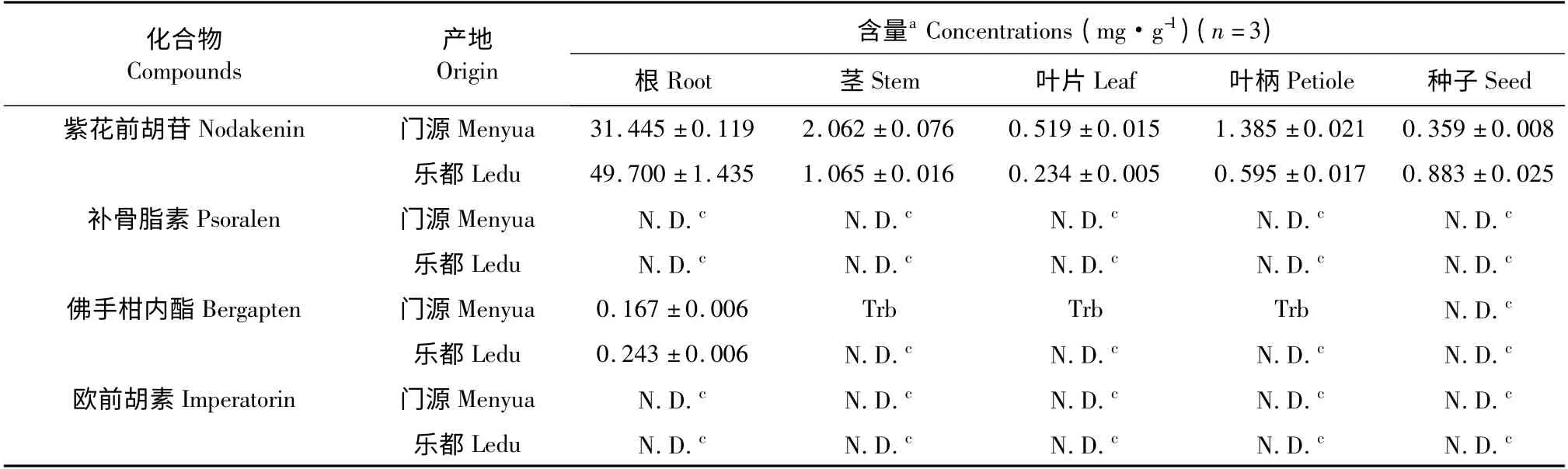
表2 宽叶羌活不同部位中紫花前胡苷、补骨脂素、佛手柑内酯和欧前胡素的含量测定结果Table 2 Concentrations of nodakenin,psoralen,bergapten and imperatorin detected in different parts of N.forbesii collected from Menyuan and Ledu
由表2 测定结果可知,门源产宽叶羌活不同部位中紫花前胡苷的含量由高到低依次为根(31.445 mg·g-1)>茎(2.062 mg·g-1)>叶柄(1.358 mg·g-1)>叶片(0. 519 mg·g-1)>种子(0. 359 mg·g-1);乐都产宽叶羌活不同部位中紫花前胡苷的含量由高到低依次为根(49.700 mg·g-1)>茎(1.065 mg·g-1)>种子(0.883 mg·g-1)>叶柄(0.0.595 mg·g-1)>叶片(0.234 mg·g-1)。两种产地宽叶羌活中紫花前胡苷含量最高的部位均为根(含量分别为31.445 mg·g-1和49.700 mg·g-1),其次均为茎(2.062 mg·g-1和1.065 mg·g-1)。有文献报道[2]曾从羌活乙醇提取部分分离得到了补骨脂素,李云霞[15]等对羌活超临界CO2提取物进行分离与鉴定,得到了香豆素类化合物欧前胡素,门源和乐都产宽叶羌活不同部位中均未检测出这两种成分,这可能与基源植物、产地、提取方法等不同等有关。佛手柑内酯的含量也较低,两种产地宽叶羌活中均仅测出根中佛手柑内酯的含量(0.167 mg·g-1和0.243 mg·g-1),其他部位该成分由于低于检测限(或定量限)而未被检出(或不能准确定量)。
2.3 羌活醇和异欧前胡素的含量测定结果
羌活中羌活醇和异欧前胡素的含量较高,它们是评价该药材质量的两个重要指标。2010 年版《中国药典》[1]规定按干燥品计算,羌活中羌活醇和异欧前胡素的总量不得低于0.4%(4 mg·g-1)。

表3 宽叶羌活不同部位中羌活醇和异欧前胡素的含量测定结果Table 3 Concentrations of notopterol and isoimperatorin detected in different parts of N.forbesii collected from Menyuan and Ledu
由表3 测定结果可知,门源和乐都产宽叶羌活不同部位中羌活醇的含量由高到低均依次为根(含量分别为0.322 mg·g-1和0.561 mg·g-1,下同)>种子(0. 208 mg·g-1和0. 297 mg·g-1)>叶柄(0.181 mg·g-1和0.188 mg·g-1)>叶片(0.175 mg·g-1和0.153 mg·g-1)>茎(0.083 mg·g-1和微量)。门源和乐都产宽叶羌活不同部位中异欧前胡素的含量由高到低均依次为根(14.100 mg·g-1和22.205 mg·g-1)>种子(4.960 mg·g-1和9.382 mg·g-1)>叶柄(1.583 mg·g-1和1.030 mg·g-1)>叶片(1.141 mg·g-1和0.503 mg·g-1)>茎(1.017 mg·g-1和0.366 mg·g-1)。两种产地宽叶羌活根中羌活醇和异欧前胡素的含量之和均远高于药典所规定的最低标准;地上部分中,只有种子中二者含量之和达到药典要求,说明以宽叶羌活根茎及根入药的传统方法具有一定的合理性。
2.4 宽叶羌活和羌活不同部位中主要活性成分含量的比较
根据本课题前期的试验结果[17],我们发现门源和乐都产羌活根中活性成分含量最高的3 种成分均为羌活醇>绿原酸>异欧前胡素,地上部分各部位中含量最高的成分均为绿原酸(门源产羌活叶片除外)。本实验的结果表明,门源和乐都产宽叶羌活根中活性成分含量最高的3 种成分均为紫花前胡苷>异欧前胡素>绿原酸,地上部分各部位中含量最高的成分也均为绿原酸。羌活和宽叶羌活根部活性成分的总含量均显著高于其他部位。对于地上部分,羌活的叶片和叶柄中活性成分的总含量高于种子和茎中活性成分的总含量;而宽叶羌活种子中活性成分的总含量高于地上部分其他部位。
宽叶羌活根中紫花前胡苷的含量明显高于羌活,其异欧前胡素的含量也较羌活高,但其羌活醇的含量却显著低于羌活。宽叶羌活根、茎、叶片和叶柄中绿原酸的含量与羌活相应部位的含量相差不大,但宽叶羌活种子中绿原酸的含量远高于羌活,其含量与根中绿原酸的含量相近。此外,根中含量较高的羌活醇、异欧前胡素和紫花前胡苷在地上部分其他部位中的含量均很低,甚至要低于其他成分的含量。门源和乐都产宽叶羌活和羌活地上部分各部位中含量最高的均为绿原酸(乐都产宽叶羌活种子和门源产羌活叶片除外),这说明羌活醇、异欧前胡素和紫花前胡苷主要富集在根部,绿原酸在全草中均广泛分布。
3 讨论
门源产宽叶羌活不同部位中所测活性成分总含量由高到低依次为根(52.812 mg·g-1)>种子(10.870 mg·g-1)>叶柄(6.607 mg·g-1)>茎(5.909 mg·g-1)>叶片(5.051 mg·g-1),乐都产宽叶羌活不同部位中所测活性成分总含量由高到低依次为根(80.104 mg·g-1)>种子(17.761 mg·g-1)>叶片(4.542 mg·g-1)>叶柄(3.801 mg·g-1)>茎(3.632 mg·g-1)。宽叶羌活和羌活均为伞形科多年生草本植物,根和根茎粗壮,圆柱形或不规则块状,二者根的形态相似,不易区分。两种产地宽叶羌活和羌活根部活性成分总含量均明显高于其他部位,门源和乐都产宽叶羌活根部活性成分总含量比其他部位分别高4.9~10.5 倍和4.5~22.1 倍,羌活根部活性成分总含量比其他部位分别高5.4~38.4 倍和4.7~21.8 倍,这与传统上以其根茎及根入药相符。
不同基源植物、同一植物不同部位各活性成分的含量均存在一定的差异。宽叶羌活中含量较高的成分为紫花前胡苷、异欧前胡素和绿原酸等,羌活中含量较高的成分有羌活醇、绿原酸和异欧前胡素等。宽叶羌活中紫花前胡苷的含量明显高于羌活,异欧前胡素的含量也较后者高,而其羌活醇的含量显著低于羌活。紫花前胡苷、羌活醇和异欧前胡素等主要富集于根部,绿原酸在全草中均广泛分布,阿魏酸、补骨脂素、佛手柑内酯和欧前胡素的含量均较低。
药典中规定羌活中羌活醇和异欧前胡素的总量不得低于0.4%(4 mg·g-1),本实验两种产地宽叶羌活根中羌活醇和异欧前胡素的总含量均远远高于药典所规定的最低标准,地上部分的种子中二者的含量之和(5.168 mg·g-1和9.679 mg·g-1)也达到要求,说明宽叶羌活种子也具有较高的药用价值。茎中活性成分总含量虽较低,但两种产地宽叶羌活茎中阿魏酸和紫花前胡苷的含量高于地上部分其他部位。茎、叶片和叶柄色谱图中也存在一些含量较高的未知峰,这些化学成分的分离和鉴定及其药理活性的评价有待于进一步的研究。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典). Beijing:China Medical Science Press,2010,VolⅠ:170-171.
2 Sun YF(孙友富),Sun YR(孙玉茄).Studies on the chemical compositions of Notopterygium incisum Ting(Ⅱ)-Isolation and identification of the chemical compositions from ethanol extracts of Notopterygium incisum Ting.Bull Chin Mater Med(中药通报),1985,10(3):31-33.
3 Zhang MF(张明发),Shen YQ(沈雅琴). Proceeding of pharmacological research on rhizoma et radix Notopterygii.China Licensed Pharmacist,2008,5(53):28-30.
4 Xie ZW(谢宗万).Discussing about the Species of Chinese Herbal Medicines(中药材品种论述). Shanghai:Shanghai Scientific and Technical Publishers,1964:142.
5 Che MF(车明凤),Li JD(李九丹),Su XL(粟晓黎).Comparison of the chemical components of qianghuo from 4 kinds of origin plants. J Chin Med Mater(中药 材),1992,15(11):33.
6 Wang YP(王幼平),Pu FD(溥发鼎),He XJ(何兴金).Study on Chinese medicine qianghuo. Nat Prod Res Dev(天然产物研究与开发),1993,5(4):40-46.
7 The Health Department of Xinjiang Autonomous Region(新疆自治区卫生局).Chinese herbal medicine in Xinjiang(新疆中草药). Urumchi:Xinjiang People's Publishing House,1975,398.
8 Zhang HQ(张涵庆),Xian QM(鲜启明),Yuan CQ(袁昌齐).Chemical constituents of the essential oil in the root of Chinese crude drug Angelica glauca Edgew.J Plant Res Envi(植物资源与环境),1992,1:44-48.
9 Gao JB(高建邦),Song PS(宋平顺),Yu X(郁霞).Simultaneous determination of isoimperatorin and ferulic acid in Rhizoma et Radix Notopterygii. J Chin Med Mater(中 药材),2010,33:231-233.
10 Chen Y(陈燕),Yi JH(易进海),Liu YH(刘云华),et al.Study on the quality standard for Notopterygii Rhizoma et Radix.Chin J Pharm Anal(药物分析杂志),2010,30:945-949.
11 Yang SB(杨仕兵),Liu DM(刘德铭),Peng M(彭敏),et al.Chemical components of liposoluble constituents from the roots of Notopterygium incisum Ting ex H.T.Chang in different districts of Qinghai.Nat Prod Res Dev(天然产物研究与开发),2007,19:259-262.
12 Hu MY(胡敏燕),Liu XF(刘显福). The volatilization oil compare of the same part of Notopterygium incisium picked in different seasons.Asia-Pacific Tradi Med(亚太传统医药),2008,4(6):40-41.
13 Wang XX(王小仙),Zhang XH(张晓红). Comparison of the essential oil yield in Rhizoma et Radix Notopterygii purchased at various times.Chin J Chin Mat Med(中国中药杂志),2002,27:617-618.
14 Liu WG(刘卫根),Wang LS(王亮生),Xu WH(徐文华),et al.Quantitative analysis of the main organic acids and coumarin compounds in different commercial parts of Notopterygium incisum.Chin Tradit Pat Med(中成药),2012,34:134-139.
15 Li YX(李云霞). Normalization of quality criteria of traditional Chinese medicine Notopterygii Rhizoma et Radix.Shenyang:Liaoning College of Traditional Chinese Medicine(辽宁中医学院),MSc.2004.
16 Zhang N(张娜),Meng XS(孟宪生),Cao AM(曹爱民),et al.A review about the chemical compositions and quality evaluation methods of Qianghuo. Lishizhen Med Mat Med Res(时珍国医国药),2006,17:2085-2087.
17 Liu WG(刘卫根),Wang LS(王亮生),Zhou GY(周国英),et al.Comparison of the contents of main organic acids and coumarins compounds in different parts of Notopterygium incisum.Chin J Pharm Anal(药物分析杂志),2012,32(11):43-50.

