天然红色素灵菌红素的抗菌性能及应用
王玉洁,孙诗清,朱长俊,刘晓侠
嘉兴学院 生物与化学工程学院,嘉兴314001
天然色素与化学合成色素相比,具有生产过程友好,安全性高、无毒、色泽自然鲜艳,且有些天然色素具有一定的营养价值和保健作用[1,2]。近年来,天然色素的需求每年呈递增趋势,而天然色素的开发生产远不能满足需要。目前大多数天然色素来源于植物,但由于植物生长周期长且受季节、气候、产地等因素的影响,提取工艺复杂,致使天然色素价格昂贵,推广应用受到局限[3]。开发新品种的天然色素,探索新的天然色素来源,对原有天然色素的生产工艺进行改进,扩大天然色素的应用范围,降低天然色素的生产成本,已成为生产中需要迫切解决的问题。
灵菌红素(Prodigiosins,PG)是由微生物产生的一类具有重要生物活性的天然色素,通常含有3 个吡咯环组成的甲氧基吡咯骨架结构[4]。近年来发现灵菌红素具有自身免疫抑制活性[5]和对肺癌、胰腺癌、前列腺癌等多种人癌细胞有抗性作用,在相同的作用剂量下,对正常细胞无任何毒害作用[6-7],已成为一种极具发展潜力的抗癌候选药物。另外灵菌红素在极低的浓度下,能快速杀死导致赤潮的浮游生物[8],在水体污染的治理方面显示出巨大的威力。初步研究表明,天然色素灵菌红素在羊毛、变性聚丙烯腈纤维等织物上具有良好的上染率和抗菌性能[9-12]。最新的研究表明灵菌红素还可作为紫外线的保护剂[13]。
本文考察了发酵生产红色素的抗菌性,并以此作为环保染料,考察其对天然纤维真丝和棉的染色性能及其抗菌性,为其作为抗菌生态染料应用开发提供基础数据。
1 材料与方法
1.1 菌种
粘质沙雷氏菌jx1(Serratia marcescens jx1)、金黄色葡萄球菌(Staphyloccocus aureus),大肠杆菌(Escherichia coli),枯草芽孢杆菌(Bacillus subtilis),由实验室保藏。
1.2 培养基
种子培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂18,pH 7.4~7.6。
发酵培养基(g/L):蛋白胨13. 0,甘油20. 0,MgSO41.2,NaCl 5.0,摇瓶装液量20 mL/100 mL(V/V),接种量5%(V/V),pH 6.5。
1.3 培养方法
种子培养:菌株经斜面活化后,接入种子培养基中,37 ℃、180 rrpm 的摇床培养12 h。
发酵培养:250 mL 三角瓶,装液量50 mL,按5%的接种量接种至发酵培养基中,28 ℃、180 rpm摇床上培养48 h。
1.4 红色素的提取
量取上述发酵液10 mL,离心10,000 rmp,10 min,取沉淀加丙酮20 mL 充分混和提取10 min,10 000 rmp 离心10 min,取上清液。旋转蒸发至恒重,再溶于乙酸乙酯,经滤纸过滤后,旋转蒸发至恒重,得红色素样品。
1.5 红色素染色
取干燥研磨后的灵菌红素0.1 g 溶于25 mL 乙醇中,溶解后用蒸馏水定容至50 mL。将50 mL 初染料加入锥形瓶中,同时加入50 mL 水以及1 mL 冰醋,摇匀即制得染料。染料用量为1%(o. w. f),浴比1∶30,pH 值为4.0~6.0,染色温度为100 ℃,染色时间为1 h。
1.6 红色素抑菌性能测试
1.6.1 不同浓度红色素灵菌红素的抑菌性能测定
取待测菌悬液0.1 mL(106-107CFU /mL),用涂布棒将菌液涂布均匀。分别吸取10 μL 浓度为4、2 和1 mg/mL 的灵菌红素溶液于无菌干燥滤纸片(直径5 mm),贴在含菌平板上,用乙醇作对照,每种菌做三个重复。将培养皿置于37 ℃恒温箱中培养24 h,采用十字交叉法测定含药滤纸片的抑菌圈直径大小,取平均值,比较抑菌效果。
1.6.2 灵菌红素的最小抑菌浓度测定
液体倍数稀释法测定最小抑菌浓度(Mininum Inhibitory Concentration MIC)测定方法在文献[14]基础上稍作修改。液体培养基按每管3 mL 分装试管,再加入不同量的灵菌红素溶液,配成一系列浓度梯度的培养基。每支试管培养基接种0.15 mL 的待测菌液,于37 ℃恒温震荡培养箱中培养24 h,另取加入与灵菌红素等量的二甲基亚砜(DMSO)及无菌水作为对照。以肉眼观察培养基澄清,无细菌生长时的最低浓度为MIC。
1.6.3 灵菌红素的最小杀菌浓度测定
从各试验的MIC 和高于MIC 的试管中吸取0.15 mL 培养物转接于相应的液体培养基上37 ℃培养24 h,观察菌体的生长情况,无菌落生长(澄清试管)的最小浓度即为该药液对该菌的最小杀菌浓度(MBC)。
1.7 上染率测试
通过测灵菌红素的最大吸收波长535 nm 处的吸光度来计算上染率。上染率的测试公式:
上染百分率 = (1-Ei/E0)× 100%
式中:Ei— 染液残液吸光度;E0— 原染液吸光度
1.8 灵菌红素染色织物的抗菌性测定
1.8.1 平板抑菌圈法
参照GB/T 20944.1-2008 国标法。将待测菌株活化,配制成合适密度的菌悬液(1 ×108CFU/mL~5 ×108CFU/mL),取0.1 mL 进行涂布平板,然后将原始织物和染色织物分别剪碎,紧密堆于涂布了待测菌种的平板中间,直径约为2 cm,于37 ℃下培养24 h,测量其抑菌圈直径。
1.8.2 震荡法
参照GB/T 20944.3-2008 国标法。将待测菌株活化,挑取至牛肉膏蛋白胨液体培养基中配制成合适浓度的菌悬液,称取原始织物和染色织物各0.75 g,剪成0.5 cm 方块,用纸包包好,合适条件灭菌,分别装入70 mL 已灭菌的PBS 三角烧瓶,200 rpm,37℃,培养24 h,分别取培养液作梯度稀释,取0.1 mL合适稀释浓度的菌液涂布平板,选取合适的菌落数计数,计算抑菌率。
抑菌率(%)=〔(A 一B)/A〕× 100%
式中:A 为对照布样平均菌落数;B 为抗菌布样平均菌落数。
2 结果与讨论
2.1 不同浓度红色素灵菌红素的抑菌性能测定
通过平板抑菌圈法定性测定灵菌红素的抑菌性,结果如图1 所示。
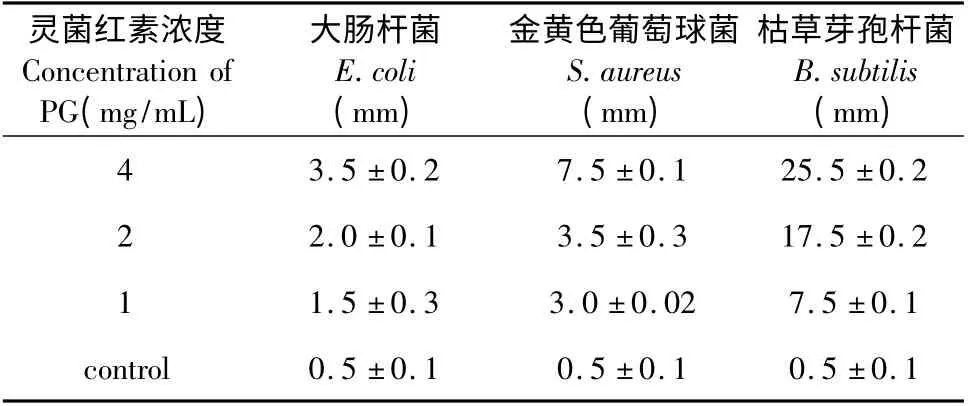
表1 不同浓度灵菌红素对细菌的抑菌圈大小比较Table 1 Inhibition zone of different concentration of prodigiosin
灵菌红素对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌都有一定的抑制作用,且抑菌效果随着浓度的增加而增强。在这三种待试菌种中,灵菌红素对枯草芽孢杆菌的抑制能力最强,金黄色葡萄球菌次之,而对大肠杆菌的抑制能力最弱。
2.2 灵菌红素最小抑菌浓度和最小杀菌浓度的测定
通过测定最小抑菌浓度(MIC)和最小杀菌浓度(MBC)来量化灵菌红素的抑菌性能。将在测定抑菌实验中,未长菌的实验组进行转接,获最小杀菌浓度,结果如表2-表7 所示。

表2 大肠杆菌MIC 实验结果Table 2 Results of MIC on E.coli

表3 大肠杆菌MBC 实验结果Table 3 Results of MBC on E.coli
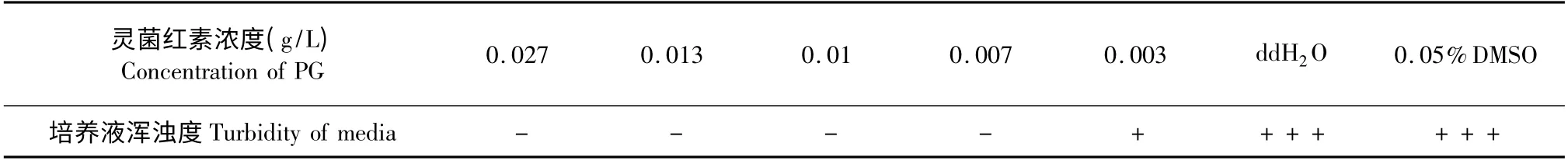
表4 枯草芽孢杆菌MIC 测定Table 4 Results of MIC on B.subtilis

表5 枯草芽孢杆菌MBC 测定Table 5 Results of MBC on B.subtilis

表6 金黄色葡萄球菌MIC 测定Table 6 Results of MIC on S.aureus

表7 金黄色葡萄球菌MBC 测定Table 7 Results of MBC on S.aureus
由表2-表7 可知,灵菌红素对大肠杆菌最小抑菌浓度MIC 为0. 05 g/L 培养基,最小杀菌浓度MBC 为0.8 g/L 培养基;对枯草芽孢杆菌的MIC 为0.007 g/L 培养基,MBC 为0.013 g/L 培养基,对金黄色葡萄球菌的最小抑菌浓度MIC 为0.002 g/L 培养基,最小杀菌浓度MBC 为0.005 g/L 培养基。灵菌红素对革兰氏阳性菌的抑菌效果要优于革兰氏阴性菌,这与Mekhael 等[13]的实验结果一致,其抑菌机理还需进一步研究。
2.3 不同天然织物的上染率
在同样的染色条件下,测的灵菌红素染料对棉织物和真丝的上染率,见图1。
从图1 中可以看出,灵菌红素对真丝的亲和力要高于棉织物,可能的原因与天然纤维的结构有关。丝纤维是由若干直径10 毫微米左右的丝朊散纤维构成,内部存在小孔隙,在热胀冷缩的条件下,染料分子进入孔隙,较难析出。而棉纤维为较大的多孔性结构,较易析出,表现出亲和力较低。

图1 不同织物的上染率Fig.1 Dye-uptake of different fabrics
2.4 灵菌红素对天然纤维的染色性能及抗菌性

采用灵菌红素制备成染料,分别对真丝和棉织物进行初步染色并对其抗菌性能进行测试。首先测定真丝染色后的平板抑菌圈见图2。
实验测得染色后的纤维对金黄色葡萄球菌的抑菌直径为1.1 cm,而对照仅为0.27 cm,对染色后的纤维大肠杆菌的抑菌直径为0.125 cm,对照抑菌直径为0.05 cm,根据GB/T20944-2008 中的琼脂平皿扩散法的抗菌效果评价,可以看出抑菌圈直径在0~1 mm 之间,织物下无细菌繁殖,评价为效果好。根据棉织物染色后平板抑菌圈(图未显示)明显,抑菌效果好。并进一步采用振荡法测定其抑菌率,染色后真丝对大肠杆菌的抑菌率为95.2%,而对金黄色葡萄球菌的抑菌率为90.1%。钟绵国等利用灵菌红素对羊毛、腈纶等织物染色后对大肠杆菌抑菌率达也均达到80%以上[9],而Alihosseini 等对染色后丝的抗菌性进行测试,对大肠杆菌的抑菌率为35%,对金黄色葡萄球菌的抑菌率为29%,而染色后棉织物未表现出抗菌性[11],有些染色后不同织物和不同染色方法所染的相同织物抑菌率存在显著差异,可能的原因,一方面和染色方法及织物中所含的灵菌红素量有关,另一方面这可能和织物的纤维结构以及染料对其亲和力有关,具体原因尚有待进一步研究。
3 结论
3.1 灵菌红素对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌具有良好抗性,对革兰氏阳性菌要优于革兰氏阴性菌。
3.2 灵菌红素作为染料,对真丝的亲和力要大于棉织物。
3.3 经灵菌红素染色后天然纤维,对革兰氏阴性菌和革兰氏阳性菌均表现出良好的抗菌性,但对革兰氏阴性菌的抗性要优于革兰氏阳性菌,这和游离的灵菌红素的抗菌性不同,具体原因尚需进一步研究。
1 Xu QH(徐清海),Ming X(明霞).Extraction on natural pigment and its physiological functions. App Chem industry(应用化工),2005,34:961-963.
2 Fan CM(范春梅),Liu XW(刘学文),Wu XM(伍学明),et al.Research progress and application prospect of curcumin.China Condlment(中国调味品),2011,36(10):4-7.
3 Shen GQ(沈国强),Yang CX(杨春霞),Zhang D(张栋).Research and development of nature colorant(dyestuff).Dyestuffs and Coloration(染料与染色),2009,4:7-10.
4 Williamson NR,Fineran PC,Leeper FJ,et al.The biosynthesis and regulation of bacterial prodiginines. Nat Rev Microbio,2006,4:887-899.
5 Pérez-Tomás R,Viñas M. New insights on the antitumoral properties of prodiginines. Curr Med Chem 2010,17:2222-31.
6 Monge M,Vilaseca M,Soto-Cerrato V,et al.Proteomic analysis of prodigiosin-induced apoptosis in a breast cancer mitoxantrone-resistant (MCF-7 MR)cell line. Invest New Drug.2007,25:21-29.
7 Ho TF,Peng YT,Chuang SM,et al. Prodigiosin down-regulates survivin to facilitate paclitaxel sensitization in human breast carcinoma cell lines. Toxicol Appl Pharmacol. 2009,235:253-260.
8 Kim D,Kim JF,Yim JH,et al.Red to red the marine bacterium Hahella chejuensis and its product prodigiosin for mitigation of harmful algal blooms. J Microbiol Biotechnol. 2008,18:1621-1629.
9 Zhong JG(钟绵国),Zhao T(赵涛). A study on dyeing properties of prodigiosin pigments.Dyestuffs and Coloration(染料与染色),2009,46(6):15-18.
10 Zhong JG(钟绵国),Zhao T(赵涛).Kinetics and thermodynamics studies of prodigiosin dyeing on wool fabrics. Wool Textile J(毛纺科技),2010,38(7):15-18.
11 Alihosseini F,Ju KS,Lango J,et al.Antibacterial Colorants:Characterization of prodiginines and their applications on textile materials.Biotechnol Prog,2008,24:742-747.
12 Alihosseini F,Lango Ju KS,Hammock BD,et al.Mutation of bacterium Vibrio gazogenes for selective preparation of colorants.Biotechnol Prog,2010,26;352-360.
13 Boric' M,Danevĉiĉ T,Stopar D. Prodigiosin from Vibrio sp.DSM 14379;a new UV-protective pigment. Microb Ecol.2011,62:528-536.

