N-乙酰半胱氨酸对活性氧诱导耳蜗毛细胞凋亡的抑制作用的观察
原红艳 张淑香 李兴启 李树华
药物性、噪声性、缺血再灌注及老年性听力损失均与活性氧(reactive oxygen species,ROS)密切相关[1~4],ROS参与了耳蜗组织损伤及耳蜗毛细胞凋亡的过程。目前临床上对这些感音神性聋的治疗效果还不十分满意,所用药物多局限于改善局部血流,尚无针对自由基来进行治疗的有效药物,因此努力寻找高效低毒的天然抗氧化剂及设法调动或激活机体中的内源性抗氧化剂至关重要。本研究旨在观察抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)对外源性H2O2诱导的耳蜗毛细胞凋亡的抑制作用,报告如下。
1 材料与方法
1.1 实验动物及分组 选用新生1~5天SD 大鼠24只,购自中国人民解放军总医院实验动物中心,雌雄不拘,样本数以耳计。随机分为4组,每组6只(12耳):①无血清培养基组;②0.1mmol/L H2O2组(H2O2组);③10mmol/L NAC组(NAC组);④10mmol/L NAC+0.1mmol/L H2O2组(NAC+H2O2组)。
1.2 主要试剂与仪器 解剖显微镜:SZ3060型,奥林巴斯公司产品;CO2培养箱:3548 型,美国FORMA 公司产品;荧光显微镜:CX41-32RFL型,奥林巴斯公司产品;N-乙酰半胱氨酸(NAC):Sigma A7250;无血清添加剂(Serum-Free supplement):Sigma I-1884;丫啶橙(acridine orange,AO);华美生物工程技术有限公司BS0043;碘化丙啶(propidium iodide,PI);Sigma P-4170。
1.3 实验方法
1.3.1 新生大鼠耳蜗Corti器的体外培养 将大鼠在-20℃环境下低温麻醉3~5分钟,待皮肤变白、不能活动后,浸于75%乙醇中消毒2分钟后取出,眼科剪断头,剪开颅骨,去除脑组织,剪下颞骨,置于盛有PBS的培养皿中,在超净工作台的解剖显微镜下分离出Corti器,并用尖刀按顶回、中回、底回将其分为3段。将分割好的组织片段移入盛有1ml无血清培养液(Serum-Free Medium)的培养皿中,并使其下沉到培养皿底部。最后将培养皿缓慢移入37 ℃、5%CO2培养箱进行培养。整个解剖过程必须迅速、准确,严格无菌操作。各组动物Corti器均在无血清培养液组培养24小时后,弃去原培养液,换入新的各组相对应的培养液,继续培养24小时。培养期间在倒置显微镜下观察基底膜Corti器的细胞结构和形态。
1.3.2 AO/PI双重染色及凋亡细胞的检测 吸干培养皿内培养液,加入含100 mmol/L AO 及10 mmol/L PI的PBS(0.1 M ,pH 6.8)染色15分钟,然后用PBS充分浸洗,再以4%多聚甲醛固定15~30分钟,最后用PBS冲洗,甘油封固。
在荧光显微镜下观察并摄像(荧光激发光波长360±10nm,发射光波长≥500nm)。经AO/PI双重染色后的基底膜,凋亡细胞被染为橙红色,活性细胞则为亮绿色。在单位长度的显微镜摄影取景框范围内对耳蜗内外毛细胞进行计数观察。
1.4 统计学方法 数据经统计软件State 4.0 处理,组间比较采用方差分析。
2 结果
2.1 各组耳蜗基底膜荧光显微镜观察结果 无血清培养基组在48小时培养过程中毛细胞始终保持良好的形态结构,在倒置显微镜下可以看到3排外毛细胞和1排内毛细胞及其周围的支持细胞,内外毛细胞排列整齐,无坏死脱落,经AO/PI染色后,内、外毛细胞均被染成亮绿色,轮廓清晰,活性良好(图1)。NAC 组耳蜗基底膜的形态结构与无血清培养基组无明显差异,经AO/PI染色后未见凋亡细胞(图2)。H2O2组培养过程中,毛细胞基本保持原有排列规律,经AO/PI染色后,可见大量凋亡细胞,细胞形态发生改变,出现水肿及碎裂,还有部分细胞缺失(图3)。NAC+H2O2组培养48小时后,细胞仍保持完好形态,染色后只见少许凋亡细胞(图4)。可见NAC明显减轻了H2O2对毛细胞的损伤程度。
2.2 各组毛细胞凋亡情况 无血清培养基组与NAC 组毛细胞凋亡率无显著差异(P >0.05),H2O2组和NAC+H2O2组凋亡率有显著性差异(P<0.05)(表1),说明NAC可明显减轻H2O2对耳蜗毛细胞的损伤。

图1 无血清培养基组耳蜗基底膜 经AO/PI染色后,内、外毛细胞均被染成亮绿色,轮廓清晰.(AO 和PI双重染色)×200 图2 NAC组耳蜗基底膜 内、外毛细胞均被染成亮绿色,轮廓清晰,保持完好活性(AO 和PI双重染色)×200 图3 H2O2组耳蜗底回基底膜 可见大量凋亡细胞,被染成橙红色(白箭头所示),还有个别OHC 保持活性,被染成绿色(黑箭头所示)(AO 和PI双重染色)×200 图4 NAC+H2O2组耳蜗基底膜 经AO/PI染色后,可见少许凋亡细胞(箭头所示),大部分OHC、IHC保持良好活性(AO和PI双重染色)×200
表1 各组耳蜗毛细胞凋亡情况(%,±s)
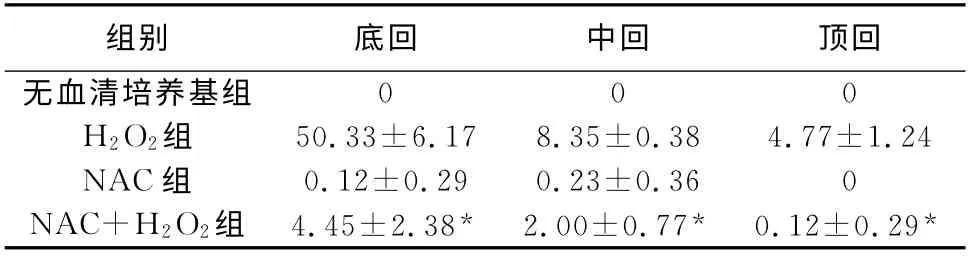
表1 各组耳蜗毛细胞凋亡情况(%,±s)
注:*与H2O2 组比较,P<0.05
组别底回中回顶回无血清培养基组0 0 0 H2O2组50.33±6.17 8.35±0.38 4.77±1.24 NAC组0.12±0.29 0.23±0.36 0 NAC+H2O2组 4.45±2.38* 2.00±0.77* 0.12±0.29*
3 讨论
3.1 H2O2诱导的耳蜗毛细胞凋亡 大量研究证明ROS参与介导了细胞凋亡的过程。在耳蜗感觉细胞营养因子去除或顺铂引起的耳毒性过程中耳蜗内ROS大量增加,这些自由基与毛细胞膜磷脂交互作用产生脂质过氧化物,其中一些脂质过氧化物作为听神经及毛细胞凋亡的介质最终引起毛细胞凋亡[5]。在应用庆大霉素等氨基糖苷类抗生素后,内耳血流减少及随后的再灌注损伤;噪声暴露后基底膜过度振动导致局部组织机械损伤等,这些过程中均有大量自由基产生,清除自由基的酶及其代谢产物的消耗,均可诱导毛细胞的凋亡[1,6]。此外,多数研究认为,Ca2+可促进细胞凋亡,胞浆内Ca2+浓度增加可作为细胞凋亡起始的早期信号[7];而细胞内游离Ca2+浓度增高,一方面又会促使自由基增加进一步造成细胞的直接损害,另一方面也可能通过钙调蛋白进一步激活蛋白激酶C,导致蛋白磷酸化,从而影响细胞的生长分化[8]。本实验发现H2O2组耳蜗基底膜有大量凋亡毛细胞,OHC 损伤最重,IHC次之,未见支持细胞凋亡,说明ROS促进了毛细胞的凋亡。
3.2 抗氧化剂NAC对H2O2诱导的耳蜗毛细胞凋亡的保护作用之机理 本实验中NAC 组细胞凋亡率并无显著变化,提示NAC 本身对细胞并无毒性作用,为临床使用的安全性奠定了基础。NAC 是一种含巯基化合物,主要用于治疗充血性和阻塞性肺部疾患如慢性支气管炎以及成人呼吸窘迫综合征和急慢性炎症[9];它作为体内活性氧系列物质(如H2O2和O2-)的清除剂和还原型谷胱甘肽(GSH)的供给体,在机体抗氧化反应中有重要作用[10,11]。GSH是细胞内重要的保护性稳定因素,它的抗氧化作用位置是在细胞内,体内具有将氧化型谷胱甘肽(oxidized glutathione,GSSG)转变为还原型谷胱甘肽(GSH)的酶系统,但随活性氧浓度增加,体内酶活性降低,因此补充外源性GSH 就显得尤为重要。研究认为,NAC作为GSH 前体,在氧化应激发生、GSH 下降时,NAC具有提高GSH 的作用[12]。
本实验发现H2O2组耳蜗基底膜的细胞凋亡率较无血清培养基组显著提高,而加入NAC 干预后,明显抑制了H2O2的细胞毒性作用,表现为细胞凋亡率显著下降,提示NAC 对耳蜗毛细胞具有保护作用,而且与其抗氧化能力有关。NAC 可对抗多种损伤导致的细胞凋亡[13~15],NAC的保护机理有:①NAC可作为自由基的清除剂,干扰自由基的形成;②NAC的巯基作为H+供体而发挥直接的抗氧化作用;③NAC 作为还原型GSH 的前体,富集于细胞环境中时可提供GSH 发挥抗氧自由基的作用。此外,NAC 还能再合成具有生物活性的GSH起间接抗氧化作用。另有证据表明,细胞凋亡的诱导和抑制与信号传导通路有关,NAC可以干扰凋亡通路下游的信号[16]。
总之,NAC作为活性氧清除剂和GSH 前体,对活性氧诱导的毛细胞凋亡具有明显的抑制作用。但关于NAC 的化学特性、生物学特性及其在体内吸收和代谢环节、起始作用、靶细胞的作用位点及作用于大分子物质的本质还不十分明确,它能否应用于人体对抗氧化应激反应还有待于进一步研究。
1 麦尔,列纳,缇雪,等.一种预防噪声导致失聪的新方法[J].解放军医学杂志,2009,5:519.
2 Clerici WJ.Effects of superoxide dismutase and U74389Gon acute trimethltin-induced cochlear dysfunction[J].Toxicol Appl Pharmacol,1996,136:236.
3 Seidman MD,Bai U,Khan MJ,et al.Association of mitochondrial DAN delection and cochlear pathology:a molecular biological tool[J].Laryngoscope,1996,106:777.
4 Seidman MD,Bai U,Khan MJ,et al.Association of mitochondrial DAN delection associated with aging and presbyacusis[J].Arch Otolaryngol Head Neck Surg,1997,123:1 039.
5 于红,祝威,李兴启.活性氧与内耳毛细胞凋亡相关的信号转导及基因调控[J].国际耳鼻咽喉头颈外科杂志,2006,30:134.
6 曲雁,李云,丁大连.噪声性耳聋的研究进展[J].河北医科大学学报,2009,8:860.
7 薛全福,王振纲.钙离子和细胞凋亡及药物调控[J].中国全科医学,2009,12:1126.
8 赵舒武,高英茂,张晓丽.钙离子与缺氧性神经干细胞凋亡的相关性研究[J].中国组织化学与细胞化学杂志,2007,5:575.
9 刘积锋,钟小宁,何志义.N-乙酰半胱氨酸对大鼠慢性支气管炎与肺气肿形成影响的实验研究[J].中国实用医药,2008,10:1.
10 Ozaras R,Tahan V,Aydin S,et al.N-acetylcysteine attenuates alcohol-induced oxidative stress in the rat[J].World Journal of Gastroenterology,2003,1:125.
11 Gillissen A,Scharling B,Jaworska M,et al.Oxidant scavenger function of ambroxol invitro:acomparison with N-acetylcysteine[J].Res Exp Med,1997,196:389.
12 Eidelman LA,Pizov R,Sprung CL.New therapeutic approaches in sepsis:a critical review Intensive[J].Care Med,1995,21(Suppl 2):S269.
13 朱斌,孙家邦,李凯.N-乙酰半胱氨酸对大鼠急性坏死性胰腺炎胰腺损伤的影响[J].中华普通外科杂志,2009,11:904.
14 吴晓燕,任江华.N-乙酰半胱氨酸对心力衰竭兔核因子NF-κB活化及心肌凋亡的干预作用[J].中华急诊医学杂志,2008,3:276.
15 刘芸野,谢青,王晖,等.N-乙酰半胱氨酸对内质网应激介导的HepG2细胞凋亡的作用[J].中华肝脏病杂志,2008,7:524.
16 Brecher AS,Koenig MJ.Protection of chymotrypsin from inactivation by an N-mustardanalog[J].Toxicol Lett,1995,76:11.

