TECTA 基因突变与常染色体显性遗传非综合征型DFNA8/12型聋的研究进展*
郭亿莲 何琦 综述 袁慧军 审校
耳聋病因复杂,由多种因素共同引起,其中约60%属于遗传性聋,遗传性聋分为综合征型和非综合征型聋,常染色体显性遗传性聋约占15%~20%。分子遗传学技术的飞速发展使常染色体显性非综合征型聋的基因定位和克隆工作取得了令人瞩目的进展。1995年第一个非综合征型聋基因被克隆,目前已成功定位的非综合征型耳聋基因位点共116个,其中常染色体显性遗传性聋基因位点(DFNA)64个,成功克隆的DFNA 耳聋基因仅25个,α-盖膜蛋白(TECTA)基因是其中之一。TECTA基因突变引起的非综合征型聋已经在澳洲、比利时、瑞典、日本、法国、黎巴嫩有报道,本文就TECTA 基因与常染色体显性遗传非综合征型遗传性聋的遗传学研究进展作一综述。
1 TECTA 基因的功能研究
盖膜是内耳的一种细胞外基质,与毛细胞顶部的静纤毛相接触,当振动进入耳蜗时,盖膜与毛细胞向不同的指点方向运动,产生一个使静纤毛弯曲的剪切力,打开了传导通道,导致毛细胞去极化和突触激活,使声波转变为神经冲动,引起听觉。α-盖膜蛋白是盖膜的主要非胶原纤维成分,Hughes等[1]将小鼠α-盖膜蛋白基因定位在9号染色体,而该区域与人的11号染色体长臂在进化上是保守的;他同时将α-盖膜蛋白定位在11号染色体,在人的这个区域定位了两个常染色体显性遗传非综合征型位点DFNA8和DFNA12;DFNA8是一个澳大利亚的非综合征型感音神经性聋家系,DFNA12是一个比利时的常染色体显性遗传性中频听力下降语前聋家系。近年来各种证据显示DFNA8 和DFNA12 是由于人类α-盖膜蛋白基因突变引起这两个耳聋家系的两种表型[2]。
Verhoeven等[3]研究发现α-盖膜蛋白基因的突变可引起常染色体隐性遗传性聋21 型(DFNB21)和常染色体显性遗传性聋8 型和12 型(DFNA8/12),并确认人a-盖膜蛋白基因全长6465bp,含有23个外显子;编码的α-盖膜蛋白是一种含2155个氨基酸的膜蛋白,由三个不同的功能域组成:氨基末端区、中心区和羧基末端区,氨基末端区与一种基底膜蛋白entactin的球形区(gldomain)同源,中心区包括三个完整的和两个局部的D 重复功能域,简称ZA 区,羧基端为透明带(zona pellucida,简称ZP区),该透明带在β-盖膜蛋白也存在;这三个功能域通过二硫键结合并且与B-盖膜蛋白相互作用构成盖膜的非胶原基质成份。听力损失的频率范围与突变的区域有关:ZA 区的突变常导致高频区为主的进行性语后聋,ZP区突变导致的听力损失一般为以中频为主的语前聋。胡鹏等[4]在我国非综合征型语前聋人群的基因突变检测中发现了α-盖膜蛋白基因的3个多态改变。TECTA 编码的α-盖膜蛋白是最重要的非胶原耳蜗盖膜及前庭系统耳石膜的组成部分,盖膜蛋白是组成盖膜的重要的非胶原成份之一,在声刺激时盖膜与基底膜的相对运动导致静纤毛的机械运动,毛细胞去极化产生听觉;每个毛细胞伸出约100根静纤毛,其中最高的纤毛与盖膜相触,声音刺激时,盖膜与毛细胞间的剪切力引起静纤毛弯曲,继而牵拉临近静纤毛精细的顶端连系,进而直接打开于顶端连接处的转导通道,引发反应,正常的听觉要求这种活动得到精确的维护。人类的α-盖膜蛋白基因仅在盖膜和前庭感觉上皮表达,其突变可通过影响盖膜的运动导致听力下降。
2 TECTA 基因与常染色体显性遗传非综合征型DFNA8/12型聋相关性研究
Kirshhofer等[2]研究澳大利亚的一个DFNA8家系,该家系是一个生长在澳洲农村地区的家庭,家族四代均出现中度到重度、语前性、非进展性听力损失者,并伴随常染色体显性遗传。Verhoeven等[3]研究了比利时的一个DFNA12家系。这两个研究发现了TECTA 基因的六种错义突变,患者均为语前发病,表现为中度至重度的听力损失,病情相对稳定或呈非进展性,在家系中不论年龄性别,听力损失程度相似。
1998 年Verhoeven 等[3]在一个DFNA8 家族中发现Y1870C(5610A→G)突变,在一个DFNA12家族中发现 Leu1820Phe (5459C →T)和Gly1824Asp(5472G→A)突变,这三个突变都引起非进行性听力损失。
韩国学者Sagong等[5]报道在一个家系中发生在TECTA 等位基因上的一个错义突变(p.C1691F)和剪接突变(c.61623insT)的复合杂合突变可以导致听力障碍;这是第一次报道的发生在TECTA 基因的复合杂合突变导致的非综合征型感音性聋。
以色列科学家Gueta等[6]研究发现TECTA 基因上的C1509G 突变可导致盖膜与外毛细胞连接的缺乏,声音传导出现障碍,听力受损。Verhoeven等[2]研究发现α-盖膜蛋白基因的突变可引起常染色体隐性遗传性聋21 型(DFNB21)和常染色体显性遗传性聋8 型和12 型(DFNA8/12)。Collin等[7]在对荷兰的一个有常染色体显性遗传性中频听力损失的家庭成员进行了精细定位结合微卫星标记技术的全基因组单核苷酸多态性分析,绘制了DFNA8/12缺陷位点,所有外显子和内含子-外显子边界的突变引起DFNA8/12 的TECTA 基因均被定序,首次研究发现外显子16区域(c.5331G>A;p.L1777L)的同义TECTA 突变导致听力损失,这个改变揭示了外显子拼接增强子的缺失;使用外显子侧翼作为引物的RT-PCR 结果显示,除了预料中来自野生等位基因PCR 产物以外,还有一个仅存在于受影响个体更小的碎片,该碎片代表了部分异常的TECTA 转录缺少了外显子16区域,异常的剪接导致了TECTA 中37个氨基酸的缺失。值得指出的是TECTA 基因杂合突变在一个家系也可表现为语后发病,病情呈非进展性[8]。另外有研究报道一个家系有2 种形式的耳聋:常染色体显性遗传DFNA12和常染色体隐性遗传DFNB1,其原因是TECTA 和GJB2基因突变在一个家系中的不同个体中发生;DFNA12 定位于11q23—q24,由TECTA 基因突变引起,DFNA12也和常染色体隐性遗传DFNB1 有关[9]。目前在澳大利亚、瑞典、比利时、法国和西班牙的DFNA8/DFNAl2家系中共发现了TECTA 基因的六种错义突变,透明带和粘附带是tectorin蛋白与其他蛋白相互作用构成盖膜的两个重要区域,上述突变正是位于这两个区域内,因而导致盖膜结构的破坏,使敏感型毛细胞静纤毛束的声音传递效率降低。两个不同区域内的基因突变可以引起不同的DFNA8/DFNAl2表型,包括语前或语后聋、进行性或稳定性聋、中频或高频聋。Plantinga等[10]研究发现发生在透明带和粘附带的TECTA 突变分别与中频和高频聋相关。1999 年Balciuniene在一个DFNA12家族中发现引起重度耳聋的Cys1057Ser突变[11]。
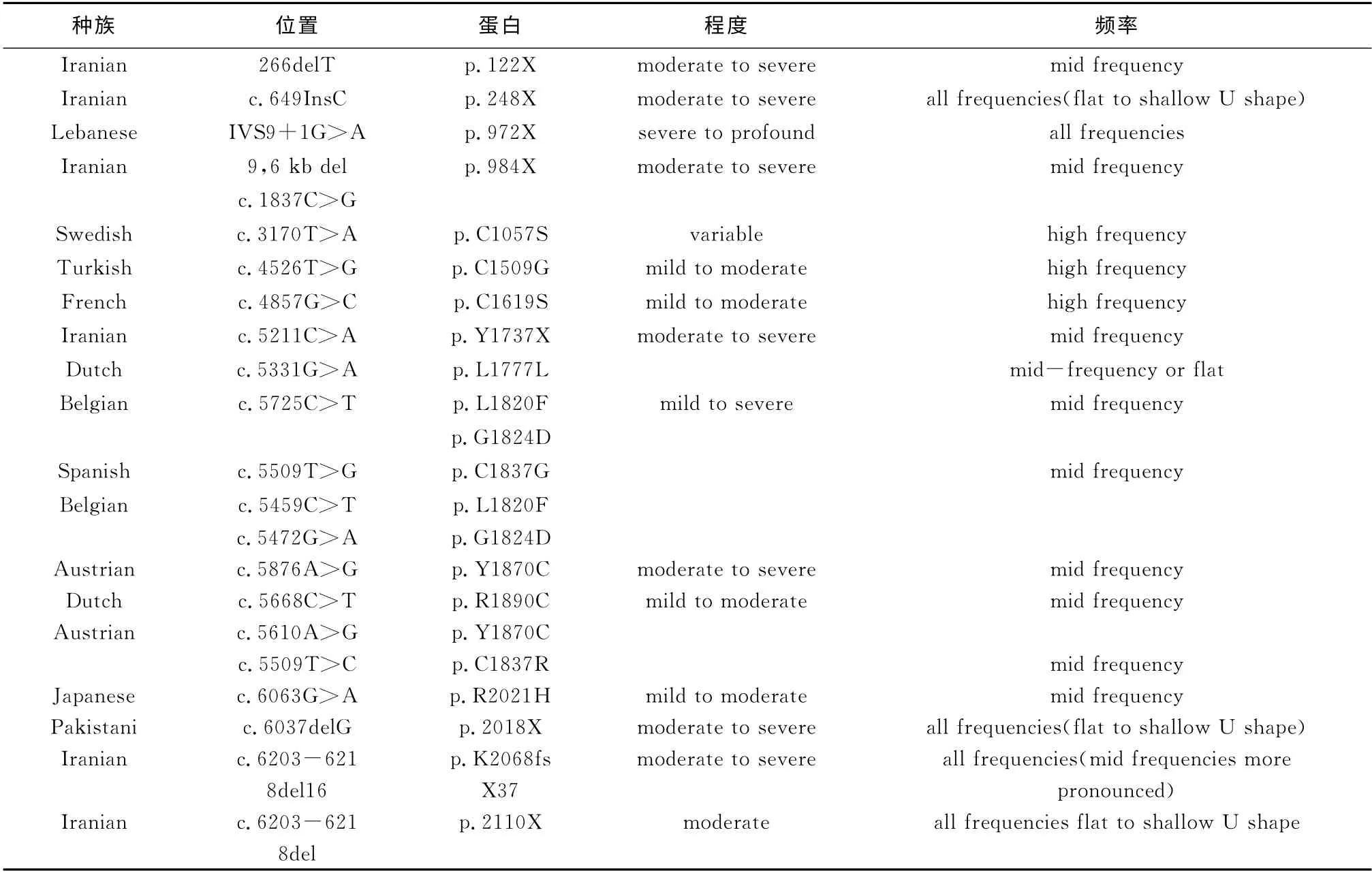
表1 已知TECTA 基因突变类型[13]
近年来由美国科学家发起了在多个国家对多个常染色体显性遗传非综合征型听力损失家系针对TECTA 基因的突变筛查,共筛查鉴定出23 个TECTA 基因突变位点,其中20个是新发现的,使已知TECTA 基因突变位点从13个增加到33个;突变区域发生在α-盖膜蛋白的所有区域,包括新发现的entactin区、vWFD1、vWFD2、vWFD3 以及D1-D2 和TIL2 链接区域[12]。表1 为已知的TECTA 基因突变类型。
由于非综合征型聋表现为高度的遗传异质性,即同一种耳聋表型可以由不同的基因位点上的基因突变引起,而同一个致聋基因不同位置突变又可引起不同的耳聋表型,使得耳聋家系的表型特征寻找相关致聋基因的对应关系复杂化,每一个耳聋家系的表型都可能具有唯一性和独特性[14]。
3 结论
引起耳聋的原因非常复杂,深刻认识各类型聋的发病机制是治疗耳聋的基础。随着非综合征型聋基因的定位与克隆、突变位点的研究,对非综合征型耳聋基因发病机制的认识不断深入。盖膜组织结构的完整性对听力的形成是很重要的,因此盖膜的任何组成成分的变异都可能引起听力下降。TECTA基因的研究为常染色体显性非综合征型聋的临床早期诊断、采取针对性的干预和治疗提供了依据。对这些引起听力损失基因的识别能更好的理解听觉的分子机制,对盖膜蛋白的进一步研究和寻找盖膜中新的组成成分将为听觉形成的分子机制提供依据。基因组学的发展使对引起听力损失基因的识别有了快速的进步,使对听力系统的细胞功能研究及发展有了快速的提高。
1 Hughes DC,Legan PK,Steel KP,et al.Mapping of theα-Tectorin Gene(TECTA)to mouse chromosome 9and human chromosome 11:a candiodate for human autosomal dominant nonsyndromic deafness[J].Genomics,1998,48:46.
2 Kirschhofer K,Kenyon J B,Hoover D M,et al.Autosomaldominant,prelingual,nonprogressive sensorineural hearing loss:localization of the gene(DFNA8)to chromosome 11q by linkage in an Austrian family[J].Cytogenet Cell Genet,1998,82:126.
3 Verhoeven K,Vanlaer L,Kirschhofer K,et al.Mutations in the human alpha-tectorin gene cause autosomal dominant non-syndromic hearing impairment[J].Nature Genet,1998,19:60.
4 胡鹏,谢鼎华,肖自安,等.非综合征型语前聋人群中a-盖膜蛋白基因突变检测[J].听力学及言语疾病杂志,2004,12:145.
5 Sagong B,Park HJ,Lee KY,et al.Identification and functional characterization of novel compound heterozygotic mutations in the TECTA gene[J].Gene,2011.[Epub ahead of print].
6 Gueta R,Levitt J,Xia A,et al.Structural and mechanical analysis of tectorial membrane Tecta mutants[J].Biophys J,2011,100:2 530.
7 Collin RW,De Heer AM,Oostrik J,et al.Mid-frequency DFNA8/12hearing loss caused by a synonymous TECTA mutation that affects an exonic splice enhancer[J].Eur J Hum Genet,2008,16:1 430.
8 Moreno-pelayo MA,Del Castillo I,Villamar M,et al.A cysteine substitution in the zona pellucida domain of alphatectorin results in autosomal dominant,postlingual,progressive,mid frequency hearing loss in a Spanish family[J].J Med Genet,2001,38:E13.
9 Meyer NC,Nishimura CJ,Mcmordie S,et al.Audioprofiling identifies TECTA and GJB2-related deafness segregating in a single extended pedigree[J].Clin Genet,2007,72:130.
10 Plantinga RF,De Brouwer AP,Huygen PL,et al.A novel TECTA mutation in a Dutch DFNA8/12family confirms genotype-phenotype correlation[J].J Assoc Res Otolaryngol,2006,7:173.
11 Balciuniene J,Dahl N,Jalonen P,et al.Alpha-tectorin involvement in hearing disabilities:one gene-two phenotypes[J].Hum Genet,1999,105:211.
12 Hildebrand MS,Morin M,Meyer NC,et al.DFNA8/12caused by TECTA mutations is the most identified subtype of nonsyndromic autosomal dominant hearing loss[J].Hum Mutat,2011,32:825.
13 Fatemeh A,Mohammad HS,Amir HB,et al.A novel TECTA mutation confirms the recognizable phenotype among autosomal recessive hearing impairment families[J].International Journal of Pediatric Otorhinolaryngology,2008,72:249.
14 王秋菊,杨伟炎,方耀云,等.常染色体显性遗传性耳聋家系的遗传学特征分析[J].中国听力语言康复科学杂志,2005(1):18.

