酸性α-淀粉酶基因在枯草芽孢杆菌中的高效表达*
王彩澜,刘新育,李学琴,刘亮伟,陈红歌
(河南农业大学生命科学学院农业部农业微生物酶工程重点实验室,河南郑州,450002)
酸性α-淀粉酶基因在枯草芽孢杆菌中的高效表达*
王彩澜,刘新育,李学琴,刘亮伟,陈红歌
(河南农业大学生命科学学院农业部农业微生物酶工程重点实验室,河南郑州,450002)
酸性α-淀粉酶是发酵行业用量最大的酶类,为了实现酸性α-淀粉酶基因的高效表达,将本实验室已经克隆得到的去信号肽的酸性α-淀粉酶基因在枯草芽孢杆菌WB600宿主中进行表达,成功的构建了表达菌株pHT43-amy/WB600。在初始菌浓度OD600为0.8时加入终浓度为0.9 mmol/L的IPTG,诱导6 h的条件下测得酶活力为1 230 U/mL,又由于宿主菌WB600外分泌蛋白较s少,因此具有明显的生产优势。
酸性α-淀粉酶基因,高效表达,枯草芽孢杆菌
α-淀粉酶(1,4-α-D-葡萄糖苷水解酶,EC 3.2.1.1)能够以淀粉为底物,从淀粉内部水解1,4-α-D-葡萄糖苷键,α-淀粉酶在淀粉加工以及味精、氨基酸、抗生素、乙醇等以淀粉为原料的发酵产品生产中具有重要的用途。酸性α-淀粉酶是指在较低 pH条件下(pH 4.0~5.0)仍能保持高酶活性的α-淀粉酶,作为一种极端环境淀粉酶在淀粉加工中显示出更大的应用价值。
目前,酸性α-淀粉酶尚没有工业产品,对酸性α-淀粉酶的研究多集中在产酶菌株筛选、异源高效表达等方面。枯草杆菌是发酵工业中的常用菌种,对人畜安全,是美国食品药物管理局(FDA)和中国农业部均批准使用的安全菌株。更为重要的是,外源基因在枯草芽孢杆菌中是分泌性表达,产物便于提取和纯化,这是大肠杆菌表达系统不可比拟的,因此枯草芽孢杆菌是极具潜力的基因工程宿主菌[1-2]。目前已有来自侧孢短芽孢杆菌碱性蛋白酶基因BLG4基因[3]﹑甘露聚糖酶基因 Man23[4]、耐高温 α-淀粉酶基因[5]等在枯草芽孢杆菌中得以高效表达。
本课题组先期已得到1株产酸性α-淀粉酶菌株——解淀粉芽孢杆菌B-5,其最适pH值为5.0,并克隆 该 酸 性 α-淀 粉 酶 基 因,NCBI登 录 号GU318401[6]。为获得该酸性α-淀粉酶基因的异源高效表达工程菌,本实验室构建了该基因在枯草芽孢杆菌中的重组表达载体,经转化后,通过对工程菌株诱导表达条件的优化,以期获得高活力酸性α-淀粉酶菌株,为酸性α-淀粉酶的实际应用打下基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
JM109,枯草芽孢杆菌WB600和pHT43质粒载体均为本实验室保存,pMD-19T-simple来自TaKa-Ra。
1.1.2 酶和试剂
限制性内切酶BamHⅠ、SmaⅠ,ExTaq酶,Premix EX Taq Version2.0,Rnase,T4 DNA Ligase,氨苄青霉素 Amp,氯霉素 Cm,IPTG,DL2000 DNA Marker,λHindⅢ DNA Marker,蛋白质分子量标准(低),DNA凝胶回收试剂盒(TaKaRa Agarose Gel DNA Purification Kit 2.0)等为 TaKaRa公司产品。
1.1.3 培养基
枯草芽孢杆菌和大肠杆菌所用的培养基均为LB培养基。在需要的时候分别加入100 μg/mL的氨苄和10 μg/mL的氯霉素,10 μg/mL的氯霉素用于重组枯草杆菌的筛选。
1.2 方法
1.2.1 质粒DNA的快速提取
按照参考文献[7]进行。
1.2.2 感受态细胞的制备和转化
按照参考文献[8-9]进行。
1.2.3 表达载体的构建设计
设计一对引物P1(5’-CGCGGATCCGAAACTGCAAACAAATC -3’)和 P2(5’-TCCCCCGGGTTAATGCGGAAGAT-3’),引物P1和P2中分别引入酶切位点BamHⅠ和SmaⅠ,见下划线。引物由上海英骏生物技术有限公司合成。以实验室保存的pET21a-amy质粒为模板扩增出去信号肽的amy基因。PCR扩增出来的片段纯化回收之后进行双酶切,与同样进行双酶切的pHT43在4℃进行酶连。构建出重组表达载体pHT43-amy。重组载体转入大肠杆菌JM109感受态细胞,在含有100 μg/mL的AMP的平板上进行筛选。从JM109转化子中提取质粒进行重组质粒的鉴定。
1.2.4 表达菌株pHT43-amy/WB600的构建
将重组质粒pHT43-amy转化枯草芽孢杆菌WB600感受态细胞中,在10 μg/mL的氯霉素的LB平板上筛选转化子。将这些转化子挑到加有氯霉素的液体LB培养基中,37℃,220 r/min过夜培养,然后37℃,200 r/min诱导,测酸性α-淀粉酶活力,并进行SDS-PAGE检测外源蛋白。
1.2.5 酸性α-淀粉酶表达条件的优化
将阳性转化子培养14 h,之后加入1 mmol/L IPTG 进行分时段诱导(0、1、2、3、4、5、6、7、8 h),通过酸性α-淀粉酶活力测定和外源蛋白表达量确定最佳诱导时刻。采用同样的分析方法优化IPTG的使用浓度和诱导时的最佳菌体浓度。
将100 mL的发酵液在5 000 g×5 min条件下离心,上清酶液保存,菌体沉淀用pH 5.0的柠檬酸-磷酸缓冲液洗涤2次,之后加入5 mL柠檬酸-磷酸缓冲液,采用200 W、10 min(工作10 s、间歇30 s、60 次)超声波破碎菌体,离心之后取上清,并定容至100 mL。
1.2.7 酸性α-淀粉酶活力测定
取10 mL的底物溶液放入1个试管,55℃水浴保温10 min后加入粗酶液1 mL,混匀,精确保温10 min,吸取0.5 mL混合液,加入盛有10 mL 0.1 mol/L的HCl的试管中,然后再取该混合液0.5 mL,加入盛有10 mL的碘液试管中摇匀,用分光光度计于660 nm下测定吸光值。对照管用同样的方法测得,只是将粗酶液事先于沸水中10 min后再加入,以蒸馏水作为比色的参比。
酶活力单位:在上述条件下,反应10 min使1%淀粉溶液显蓝强度减低1%所需酶量为1个酶活力单位(U)[10]。
2 结果与分析
2.1 表达载体pHT43-amy的构建
将PCR扩增出来的带有BamHⅠ和SmaⅠ酶切位点的去信号肽的amy基因进行双酶切,与同样经双酶切的pHT43质粒在4℃进行酶连,转化大肠杆菌JM109后,提取质粒,经PCR验证(如图1a)、双酶切验证(如图1b),证明amy基因已经重组至pHT43载体上,将该重组质粒记作pHT43-amy。
吸附等温线:准确称取已预处理树脂5.0 g于锥形瓶中,加入不同浓度的花色苷溶液各50 mL,置于振荡器30 ℃、100 r/min上下振荡3 h,待吸附平衡后测定溶液的平衡质量浓度,并计算吸附量,以吸附量对浓度作图,绘制吸附等温曲线。
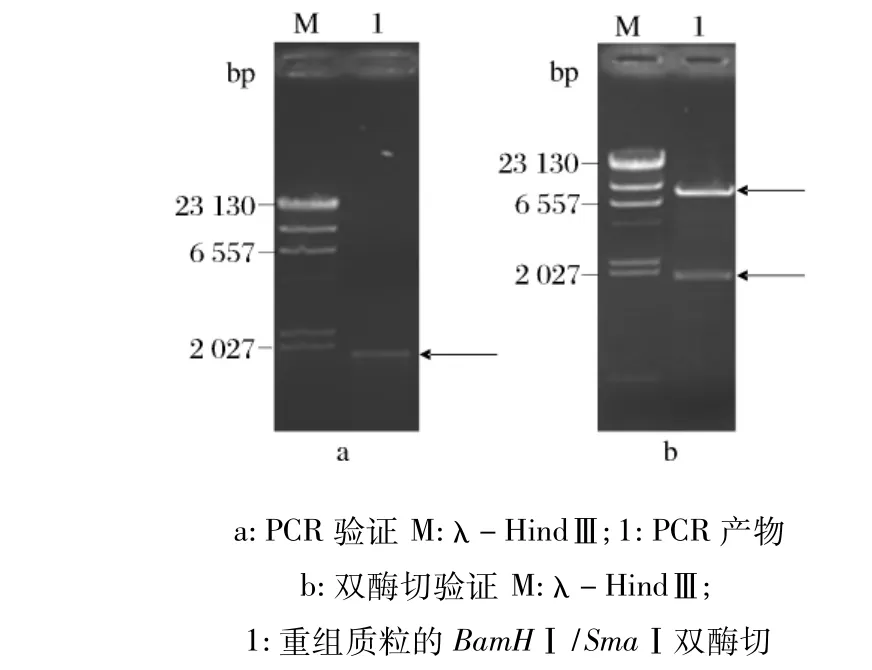
图1 重组质粒的PCR验证及双酶切验证
2.2 枯草杆菌重组菌株的构建
在实验中我们选取枯草芽孢杆菌WB600为受体菌,它是6种蛋白酶基因缺陷型菌株,能将重组蛋白分泌到胞外,便于分离提纯,没有密码子偏爱性[11]。将重组质粒pHT43-amy转入感受态细胞WB600中,挑取其中10个阳性转化子进行酸性α-淀粉酶活力检测,结果显示其中1个转化子是假阳性,而其它9个转化子具有相同的酸性α-淀粉酶活力水平,约为1 200 U/mL。选取4号转化子作为后续试验的研究材料。对4号菌株进行SDS-PAGE检测,如图2所示,可知在约66 ku处出现预期大小的酸性α-淀粉酶基因的表达蛋白,通过Quantity One软件分析可知,该外源蛋白可占重组枯草杆菌胞外蛋白的80% 以上。

图2 重组菌株pHT43-amy/WB600粗酶液的SDS-PAGE
2.3 重组枯草杆菌酸性α-淀粉酶表达条件的优化
2.3.1 诱导时间对酸性α-淀粉酶表达量的影响
将重组枯草杆菌培养至OD600为1.0时,加入终浓度为1 mmo/L的IPTG进行诱导,经不同诱导时间的培养后,取出培养液,离心获得粗酶液进行酸性α-淀粉酶活力测定(图3)和SDS-PAGE检测(图4)。可以看出,在诱导6 h时酸性α-淀粉酶活力已达最高,继续诱导至8 h,酶活力没有增加,SDS-PAGE也显示在诱导6~8 h之间外源蛋白表达量没有明显差异,因此后续试验采用6 h的诱导时间。
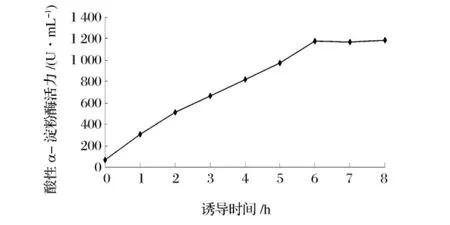
图3 诱导时间对重组菌株酸性α-淀粉酶活力的影响
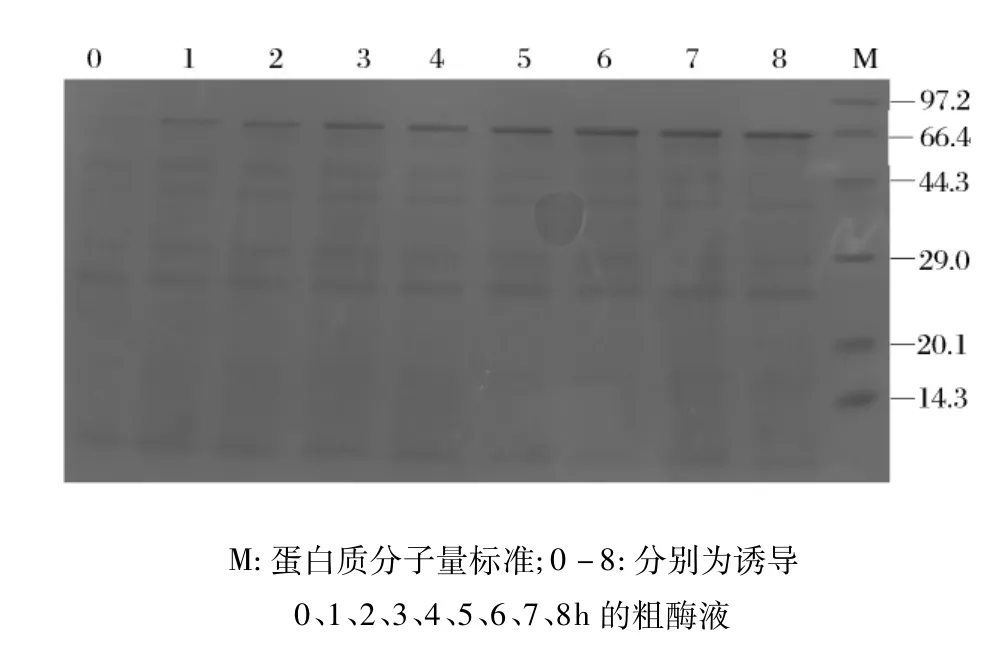
图4 不同诱导时间对酸性α-淀粉酶表达量的影响
2.3.2 诱导的起始菌浓度对酸性α-淀粉酶表达的影响
分别在菌体浓度 OD600为 0.6、0.8、1.0、1.2、1.4时加入1 mmol/L的IPTG诱导6 h后,比较其酸性α-淀粉酶活力,结果如图5所示。可知在OD600为0.8时诱导产生的酸性α-淀粉酶活力最高,进行 SDSPAGE检测(如图6),通过Quantity One软件分析可知OD600为0.8时的外源蛋白表达量最大,因此认为该重组菌在OD600为0.8时开始诱导最佳。
2.3.3 IPTG浓度对酸性α-淀粉酶表达的影响
将重组枯草杆菌培养至 OD600为0.8,分别加入0.5~1.6 mmol/L(间隔0.1 mmol/L)不同浓度的IPTG,培养6 h后,检测不同IPTG浓度对酸性α-淀粉酶活力和表达量的差异,结果如图7、图8所示。尽管酸性α-淀粉酶活力测定显示IPTG浓度为0.9 mmol/L时活力最高,但SDS-PAGE显示不同浓度IPTG诱导下外源蛋白表达量差异并不明显,说明IPTG浓度对酸性α-淀粉酶的表达没有显著影响,出于经济投入节省成本考虑,后续试验可选择0.5 mmol/L的IPTG浓度进行该酸性α-淀粉酶的诱导表达。
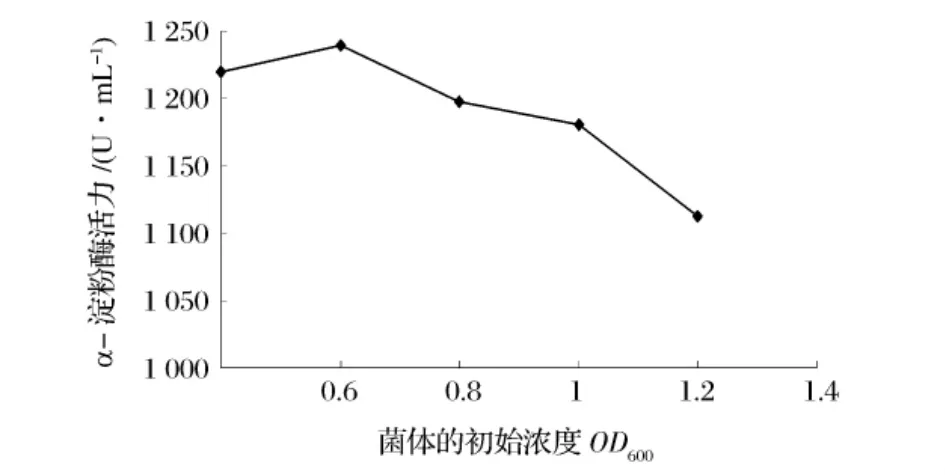
图5 不同菌体浓度诱导时酸性α-淀粉酶活力的变化

图6 不同菌体浓度诱导对酸性α-淀粉酶表达量的影响

图7 不同IPTG浓度对酸性α-淀粉酶活力的影响
2.4 外源酸性α-淀粉酶的分泌情况
为了探究酸性α-淀粉酶在重组枯草杆菌中的分泌情况,用250 mL的三角瓶诱导培养了100 mL菌液,先离心获得胞外酶组分,又将菌体沉淀用pH 5.0的柠檬酸-磷酸缓冲液洗涤2次之后,加入5 mL缓冲液进行超声波破碎,取上清定容至100 mL,此为胞内酶组分。分别测定以上2组分的酸性α-淀粉酶活力,结果如表1所示。可知重组枯草杆菌所表达的酸性α-淀粉酶有98%以上都分泌到了胞外。

图8 不同IPTG浓度对酸性α-淀粉酶表达量的影响

表1 酸性α-淀粉酶的分泌情况
3 结论与讨论
本研究成功地将解淀粉芽孢杆菌酸性α-淀粉酶基因amy在枯草芽孢杆菌WB600中表达,通过对重组菌株表达条件的优化,当菌体浓度OD600达到0.8时,用0.9 mmol/L IPTG诱导6 h,酸性α-淀粉酶酶活力高达1 230 U/mL,是原始菌株α-淀粉酶酶活力360 U/mL的3倍,显示出更大的工业应用潜力。
本实验得到的重组枯草芽孢杆菌表达的酸性α-淀粉酶98%以上都分泌到了胞外;同时,从胞外总蛋白的表达情况来看,杂蛋白较少,外源α-淀粉酶量可占胞外总蛋白量的80%以上,从而使目的蛋白易于被纯化。试验还发现该重组菌粗酶液可在4℃下存放3个月而酶活力没有下降,证明该酶液组分不易被降解,具有良好的稳定性,这些特性都极有利于酸性α-淀粉酶的工业化生产。
[1] Liu G,Xing M,Yu S W.High-effective expression of thermostableα-amylase from a bacterial phage based recombinant Bacillus subtilis[J].Chin J Appl Environ Biol,2005,11(3):368 -372.
[2] Zhang X Z,Yan X,Cui Z L,et al.Recombinant expression and secretion of mpd gene using the promoters of ytkA and ywoF gene from Bacillus subtilis[J].Chin J Biotechnol,2006,22(2):249 -256.
[3] 郭菁,田宝玉,蔡婉玲,等.侧孢短芽孢杆菌碱性蛋白酶基因BLG4在枯草芽孢杆菌WB600中的高效表达[J].福建农林大学学报:自然科学版,2011,40(2):165-171.
[4] 胡杨,周海燕,董蕾,等.甘露聚糖酶基因Man23在芽孢杆菌WB600中的表达[J].湖南农业大学学报:自然科学版,2007,33(5):539 -541.
[5] 董晨,曹娟,张迹,等.耐高温α-淀粉酶基因在枯草芽孢杆菌中的高效表达[J].应用与环境生物学报,2008,14(4):534-538.
[6] 安弋.酸性α淀粉酶基因的克隆与表达[D].郑州:河南农业大学,2010.
[7] 洪青,张忠辉,张晓舟,等.中度嗜盐菌Halomonas SP.BYS-1启动子的克隆和测序[J].应用与环境生物学报,2005,(6):729 -732.
[8] Sambronk J,Fritsch E F,Maniatis T.Molecular cloning:a laboratory manual[M].2nd ed.New York:Cold Spring Harbor Laboratory Press,2002:568 -595 .
[9] Anagnostopoulus C,Spizizen J.Requirements for transformation in Bacillus subtis[J].J Bacteriot,1961,84:741 -746.
[10] 谢慧玲,阮森林,刘亮伟,等.酸性生淀粉酶产生菌的筛选及酶学性质研究[J].食品工业科技,2008,10(29):85-87.
[11] Liu Yi-han,Lu Fu-ping,Li Yu,et al .Characterisation of mutagenised acid-resistant alpha-amylase expressed in Bacillus subtilis WB600 [J].Appl Microbiol Biotechnol,2008,78:85 -94.
High-level Expression of Acid-stable α-amylase Gene of Bacillus amyloliquefaciens in Bacillus subtilis WB600
Wang Cai-lan,Liu Yu-xin,Li Xue-qin,Liu Liang-wei,Chen Hong-ge
(Key Laboratory of Enzyme Engineering of Agricultural Microbiology,Ministry of Agriculture,Henan Agricultural University,Zhengzhou 450002,China)
Acid-stable α-amylase is widely used in fermentation industry.In order to highly express acid-stable α-amylase gene,a recombinant vector containing no signal peptide of acid-stable α-amylase gene from Bacillus amyloliquefaciens was constructed followed by transformation into Bacillus subtilis WB600host.The highest activity of recombinant acid-stable α-amylase was 1230 U/mL under the condition as follows:OD600 of the initial bacteria was 0.8 and final concentration of IPTG was 0.9 mmol/L,and the cell suspension was cultured for 6 hours after addition of IPTG.As the recombinant Bacillus subtilis WB600 secreted few other proteins except the targeted acid-stableα-amylase,it showed obvious advantages in amylase production.
acid-stable α-amylase gene,high level expression,Bacillus subtilis
硕士研究生(陈红歌教授为通讯作者)
*河南省教育厅自然科学研究计划(2010A180006)
2011-12-13,改回日期:2012-03-31

