活性污泥中1株产PHB丝状细菌的分离与鉴定*
马忠友,汪建飞,祝嫦巍,吴萍
1(安徽科技学院,生命科学学院,安徽 凤阳,233100)
2(安徽科技学院,城建与环境学院,安徽 凤阳,233100)
活性污泥中1株产PHB丝状细菌的分离与鉴定*
马忠友1,汪建飞2,祝嫦巍1,吴萍1
1(安徽科技学院,生命科学学院,安徽 凤阳,233100)
2(安徽科技学院,城建与环境学院,安徽 凤阳,233100)
从污水处理厂等活性污泥样品中分离到了19株丝状细菌,通过苏丹黑染色法和紫外吸收光谱扫描技术证明这些丝状细菌能够在菌体内积累聚β-羟基丁酸(PHB)。采用氯仿乙醇法提取PHB,并采用紫外吸收法进行定量测定,筛选出1株高产PHB丝状细菌HY10,细胞PHB含量为(37.24±0.74)%,PHB产量为1.15±0.06 g/L。综合该菌株的菌落形态和16S rDNA序列(GenBank No.JQ353768)分析结果将HY10菌株鉴定为假蕈状芽孢杆菌(Bacillus pseudomycoides)。
聚β-羟基丁酸,丝状细菌,假蕈状芽孢杆菌
随着塑料制品的广泛使用,废弃的化学塑料由于不能被微生物分解,带来了严重的“白色污染”。聚β-羟基丁酸(PHB)是细菌细胞内积累的一种能被微生物酶所降解的高分子聚合物。PHB的性质与目前普遍使用的合成塑料有许多相似之处,例如可压塑、成膜和拉丝等,此外,它还具有生物可降解性和生物相容性等优点,在医学尤其在组织工程上,具有重要的作用。因此,PHB作为一种新型的塑料替代品以及生物医学材料,已经成为人们的研究热点[1]。Lemoigne于1926年首先在巨大芽孢杆菌(Baillus megatheriucm)细胞中发现PHB,能产生PHB的微生物分布极广,包括光能和化能自养及异养菌,共65个属中的近300种微生物。目前研究得较多用于合成PHB的微生物有:产碱杆菌属(Alcaligenes),假单胞菌属(Pseudonomas),甲基营养菌(Methylotrophs),固氮菌属(Azotobacter)和红螺菌属(Rhodospirillum)等,它们能分别利用不同的碳源合成不同的PHAs。其中以真养产碱杆菌的研究最多,也最成熟,已经能够小规模工业化生产 PHB 和 PHBV[1-2]。
丝状细菌主要分布在水生环境、潮湿土壤和活性污泥中,该类细菌能在胞内积累含量较高的PHB颗粒,而且它们对污水中的有机物和有毒物质有很强的降解能力,在污水处理过程中发挥着重要的作用[3]。如果能以工厂污水为原料,利用丝状细菌来生产PHB,一方面将有可能大大降低PHB的生产成本,另一方面又使污泥得到了合理利用。本研究采用低营养培养基,通过富集培养和紫外吸收光谱测定技术,从活性污泥中分离、筛选到了1株高产PHB丝状细菌,并通过16S rDNA测序技术对该菌株进行了分类鉴定。
1 材料与方法
1.1 实验材料
1.1.1 样品来源
蚌埠市第一污水处理厂活性污泥、安徽科技学院校内排水沟污泥、凤阳城区居民排水沟污泥和面粉厂排污处污泥。
1.1.2 实验药品
聚 β-羟基丁酸标准品(美国,Sigma-aldrich),其他实验药品均为国产分析纯。
1.2 实验方法
1.2.1 培养基
尿素富集培养基(g/L):尿素0.5,葡萄糖1.0,MgSO4·7H2O 0.05,K2HPO40.1,自来水定容至1L,pH 7.0~7.2,115℃灭菌30 min。
Stoke分离纯化培养基(g/L):葡萄糖1.0,蛋白胨1.0,MgSO4·7H2O 0.2,CaCl20.05,FeCl30.01,自来水定容至1L,pH 7.0~7.2,琼脂20,115℃灭菌30 min[3]。
产PHB基础发酵培养基(g/L):葡萄糖10,蛋白胨 3,MgSO4·7H2O 0.2,CaCl20.05,FeCl30.01,K2HPO40.04,KH2PO40.03,NaH2PO4·2H2O 0.05,H3BO30.005,蒸馏水定容至1L,pH 7.0,分装至250mL三角瓶中,每瓶50mL,115℃灭菌30 min。
1.2.2 显微染色观察
按常规制成涂片,以0.3%苏丹黑 B染色10 min,水冲去染剂,用滤纸吸将水吸干,再用二甲苯冲洗至无色素,然后用0.5%番红复染1 min,水洗,吸干,镜检。PHB颗粒染成黑绿色,菌体其他部分呈红色[4]。
1.2.3 产PHB丝状细菌的分离、纯化
取活性污泥5 g接种于100 mL已灭菌的富集培养液(尿素培养基)中,30℃摇床培养1天,再静止培养1天。待长出漂浮于液体中的半透明絮状物时,挑取絮状物,经苏丹黑染色显微镜镜检有PHB颗粒后,再挑取絮状物移入新鲜富集培养基中继续培养。
挑取少量经过多次富集后得到的絮状物,在Stoke平板上划线分离,30℃培养2天,见有丝状体伸展时,挑取絮状物,经苏丹黑染色显微镜镜检有PHB颗粒后,及时用接种针挑取菌体在Stoke平板上划线。经过3~4次的重复划线后,既可得纯菌落。
1.2.4 PHB的紫外吸收光谱扫描定性分析
准确称取0.01 g干菌体,放入干净的带刻度的试管中,加入20 mL V(三氯甲烷)∶V(乙醇)=2∶1,溶液,于60℃的水浴锅内水浴抽提1 h,接着过滤,取滤液0.2 mL加入另一批干净的试管中,放入干燥箱内蒸发掉氯仿和乙醇,然后加入10 mL浓H2SO4,100℃中水浴10 min,冷却并混匀,在200~800 nm范围内进行扫描检测[3]。
1.2.5 PHB定量标准曲线的制备
PHB在浓H2SO4中加热时可以定量地转化为巴豆酸(反-2-丁烯酸)。根据巴豆酸在235 nm处有一最大吸收峰值,而其它含碳化合物在同样条件下的吸收峰与PHB有很大的差别,建立适用于PHB含量测定的PHB标准曲线。
用电子天平准确称取0.01 g PHB标准品,加入20 mL三氯甲烷,混匀,于60℃水浴30 min,使其充分溶解,PHB浓度为500 μg/mL。从中吸取2 mL,加入198 mL氯仿,混匀溶解,PHB 浓度为5μg/mL,再从该溶液中分别吸取 1,2,3,4,5,6,7 mL 加入 7 支干燥的带塞带刻度的干净试管中(每个浓度各3支),使其中 PHB 的质量分别为 5,10,15,20,25,30,35 μg。加热除去三氯甲烷,加入10 mL浓H2SO4,试管口用玻璃片盖住,在100℃水浴中加热10 min,冷却,并充分混匀。然后用浓H2SO4作空白对照,在紫外可见分光光度计的235 nm处测OD值。以PHB浓度为横坐标,OD值为纵坐标作图,即可得到PHB浓度标准曲线[5],如图1 所示。

图1 PHB的标准曲线
1.2.6 产PHB丝状细菌的筛选
将获得的产PHB丝状细菌接种于液体基础发酵培养基中,每株设置3个重复。30℃进行摇瓶培养2天,8000 r/min离心发酵液,弃去上清液,洗涤沉淀物,得湿菌体于60~70℃下烘干。称细胞干重,测PHB的含量,计算各菌株PHB的产量,筛选出高产PHB的菌株。
1.2.7 PHB含量的测定
采用氯仿乙醇法提取菌体胞内的PHB,经浓硫酸处理后,用紫外可见分光光度计在235 nm处测OD值,并通过PHB定量标准曲线计算其含量及产量[3]。
1.2.8 产PHB细菌的分类鉴定
菌株16S rDNA区域的扩增采用菌液PCR法,扩增引物采用27F(5'– AGAGTTTGATCCTGGCTCAG–3')和 1492R(5'– GGTTACCTTGTTACGACTT –3')。
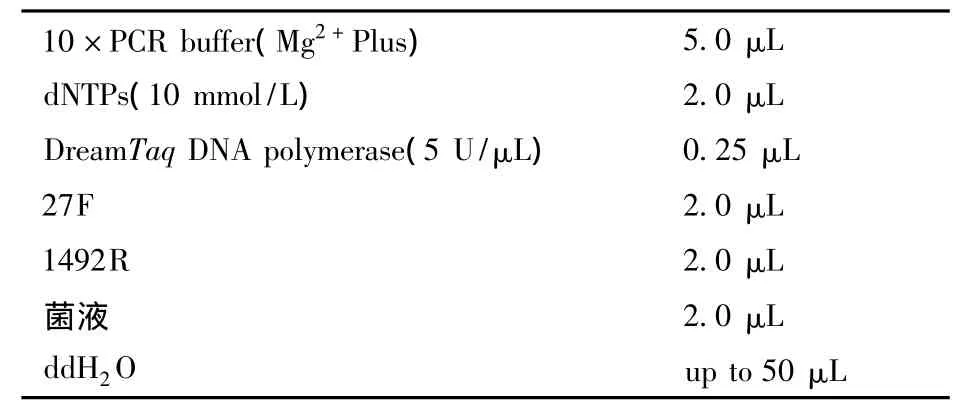
表1 PCR扩增体系
扩增反应在美国Bio-Rad公司生产的PCR仪上进行。
扩增程序:94℃变性5 min,(94℃变性1min,52℃退火1 min,72℃延伸1min)×30,72℃延伸 10 min,4℃保温。取5 μL PCR产物,用1%琼脂糖凝胶电泳检测扩增结果。PCR扩增产物被送到上海Invitrogen生物技术有限公司进行测序。
1.2.9 系统树的构建
为研究供试菌株与已知细菌的亲缘关系及其系统地位,在GenBank上下载相关近缘种细菌菌株的16S rDNA区域序列与供试菌株的序列放在一起,用BioEdit软件进行匹配排列,使用MEGA4.1软件,并采用Neighbor-Joining方法构建分支系统树和Bootstrap analysis方法进行1000次重复抽样分析。
2 结果与分析
2.1 产PHB丝状细菌的分离
从不同地点采集到的污泥样品,经过三角瓶富集培养,结合平板划线和苏丹黑染色显微镜检法,成功分离到了19株产PHB丝状细菌。结果表明,蚌埠市第一污水处理厂活性污泥、本校排水沟污泥、凤阳城区居民排水沟污泥、凤阳郊区面粉厂排污处污泥均分离到了丝状细菌。不同地点的污泥样品中所含产PHB丝状细菌的数量不同,其中以蚌埠市第一污水处理厂活性污泥最多,共分离到10株。丝状细菌HY10菌株的菌落和胞内积累的PHB颗粒如图2所示。
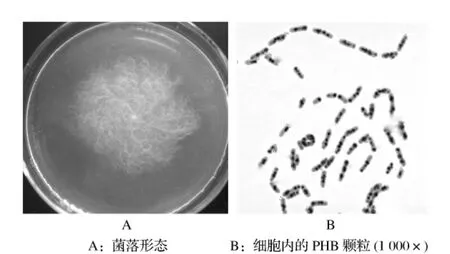
图2 丝状细菌HY10
2.2 PHB的紫外光谱扫描定性分析
采用氯仿乙醇法提取菌体胞内物质,将所获得的白色粉末或薄膜状样品经浓硫酸处理后,在200~800 nm利用岛津UV-2550紫外分光光度计进行扫描检测,并以浓H2SO4做空白对照。实验结果表明,浓H2SO4处理产物在235 nm处有一最大吸收峰值(图3),这与PHB标准品在热浓硫酸中的转化产物——巴豆酸(反-2-丁烯酸)的最大吸收值一致。

图3 PHB的紫外扫描光谱图
2.3 产PHB丝状细菌的筛选
将分离纯化得到的19株产PHB丝状细菌接入基础发酵培养基中,30℃摇床培养2天,实验结果见表1。经比较,编号为HY10的菌株细胞干重为3.08±0.12 g/L,PHB含量为(37.24±0.74)%,PHB产量为1.15±0.06 g/L,PHB的含量和浓度均为最高,而细胞干重也较高,故选择HY10菌株作为进一步研究的菌株。
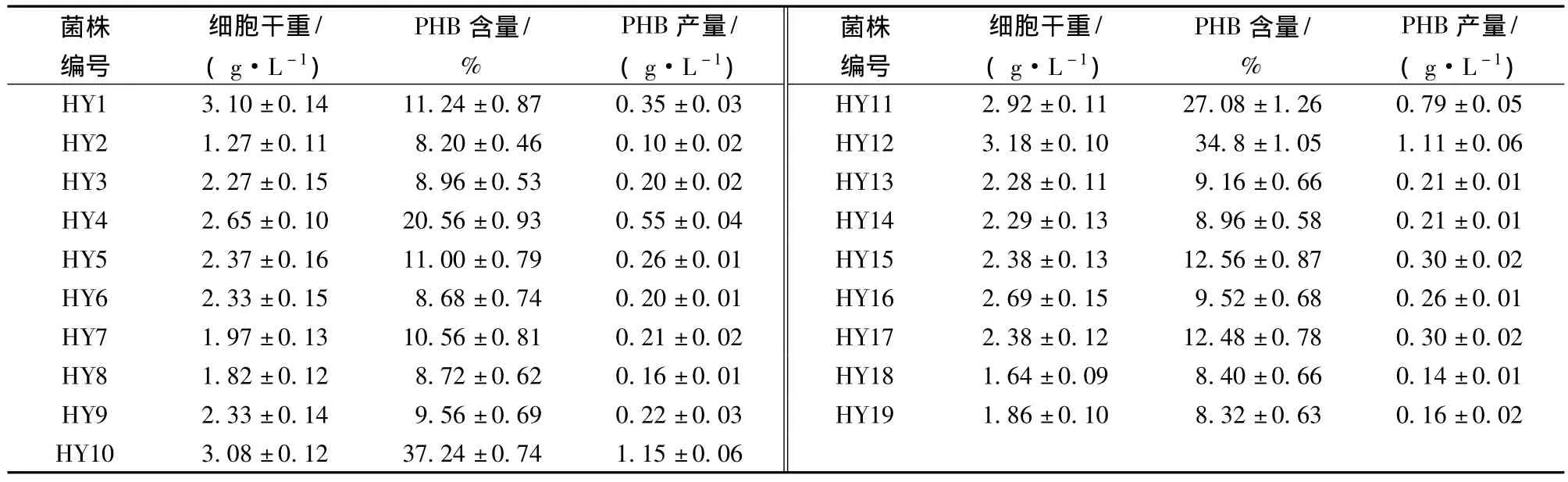
表1 不同丝状细菌PHB产量的比较
2.4 产PHB丝状细菌的分类鉴定
采用菌液PCR法扩增HY10菌株的16S rDNA序列,取5 μL PCR产物,用1%琼脂糖凝胶电泳检测扩增结果,如图4所示,长度约1500 bp。

图4 HY10菌株16S rDNA序列PCR产物的电泳图谱
根据HY10菌株的16S rDNA序列(GenBank No.JQ353768)在GenBank数据库中进行同源序列搜索(BLAST search),结果显示HY10菌株和假蕈状芽孢杆菌Bacillus pseudomycoides NBRC 101232(Gen-Bank No.AB681414)、B.pseudomycoides DSM 12442(GenBank No.AM747226)的16S rDNA区序列完全相同,相似性为100%。从GenBank数据库中下载相关菌株蜡状芽孢杆菌B.cereus IAM 12605T(GenBank No.D16266)、巨大芽孢杆菌 B.megaterium IAM 13418T(GenBank No.D16273)、蕈状芽孢杆菌 B.mycoides DSM 2048T(GenBank No.X55061)、B.mycoides DSM 2048T(GenBank No.AB592538)、枯草芽孢 杆 菌 B.subtilis NCDO 1769T(GenBank No.X60646)、假蕈状芽孢杆菌 B.pseudomycoides NBRC 101232(GenBank No.AB681414)、B.pseudomycoides DSM 12442(GenBank No.AM747226)、B.pseudomycoides GTC 02831(GenBank No.AB592542)、B.pseudomycoides NRRL B-617T(GenBank No.AF013121)和大肠杆菌Escherichia coli ATCC 11775T(GenBank No.X80725)的16S rDNA序列构建系统发育树(图5),HY10菌株和假蕈状芽孢杆菌 B.pseudomycoides聚在一组,概率99%。因此综合HY10菌株的形态特征(图1)和16S rDNA序列,把该菌株鉴定为假蕈状芽孢杆菌Bacillus pseudomycoides Nakamura[6]。
3 讨论
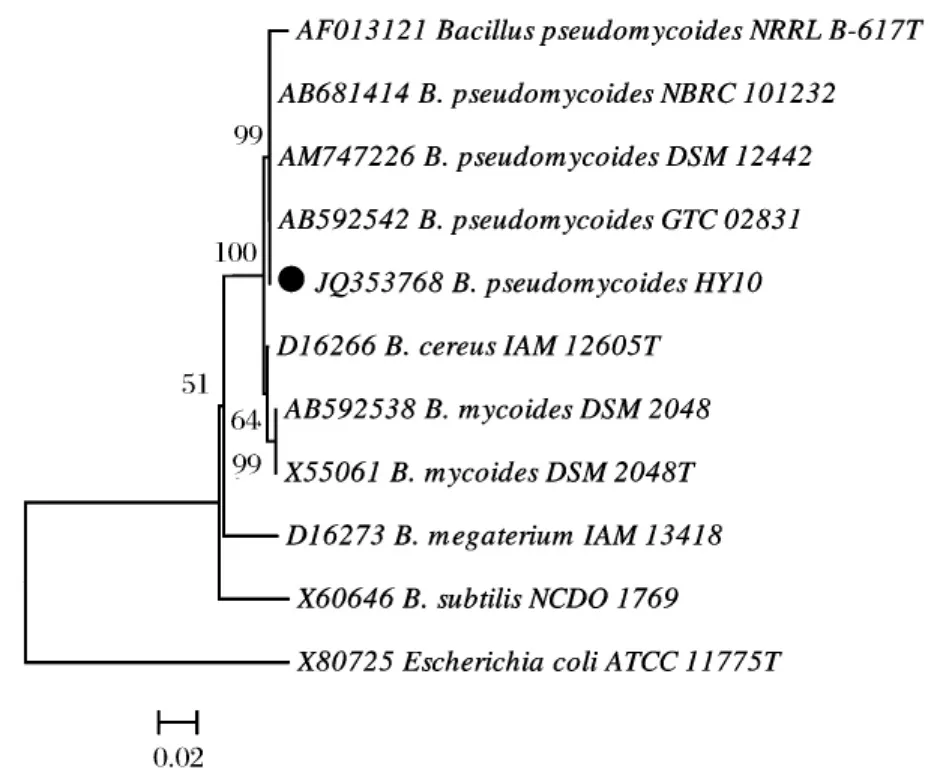
图5 芽孢杆菌属部分菌株的16S rDNA序列分支系统树
丝状细菌的比表面积大,有利于摄取低浓度底物,在底物浓度相对较低的条件下比其他细菌增殖速度快。根据这个特点,很多丝状细菌被从样品中分离出来,如浮游球衣菌 Sphaerotilus natans[7,8]和蕈状芽孢杆菌B.mycoides[9]等。本研究从不同来源的活性污泥中分离到了19株产PHB丝状细菌,由于所在的环境条件不同,其积累PHB的能力也不同。从污水处理厂活性污泥分离到的假蕈状芽孢杆菌B.pseudomycoides HY10菌株的生长能力和PHB产量最高,这可能与污水处理厂常年处理不稳定的不同性质的污水有关,因为PHB在环境压力和营养不平衡的条件下更容易被微生物合成[10]。
通过核磁共振波谱技术研究显示,生物可降解塑料聚羟基脂肪酸酯有聚β-羟基丁酸(简称PHB)、聚β-羟基戊酸(简称 PHV)和聚 β-羟基己酸(简称PHH)等多种类型[4,11-15],此外,在一定条件下2种或2种以上的单体还能形成共聚物,其典型代表是3HB和3HV组成的共聚物P(3HB-co-3HV),又写成PHBV[10,16]。在培养基中加入不同的单体(例如:3-羟基戊酸盐,3-羟基丁酸盐,3-羟基己酸盐等),进行多样性的组合,改变其性能,可以产生巨大的高分子生物聚合物。从图3中可以看出除了在235 nm处有一最大吸收峰,PHB标准品在303 nm处有一较弱的吸收峰,而假蕈状芽孢杆菌HY10胞内PHB在319 nm处有一较弱的吸收峰,说明假蕈状芽孢杆菌HY10胞内PHB的单体和3-羟基丁酸有差异,可能具有新的基团,有待于利用红外光谱和核磁共振技术进一步研究。
[1]Khanna S,Srivastava A K.Recent advances in microbialpolyhydroxyalkanoates[J].Process Biochemistry,2005,40(2):607-619.
[3]陈接锋,许旭萍,余晨兴,等.合成聚 β-羟基丁酸(PHB)鞘细菌的分离、鉴定与筛选[J].工业微生物,2003,33(4):23-26,31.
[4]Legat A,Gruber C,Zangger K,et al.Identification of polyhydroxyalkanoates in Halococcus and other haloarchaeal species[J].Applied Microbiology and Biotechnology,2010,87(3):1119-1127.
[5]Law J H,Slepecky R A.Assay of poly-β-hydroxybutyric acid[J].Journal of Bacteriology,1961,82:33-36.
[6]Nakamura L K.Bacillus pseudomycoides sp.nov[J].International Journal of Systematic Bacteriology,1998,48(3):1031-1035.
[7]许旭萍,陈接锋,李惠珍.Sphaerotilus natans FQ40合成聚β-羟基丁酸(PHB)条件的研究[J].食品与发酵工业,2004,30(9):23-26.
[8]张立新,王锦平,郭秀君,等.从球衣细菌中分离提取PHB的研究[J].微生物学杂志,1993,13(1):30-33.
[9]Borah B,Thakur P S,Nigam J N.The influence of nutritional and environmental conditions on the accumulation of poly-β-hydroxybutyrate in Bacillus mycoides RLJ B-017[J].Journal of Applied Microbiology,2002,92(4):776-783.
[10]López-Cortés A,Lanz-Landázuri A,García-Maldonado,J.Screening and isolation of PHB-producing bacteria in a polluted marine microbial mat[J].Microbial Ecology,2008,56(1):112-120.
[11]Thirumala M,Reddy S,Mahmood S.Production and characterization of PHB from two novel strains of Bacillus spp.isolated from soil and activated sludge[J].Journal of Industrial Microbiology and Biotechnology,2010,37(3):271-278.
[12]Reddy S V,Thirumala M,Mahmood S K.A novel Bacillussp.accumulating poly(3-hydroxybutyrate-co-3-hydroxyvalerate)from a single carbon substrate[J].Journal of Industrial Microbiology and Biotechnology,2009,36(6):837-843.
[13]Tajima K,Igari T,Nishimura D,et al.Isolation and characterization of Bacillus sp.INT005 accumulating polyhydroxyalkanoate(PHA)from gas field soil[J].Journal of Bioscience and Bioengineering,2003,95(1):77-81.
[14]Kung S S,Chuang Y C,Chen C H,et al.Isolation of polyhydroxyalkanoates-producing bacteria using a combination of phenotypic and genotypic approach[J].Letters in Applied Microbiology,2007,44(4):364-371.
[15]陈宏,方东升,陈秉良.聚-β-羟基丁酸产生菌NS-82#的研究[J].微生物学通报,2001,28(4):27-31.
[16]Reddy S V,Thirumala M,Reddy T K,et al.Isolation of bacteria producing polyhydroxyalkanoates(PHA)from municipal sewage sludge[J].World Journal of Microbiology and Biotechnology,2008,24(12):2949-2955.
ABSTRACT19 strains of filamentous bacteria that accumulated poly-β-hydroxybutyrate(PHB)were isolated from activated sludge by enrichment cultivation.Staining with Sudan Black B was applied to detect PHAs.Quantitative estimation of PHB extracted from the isolates was done by Ultraviolet spectrophotometer method.PHB was extracted from these strains through the CHCl3-CH3CH2OH method.The PHA productivities of strain HY10 was the highest in 19 isolates mentioned above,in which PHB yield and productivities were(37.24 ±0.74)%dry cell weight(DCW)and 1.15±0.06 g/L,respectively when grown in a medium containing 20 g/L sucrose.According to its clone morphological and the 16S rDNA sequence(GenBank No.JQ353768),it suggested that strain HY10 was Bacillus pseudomycoides.
Key wordspoly-β-hydroxybutyrate,filamentous bacteria,Bacillus pseudomycoides
Isolation and Characterization of Filamentous Bacteria HY10 Accumulating Poly-β-hydroxybutyrate(PHB)from Activated Sludge
Ma Zhang-you1,Wang Jian-fei2,Zhu Chang-wei1,Wu Ping1
1(College of life Science,Anhui Science and Technology University,Fengyang 233100,China)
2(College of Urban Construction & Enviroment Science,Anhui Science and Technology University,Fengyang 233100,China)
博士,讲师(汪建飞教授为通讯作者)。
*国家自然科学基金(31100070);安徽科技学院稳定人才基金(2RC2011299);安徽科技学院生物学重点建设学科(AKXK20102-1);安徽农业科技成果转化基金(10140306017)
2012-01-07,改回日期:2012-02-02

