微波消融联合过继免疫治疗肝癌的临床研究
周 佩,梁 萍,董宝玮,于晓玲,于 杰,徐迎新
(1.广州军区武汉总医院超声影像科,武汉 430070;2.解放军总医院介入超声科,北京 100853;3.解放军总医院普外研究所,北京 100853)
慢性乙肝合并肝癌患者存在多种免疫细胞功能缺陷[1],多环节多途径干预的免疫治疗有利于提高患者总体免疫状态、改善免疫缺陷。体外制备荷载肿瘤抗原的树突状细胞[2]和肿瘤抗原特异性和非特异性效应细胞过继免疫治疗肝癌[3-4]取得一定临床疗效。局部热消融治疗小肝癌的远期疗效与手术切除相当,已被公认为是继手术和肝移植之后的根治性治疗方法之一[5]。微波消融后,机体肿瘤负荷减轻、肿瘤对免疫系统的抑制大大解除,同时死亡和凋亡的肿瘤细胞使肿瘤抗原得以释放和暴露[6],因而也是激发机体特异性抗肿瘤免疫的最佳时机。
本研究观察微波消融联合过继细胞免疫治疗乙肝后肝硬化并原发性肝癌患者的临床安全性,以及对外周血淋巴亚群比例的影响。
1 资料与方法
1.1 一般资料
本研究经解放军总医院伦理委员会批准,所有患者均签署知情同意书。10例原发性肝癌患者接受微波消融联合树突状细胞疫苗及效应细胞过继免疫,纳入联合组。患者入组标准为:(1)肝内病灶为单发结节,最大径≤5 cm,或小于3个结节,最大径≤3 cm;(2)无血管、胆管癌栓或肝外转移;(3)肝功能Child分级A或B级;(4)有进针路径,可行超声引导下活检及微波消融治疗;(5)慢性乙型肝炎后肝硬化基础病变;(6)肝癌病程≤3年。实验室标准为:血红蛋白>100 g/L,白细胞计数>2×109/L,血小板计数 >75×109/L,血清肌酐<110 μmol/L,天冬氨酸转氨酶<3倍正常上限,血清胆红素<2.5倍正常上限,凝血酶原时间<19 s,HCV和HIV阴性。排除标准包括:妊娠和哺乳期妇女,吸毒,精神异常,未控制的感染,全身皮质激素治疗,自身免疫性疾病,缺血性心脏病或心力衰竭,近6个月内进行过化疗或放疗的患者。
同期符合相同纳入和排出标准的24位经皮微波治疗的患者纳入微波组,联合组与微波组间性别、年龄、病程分布、肝功能Child分级、病灶数目、肿瘤最大径均无统计学差异(表1)。
1.2 微波消融方法
所有消融治疗均在超声引导下和静脉麻醉下完成,所用麻醉剂为异丙酚和氯胺酮。微波设备为中国南京康友微波能应用研究所研制的KY-2000(2 450 MHz)及KY-2100(915 MHz)微波消融仪,配用微波天线为15 G硬质裂隙水冷天线,最大输出功率为100 W;随机配备组织测温系统,连接3根21 G组织测温针(南京康友微波能应用研究所,中国)。
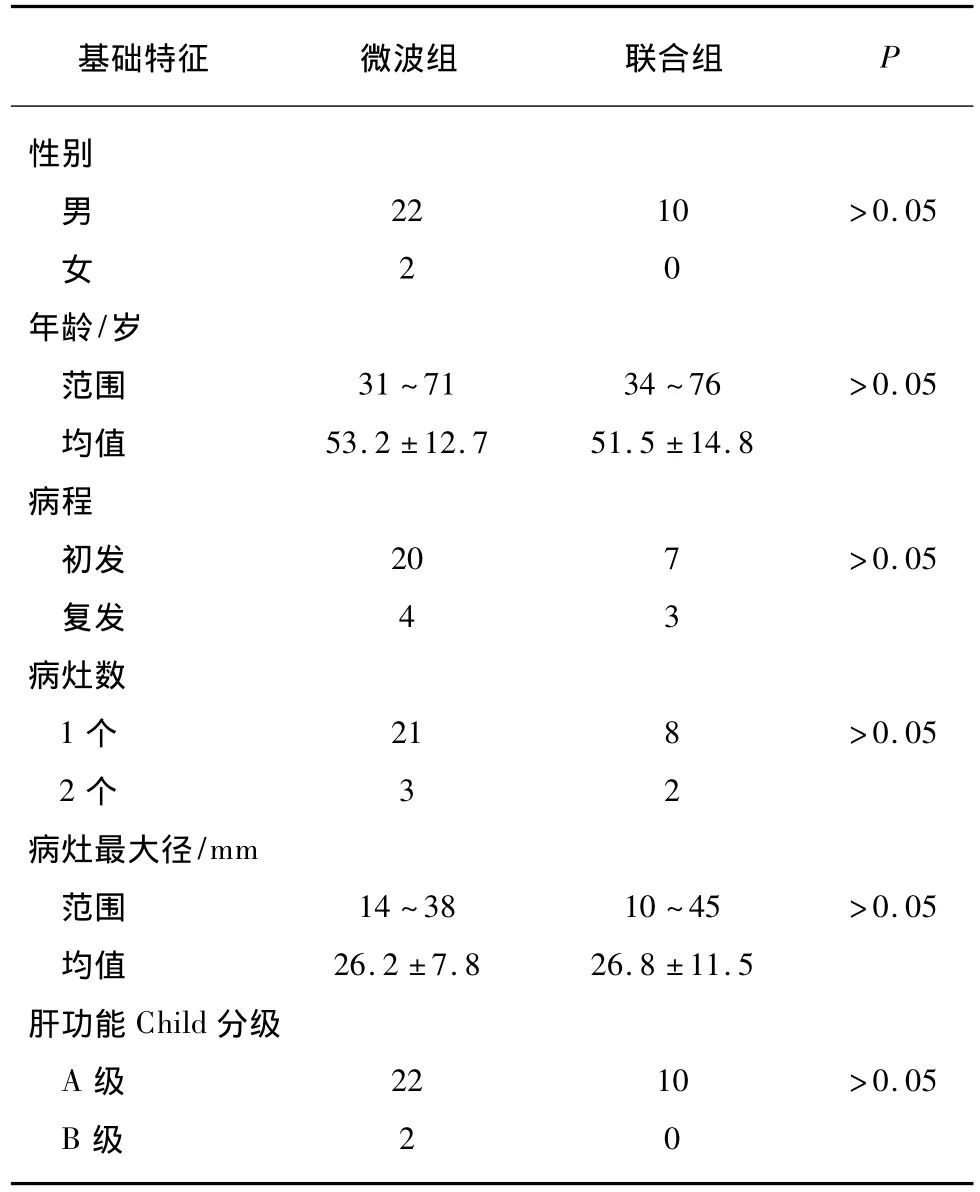
表1 联合组与微波组患者及肿瘤基础特征比较Tab.1 Comparison of clinical characteristics between combination group and PMWA group
微波治疗方案设计为1次消融治疗实现肿瘤完全灭活。根据肿瘤的大小、部位结合微波消融针热场分布及操作者多年消融治疗临床经验,制定每位患者及每个肿瘤病灶的消融方案[7]。一般情况下,对于直径<1.7 cm的肿瘤,使用单根微波天线,对于直径≥1.7 cm的肿瘤,使用两根微波天线,根据肿瘤大小分次布针形成组合热场。瘤边缘区植入1根测温针,监测瘤边缘温度。对于肿瘤病灶邻近胃肠、胆囊及肝内Glission鞘一二级分支等重要器官和结构时,利用超声引导,在肿瘤边缘邻近重要结构处的肝组织内或肿瘤边缘组织内放置1~2根测温针及1~2根21G的PTC针。治疗中使用微波输出功率为40~60周,通过PTC针在治疗过程中缓慢注射1~5 ml无水酒精至邻近重要结构处的肿瘤边缘组织内,并监测测温针所在邻近重要结构部位的温度,通过停止微波发射及/或改变输出功率控制监测部位温度在45℃~60℃,维持10 min。治疗过程中观察超声及瘤边缘温度上升情况,要求非邻近危险部位瘤边缘温度达到60℃以上或54℃ 3 min以上,并且声像图显示消融所致强回声区完全覆盖瘤区。微波组和联合组患者均进行1~2次消融治疗,使用微波针数为1~4针,两组消融治疗次数和治疗针数差异无统计学意义(P>0.05)。
1.3 DCs和效应细胞培养方法
免疫细胞的培养参照Romani等[8]报道的方法,在解放军总医院普外研究所GMP(Good Manufacturing Practice)实验室进行。用淋巴细胞分离液(中科院血液研究所)采用密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)。PBMCs悬浮于10 ml DC专用培养基STEM-34(Gibco,美国),37℃ 5%CO2恒温培养箱贴壁3 h。吸出未贴壁细胞,贴壁细胞加入人重组粒巨噬细胞集落刺激因子(human recombinant granulocyte-macrophage colonystimulating factor,rh-GM-CSF)1000 U/ml(北京联合药业)及人重组白细胞介素4(human recombinant interleukin 4,rh-IL-4)500 U/ml(北京联合药业),隔日半量换液,加入细胞因子,剂量同前。第7天收获半量iDC细胞回输,另半量iDC于第9天加入肿瘤抗原裂解物、BA 2.8万粒/ml及细胞因子制备荷载肿瘤抗原的DC。未贴壁的PBMCs细胞用于制备CIK细胞,用淋巴细胞培养液KBM-551(TaKaRa,日本)重悬,加入 γ 干扰素(IFN-γ)1 000 U/ml,37 ℃ 5%CO2恒温培养箱培养过夜,加入CD3单抗(北京瑞得合通公司)2 μg/ml、CD28 单抗(北京瑞得合通公司)1 μg/ml、IL-2(北京瑞得合通公司)500 U/ml,37 ℃5%CO2恒温培养箱培养。隔日添加新鲜培养基及IL-2,第12天收获CIK细胞。在第二疗程中,未贴壁的PBMCs细胞与第一疗程中培养的荷载肿瘤抗原的DCs细胞共培养以制备CTL细胞(培养方法同CIK细胞),第10天收获。在第三疗程中,在收获和回输的前1 d,CIK细胞与成熟DCs细胞以10∶1比例混合培养。
1.4 免疫细胞回输前表型分析
免疫细胞回输前,利用单抗与表面分子直接结合法,采用四色流式细胞仪 FACSCalibur(BD Biosciences)及Cell QuestPro软件对免疫细胞特异性表面标志分子进行表型分析。各流式检测管中加入细胞样本(1 ×106),离心 1 500 r/min,5 min,弃上清;加入1 ml的D-hanks'液洗涤,离心1 500 r/min,5 min,弃上清;加入抗体标记样本细胞(CD4/8/3抗体各20 μl及 CD56 抗体5 μl标记效应细胞,CD80/86/83及 HLA-DR 抗体各 20 μl标记 DC),避光40 min;加入2 ml的D-hanks'液洗涤,离心1500 r/min,5 min,弃上清,加入500 μl鞘液上机检测分析。
1.5 免疫治疗方案
免疫治疗三个疗程分别开始于微波治疗日、微波治疗后11 d和第100天,免疫细胞从患者45 ml外周血中分离和诱导培养。第一疗程中,微波治疗前1周,抽取患者外周血用于分离诱导培养DC及CIK细胞;微波治疗前活检,2条组织送病理检查,3条组织用于冻融法制备自身肿瘤抗原;微波消融后2 h,行超声造影评价消融疗效排除残存高增强结节;在超声造影引导下将21 G穿刺针引导至消融区与充血带交界区后缘,局部注射半量培养7 d的iDC(<2 cm结节注射4 ml,≥2 cm结节注射8 ml),将穿刺针退至消融区与充血带交界区前缘,注射剩余半量。微波治疗后第5天,经静脉回输CIK。第二疗程中,微波治疗后次日,抽取患者外周血用于分离培养制备负载肿瘤抗原的成熟DC和CTL,于微波消融后第11天回输。成熟DCs悬浮于1 ml生理盐水中在超声引导下回输到双侧腹股沟淋巴结(每侧0.5 ml)。CTL细胞悬浮于20 ml生理盐水中,于微波消融后第11天在超声造影引导下于肝内消融区与充血带交界区局部回输4 ml或8 ml(方法同iDC回输),剩余量在超声引导下回输到右上腹腹腔内。第三疗程中,成熟DC于培养后第10天回输至腹股沟淋巴结内;DC-CIK于培养后第10天回输到右上腹腹腔内及第12天经静脉回输。
1.6 外周血淋巴细胞亚群分析
患者治疗前后外周血淋巴细胞表型分析用流式细胞仪进行检测。血样以EDTA抗凝,各检测管中加入相应抗体(CD3-PerCP,CD4-FITC,CD8-FITC,CD 25 PE,CD 28 PE,CD56 PE,Mouse IgG1-FITC,Mouse IgG1-PE,Mouse IgG2a-PE,Becton Dickinson Immunocytometry Systems,BDIS,USA),混匀,室温暗处反应15 min;加入2 ml FACS Lysing Solution(BDIS,USA),混匀,室温暗处放置10 min;3 000 r/min,离心 5 min,弃上清;洗涤,加入 300 μl 1% 多聚甲醛;2℃~8℃暗处保存,24 h内用FACS-Calibur(Becton Dickinson,USA)检测分析。
1.7 病理诊断、临床观察及随访
每位患者治疗至少2种增强影像检查考虑肝癌诊断,所有初发的肝癌患者微波治疗前均行超声引导下活检,每位患者均有明确病理诊断。
微波消融治疗前、消融后1、3个月及以后每3个月、1年后每6个月行实验室检查及US、增强CT或增强MRI检查。实验室检查随访指标包括血常规、肿瘤标记物、肝肾功能。消融治疗前1周及治疗后1、3、6个月进行外周血淋巴细胞亚群百分比检测。
1.8 统计学方法
实验数据使用CHISS统计软件进行统计学处理,计量资料以±s表示。计量资料两组间比较采用t检验,多组比较采用方差分析或秩和检验;计数资料采用Pearson卡方检验;P<0.05为差异有统计学意义。
2 结 果
2.1 微波消融联合过继细胞免疫治疗的安全性
联合治疗组10例患者54次细胞回输治疗未出现Ⅲ或Ⅳ级严重不良反应,治疗后主要的不良反应为发热及轻微乏力,15(27.78%)次细胞回输后无任何不良反应,39(72.22%)次细胞回输后出现发热,21次为低热,9次出现38℃~39℃之间中等发热,仅9次为39℃以上高热。经对症处理,2~7 d后体温降至正常,乏力症状也消失,不同细胞回输后发热程度及持续时间均无统计学差异(P>0.05)。实验室检查动态观察6个月,临床观察12个月以上,未发现有明显肝肾心肺、血液系统和神经系统毒性作用,亦无明显自身免疫疾病临床表现。
2.2 患者外周血淋巴细胞亚群百分比的变化
治疗前联合组与微波组外周血各淋巴细胞亚群百分比差异无统计学意义(P>0.05);微波组治疗后1、3、6个月时外周血各淋巴细胞亚群百分比与治疗前相比,差异无统计学意义(P>0.05),联合组患者治疗前后外周血 CD3+、CD3+CD56+及 CD3-CD56+细胞亚群百分比无明显变化,而 CD4+、CD8+、CD4+CD25high、CD8+CD28+、CD8+CD28-细胞亚群百分比及CD4+/CD8+比值有较大变化。
治疗后1个月,联合组患者外周血CD4+细胞百分比降低并显著低于微波组(P<0.01)、CD8+细胞百分比升高并显著高于微波组(P<0.01)、CD4+/CD8+比值降低并显著低于微波组(P<0.01)。联合组患者外周血CD4+CD25highTreg细胞亚群较治疗前显著降低(P<0.05),并显著低于微波组(P<0.05)。联合组原初及早期效应细胞亚群CD8+CD28+细胞百分比较治疗前升高,而微波组较治疗前降低,(P<0.01),联合组中晚期记忆及效应细胞亚群CD8+CD28-细胞百分比较治疗前显著升高(P<0.05)。
经过两个疗程免疫治疗后,第3个月时,联合组患者外周血CD4+细胞百分比低于治疗前并显著低于微波组(P<0.05)、CD8+细胞百分比降低仅略高于治疗前,与微波组相比差异无统计学意义(P>0.05),但CD4+/CD8+比值仍低于治疗前并显著低于微波组(P<0.05,图2)。联合组患者外周血CD4+CD25+细胞亚群百分比仍显著低于治疗前(P<0.05),但 CD4+CD25highTreg细胞亚群百分比与微波组差异无统计学意义(P>0.05)。联合组CD8+CD28+细胞亚群百分比虽已降至治疗前水平但仍显著高于微波组(P<0.05),且记忆及效应细胞亚群CD8+CD28-细胞百分比仍显著高于治疗前(P<0.05),见表2。
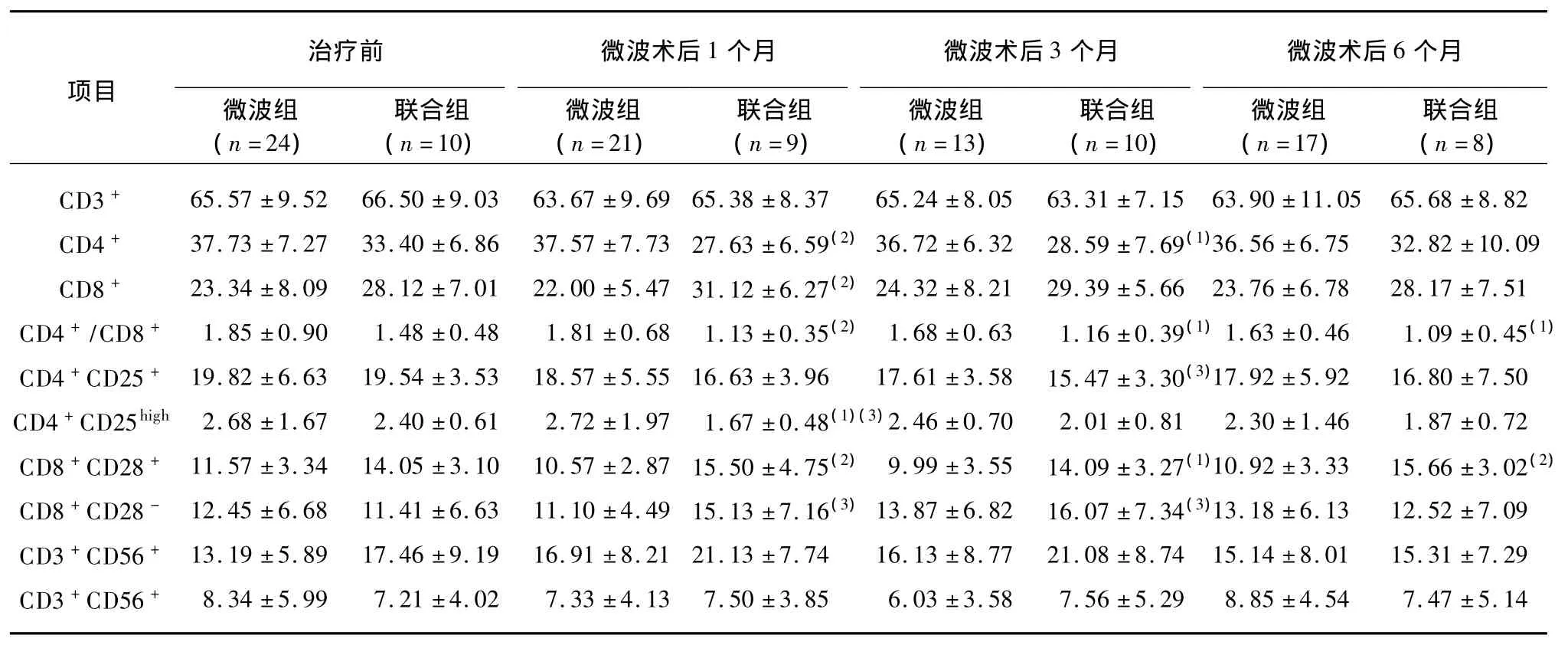
表2 联合组与微波组治疗前后外周血淋巴细胞亚群比例的比较Tab.2 Comparison of the percentage of peripheral lymphocytes between combination group and PMWA group before and after treatment
经过第三疗程免疫治疗,治疗后6个月时,联合组患者外周血淋巴细胞亚群CD4+/CD8+比值依然低于治疗前并显著低于微波组(P<0.05);效应T细胞亚群CD8+CD28+百分比再次升高,显著高于微波组(P<0.01),而 CD8+CD28-、CD4+CD25+及CD4+CD25highTreg细胞亚群与治疗前比较以及与微波组比较均无显著差异。
3 讨 论
目前,治疗肝癌的有效方法有手术切除、局部消融和经肝动脉栓塞等,均能极大地减少肿瘤负荷,取得显著的阶段性临床疗效。然而,肿瘤常常在治疗后1年内出现复发。既往的研究[9]表明,微波治疗刺激局部免疫反应,但持续时间较短,提示微波治疗后有必要进行免疫治疗,进一步巩固和扩大消融治疗后减灭瘤负荷的成果,达到降低和延缓肿瘤复发的目的。根据0级动力学原则,一定的免疫活性细胞只能杀灭一定数量的肿瘤细胞,较少数量的肿瘤细胞能被免疫系统消灭,而较多的肿瘤负荷则难以抗衡。肝癌病灶微波消融后体内大部分肿瘤细胞死亡,机体肿瘤负荷已阶段性降至低谷,但病灶局部、肝内或肝外以及血循环内可能仍然存在少量的肿瘤细胞或微小病灶,消融后早期应为进行免疫治疗的最佳时机。
肝癌患者多有慢性肝炎感染和肝硬化背景,机体免疫状态复杂,肝癌消融术后即刻联合免疫治疗的治疗方案尚未见报导,临床治疗安全性是首先必须在治疗过程中观察和证实的。本临床初步研究结果表明微波消融后联合树突状细胞疫苗及效应细胞过继转移治疗是安全的,没有发生任何Ⅱ级以上不良反应。主要不良反应为发热及轻微乏力,持续时间短,仅需对症处理,患者完全可以耐受并不影响日常活动。且不同细胞回输后发热的程度及持续时间均无明显差异,特别是微波联合消融区周边注射iDC治疗后与其他免疫细胞回输治疗后发热程度及持续时间无明显差异,表明本临床研究设计的免疫治疗方案是安全可行的。免疫治疗后随访12个月,患者的肝肾功能、凝血功能及血常规多个指标均与治疗前比较差异无统计学意义,表明免疫治疗对患者肝肾功能及骨髓造血功能均无明显影响;临床观察未发现对肺、心及神经系统有影响,亦未发现自身免疫疾病发生,表明本临床研究设计的微波联合免疫治疗方案是安全可行的。
消融治疗后,不仅机体肿瘤负荷减轻、肿瘤对免疫系统的抑制大大解除,同时死亡的肿瘤细胞使肿瘤抗原得以释放和暴露,因而也是激发机体特异性抗肿瘤免疫的最佳时机。本研究在微波治疗后11 d内,设计了2个疗程,综合应用多种免疫活性细胞通过多个途径进行免疫治疗,利用超声造影在消融术后早期及时、准确评价疗效以及精确定位消融区与充血带交界区的优势,将细胞回输到消融区与充血带交界区,将效应细胞或荷载肿瘤抗原的成熟DC细胞在超声引导下回输到腹腔内或淋巴结内。利用iDC迁移及吞噬能力强的特点,将iDC回输到肝癌病灶消融区局部,能高效地提呈肿瘤抗原,激发特异性抗肿瘤免疫,特别是能在消融区局部激活免疫细胞,从而改善了肿瘤病灶的局部微环境,有利于杀灭残癌。肿瘤抗原致敏的成熟DC细胞,具有可直接向淋巴细胞递呈肿瘤抗原的功能且迁徙能力较差,因而直接回输到淋巴系统内能更有利于发挥其激活淋巴细胞的作用。效应细胞是肿瘤细胞的直接攻击者,活化淋巴细胞还可释放细胞因子,将活化淋巴细胞回输到肿瘤局部有利于改善局部免疫微环境。因而,微波消融后多种免疫细胞综合过继治疗有利于从多环节上改善机体免疫。
细胞免疫在抗肿瘤免疫中发挥重要作用。人类血循环中的T细胞是一群异质细胞群,由许多表型和功能不同的亚型组成。共刺激分子CD28的表达将 T淋巴细胞分为 CD28+和 CD28-两亚群。CD28+是表达在原初未经抗原活化T细胞的表面分子。CD28-T细胞为CD28+T细胞与抗原提呈细胞表面的B 7.1(CD80)和 B 7.2(CD86)配体结合后,CD28+分子表达下调而成为CD28-表型的活化的能识别抗原的效应细胞[10]。CD4+细胞是辅助性T细胞(T helper,Th),受抗原刺激后可诱导分化为Th1和Th2细胞,Th1细胞有利于诱导正向抗肿瘤免疫反应,而 Th2细胞抑制抗肿瘤免疫反应。CD4+CD25+调节性T细胞是潜在的免疫反应的抑制者,是一群异质性细胞群。既往研究表明,CD4+CD25+Foxp3+Treg细胞损害CD8+CTL细胞的功能,并与肝癌的侵犯转移相关[11-12]。以往以CD4+CD25+表型细胞代表调节性T细胞,但其中难以区分调节性和活化的CD4+T细胞。新近研究[15]表明,Treg主要存在于CD4+细胞中高表达CD25的细胞亚群(CD4+CD25high)[13]。因而CD8+CD28+、CD8+CD28-及CD4+CD25high淋巴细胞亚群百分比的动态变化能反应机体免疫状态的改变。
研究表明,微波联合免疫治疗后明显改善了患者外周血淋巴细胞亚群的百分比和免疫状态。联合免疫治疗后辅助T细胞亚群CD4+百分比降低、效应细胞亚群CD8+百分比增高及CD4+/CD8+比值降低均与微波组差异有统计学意义,表明免疫治疗刺激了CD8+T细胞增殖,明显改变了患者外周血细胞百分比状态,且影响一直持续到治疗后6个月;更重要的是,联合免疫治疗后外周血原初效应细胞亚群CD8+CD28+百分比升高,显著高于微波组,并且一直持续到治疗后6个月。治疗后1、3个月,联合组CD8+CD28-细胞亚群百分比亦较治疗前显著升高,表明免疫治疗不仅刺激了CD8+T细胞增殖,扩大了效应细胞池,而且诱导了肿瘤抗原特异性效应细胞,激发了机体抗肿瘤免疫机能。联合免疫治疗后1个月CD4+CD25highTreg调节细胞亚群较治疗前显著降低,并显著低于微波组,表明免疫治疗明显改善了患者的免疫抑制状态。总之,治疗后患者抑制免疫反应的调节性T细胞百分比降低,活化效应细胞百分比升高,表明患者机体免疫状态和免疫微环境得到了正向调节和改善,抗肿瘤免疫机能得到激发和提高。
同时也需要注意到,治疗后3个月时CD8+CD28+亚群百分比较治疗后1个月时降低,经过第三疗程治疗后再次升高。治疗后6个月时,抗原特异性效应细胞CD8+CD28-亚群百分比较治疗后1和3个月时降低。治疗后3个月时CD4+CD25highT淋巴细胞亚群百分比较1个月时升高,虽仍低于治疗前但与微波组已无显著差异。经过第三个疗程的免疫治疗后,6个月时CD4+CD25highT淋巴细胞亚群百分比较3个月时降低但仍高于治疗后1个月,并且与微波组无显著差异。正向和反向调节免疫的两个淋巴细胞亚群百分比变化趋势表明,联合组患者前2个疗程免疫治疗力度大,效果较好,持续时间较长,而第3个疗程免疫治疗后对患者外周血细胞亚群比例和免疫功能的改善效果已减弱,表明本过继免疫治疗方案改善了机体免疫状态,但持续时间有限。
本研究表明微波消融术后早期联合树突状细胞和效应细胞综合过继免疫治疗肝癌是安全的,改善了患者外周血淋巴细胞比例和机体免疫状态,其对临床疗效的影响尚需大样本随机试验及长时间随访观察。
[1] Boonstra A,Woltman AM,Janssen HL.Immunology of hepatitis B and hepatitis C virus infections[J].Best Pract Res Clin Gastroenterol,2008,22(6):1049-1061.
[2] Lee WC,Wang HC,Hung CF,et al.Vaccination of advanced hepatocellular carcinoma patients with tumor lysate-pulsed dendritic cells:a clinical trial[J].J Immunother,2005,28(5):496-504.
[3] Fatourou EM,Koskinas JS.Adaptive immunity in hepatocellular carcinoma:prognostic and therapeutic implications[J].Expert Rev Anticancer Ther,2009,9(10):1499-1510.
[4] Takayama T,Sekine T,Makuuchi M,et al.Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma:a randomized trial[J].Lancet,2000,356(9232):802-807.
[5] Bruix J,Hessheimer AJ,Forner A,et al.New aspects of diagnosis and therapy of hepatocellular carcinoma[J].Oncogene,2006,25(27):3848-3856.
[6] de Brok MH,Sutmuller RP,van der Voort R,et al.In situ tumor ablation creates an antigen source for the generation of antitumor immunity[J].Cancer Res,2004,64(11):4024-4029.
[7] Liang P,Dong B,Yu X,et al.Prognostic factors for survival in patients with heaptocellular carcinoma after percutaneous microwave ablation[J].Radiology,2005,235(1):299-307.
[8] Schuler G,Brang D,Romani N.Production and properties of large numbers of dendritic cells from human blood[J].Adv Exp Med Biol,1995,378:43-52.
[9] Dong BW,Zhang J,Liang P,et al.Sequential pathological and immunologic analysis of percutaneous microwave coagulation therapy of hepatocellular carcinoma[J].Int J Hyperthermia,2003,19(2):119-133.
[10] Tsukishiro T,Donnenberg AD,Whiteside TL.Rapid turnover of the CD8+CD28-T-cell subset of effector cells in the circulation of patients with head and neck cancer[J].Cancer Immunol Immunother,2003,52(10):599-607.
[11] Shen X,Li N,Li H,et al.Increased prevalence of regulatory T cells in the tumor microenvironment and itscorrelation with TNM stage of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2010,136(11):1745-1754.
[12] Cany J,Tran L,Gauttier V,et al.Immunotherapy of hepatocellular carcinoma:is there a place for regulatory T-lymphocyte depletion?[J].Immunotherapy,2011,3(4 Suppl):32-34.
[13] Baecher-Allan C,Brown JA,Freeman GJ,et al.CD4+CD25highregulatory cells in human peripheral blood[J].J Immunol,2001,167(3):1245-1253.

