黄药类捕收剂对细菌浸出黄铜矿的抑制机理
董颖博 ,林 海 ,周闪闪
(1.北京科技大学 金属矿山高效开采与安全教育部重点实验室,北京 100083;2.北京科技大学 土木与环境工程学院,北京 100083)
细菌浸矿技术在选矿领域属于一门新技术,随着人类对矿物需求量不断增加,矿床开采难度不断加大,环境法规日益严厉,迫使人们不断开发新技术,以期充分利用矿物资源,特别是低品位、细分散和难处理矿石[1-3]。细菌浸矿技术具有成本低、能耗低且无污染等特点,越来越受到人们的关注[4]。目前,国内外研究者已针对细菌浸矿进行了大量研究,主要集中在高效浸矿细菌的选育、浸矿工艺的优化和细菌浸矿的工业化实施等方面[5-6]。然而,目前国内外在浮选药剂对细菌浸矿影响方面研究颇少。大量有色金属通过浮选方法回收,残余在精矿和尾矿中的浮选药剂对浸矿菌种活性有较大影响,进而影响浸矿效率。LOON和MADGWICK[7]研究表明,随着药剂用量增加,黄药类捕收剂对嗜酸氧化亚铁硫杆菌生长抑制作用增强,从而导致黄铜矿中浸出的铜离子和铁离子按比例减少,其中异丙基黄药对菌种毒性相对较小,因此,当对黄铜矿精矿进行微生物浸出时,异丙基黄药可作为黄铜矿富集的浮选药剂。BRIERLY和 BRIERLY[8]研究了在硫化锌精矿细菌浸出过程中浮选药剂对细菌生长的影响,得出了乙基黄药、丁胺黑药、丁基黄药和2号油对细菌生长由大到小的影响顺序。覃文庆等[9]研究了丁基醚醇、乙基黄药和丁胺黑药3种浮选药剂对浸矿细菌活性的影响,发现浮选药剂对细菌活性影响十分明显。董颖博等[10]研究得出了5种组合浮选药剂对浸矿细菌生长、氧化活性和铜浸出率的影响规律。但上述研究只得出了浮选药剂对细菌活性和浸矿性能有一定影响,均缺乏浮选药剂对细菌浸矿体系抑制的内在机制研究,因此对含有浮选药剂矿样的微生物浸出技术起不到有效的指导作用。
本文作者在研究浮选药剂对细菌毒害作用的基础上,采用XPS和FTIR等现代分析测试手段研究细菌、矿物与浮选药剂的作用性质,分析浮选药剂对浸渣表面Cu 2p、Fe 2p和S 2p电子结合能变化以及红外特征吸收峰偏移的影响,进而揭示浮选药剂对细菌浸矿的抑制机理。
1 实验
1.1 菌种及培养基
实验所用At.fLD-1菌株取自湖北大冶铜山口铜矿排水沟的土壤和矿坑水,经筛选、纯化分离、驯化和诱变培养后获得。微生物学鉴定分析结果表明,该浸矿细菌主要为嗜酸氧化亚铁硫杆菌(Acidthiobacillus ferrooxidans, 简称At.f菌)。该菌种最佳培养条件如下:初始pH值2.0、摇床温度30 ℃、转速160 r/min。采用9K培养基,将基础无机盐培养液于121 ℃灭菌20 min,能源物质硫酸亚铁经微孔滤膜(d0.22 μm)真空抽滤除菌,然后混合使用[11]。
1.2 实验矿样
本实验的矿样为黄铜矿,纯度约为80%,粒度为100%小于0.074 mm,黄铜矿的XRD衍射分析结果如图1所示。从图1可知,矿样主要含有黄铜矿,还有少量黄铁矿,其化学分析结果见表1。

图1 黄铜矿样品的XRD谱Fig.1 XRD pattern of chalcopyrite sample

表1 黄铜矿样品主要元素分析结果Table 1 Chemical analysis results of chalcopyrite sample(mass fraction, %)
1.3 实验方法
将2 g黄铜矿放入250 mL锥形瓶中,装入90 mL已灭菌pH值为2.0的无铁9K培养基,接入纯化后的At.fLD-1菌(细菌浓度为 1.0×108cell/mL)的菌液 10 mL,然后加入不同的浮选药剂,各浮选药剂添加量均为10 mg/L,矿浆浓度为2%(质量分数),置于30 ℃、160 r/min的空气浴恒温摇床内振荡培养,定期测定浸出液中铜的浸出率。待At.fLD-1菌浸出黄铜矿20 d后,收集浸渣,用稀硫酸和去离子水洗涤多次,经干燥处理后,作为XPS和FTIR测试分析的样品。
1.4 分析方法
Cu2+浓度采用原子吸收光谱法测定;采用 ZBM-300E无穷远生物显微镜观察细菌并采用血球计数板测定细菌数量;采用英国 Kratos公司生产的 AXIS Ultra DLD型XPS能谱仪进行黄铜矿及浸渣的光电子能谱分析;红外光谱分析采用Nicolet Nexus 670 FTIR光谱仪进行测定。
2 结果和讨论
2.1 黄药类捕收剂对At.f LD-1菌黄铜矿浸出的影响
选择硫化铜矿常用浮选捕收剂乙基黄药(记作Collector 1)、异丙基黄药(记作Collector 2)、丁基黄药(记作Collector 3)、异戊基黄药(记作Collector 4),其对At.fLD-1菌浸出黄铜矿时铜浸出率的影响结果见图2。由图2可以看出,与不加药剂的空白试验相比(记作Blank),4种黄药类捕收剂均会降低At.fLD-1菌浸出黄铜矿的铜浸出率;在4种捕收剂用量相同的情况下(均为10 mg/L),浸出20 d后,铜浸出率与空白试验相比,均有不同程度的降低。原因如下:矿物上残留的黄药类捕收剂对细菌浸出过程有较大影响,一方面是因为这些药剂会改变矿物表面的润湿性等表面性质;另一方面会影响浸矿菌种的生长,改变其氧化活性。从图2的结果可以得出 4种黄药类捕收剂对At.fLD-1菌浸出黄铜矿体系的浸铜效率影响作用由小到大顺序为丁基黄药、异丙基黄药、异戊基黄药、乙基黄药。
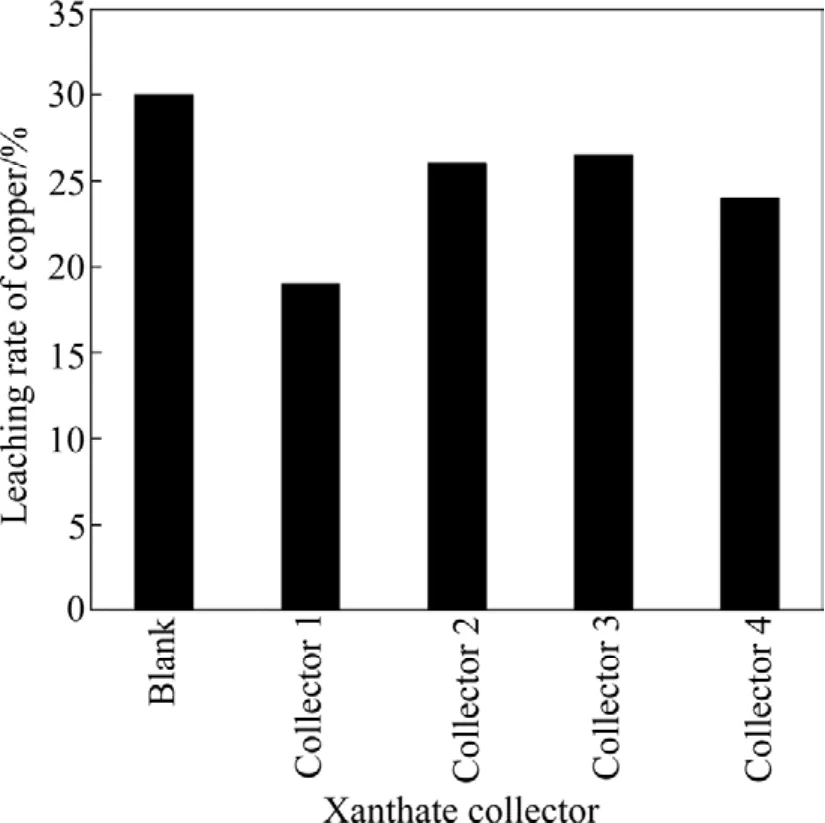
图2 不同黄药类捕收剂对铜细菌浸出率的影响Fig.2 Effect of xanthate collectors on leaching rate of copper
2.2 黄药类捕收剂作用下浸渣的XPS分析
为了研究黄药类捕收剂对细菌浸铜体系的影响机制,选择乙基黄药和异戊基黄药作用下At.fLD-1菌浸出黄铜矿的浸渣进行XPS能谱分析,并与无药剂作用时所得浸渣进行对比,进而分析黄药类捕收剂所引起的黄铜矿浸渣表面铜、铁、硫电子结合能的变化。试验得到的元素电子结合能以C 1s (284.6 eV)进行校正,仪器误差为±0.1 eV,灵敏度因子分别为Cu 2p 5.321 0、Fe 2p 2.957 0和S 2p 0.668 0。
图3~5所示分别为无黄药类捕收剂作用时,与黄铜矿原矿相比细菌浸渣表面Cu2p、Fe2p和S 2p电子结合能的位移。从图3可以看出,黄铜矿原矿表面Cu的强峰在932.25 eV处,表示空3d轨道处于激发态,这与纯Cu (Ⅰ)不匹配,TODD等[12]通过对黄铜矿、铜
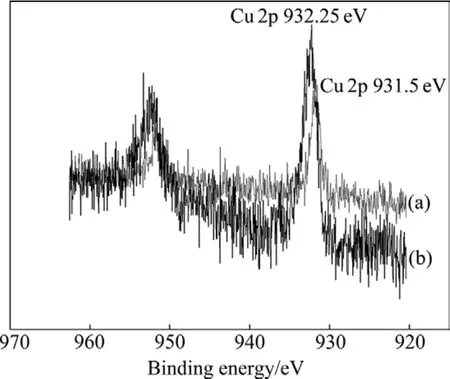
图3 无浮选捕收剂作用下细菌浸出前后黄铜矿表面Cu 2p电子结合能Fig.3 Electron binding energies of Cu 2p on surface of chalcopyrite and leached residue without collectors:(a)Leached residue; (b)Chalcopyrite
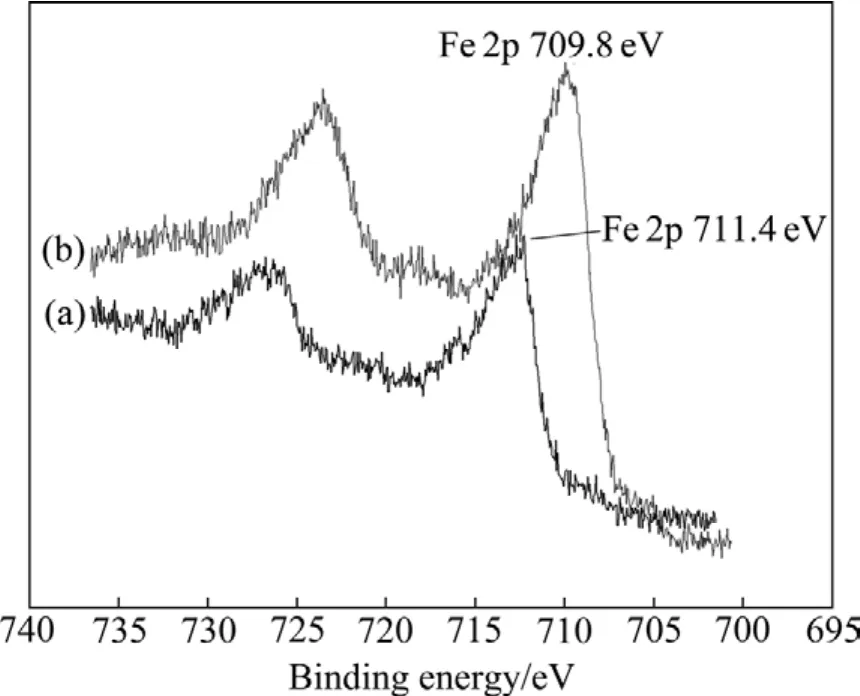
图4 无浮选捕收剂作用下细菌浸出前后黄铜矿表面Fe 2p电子结合能Fig.4 Electron binding energies of Fe 2p on surface of chalcopyrite and leached residue without collectors:(a)Leached residue; (b)Chalcopyrite
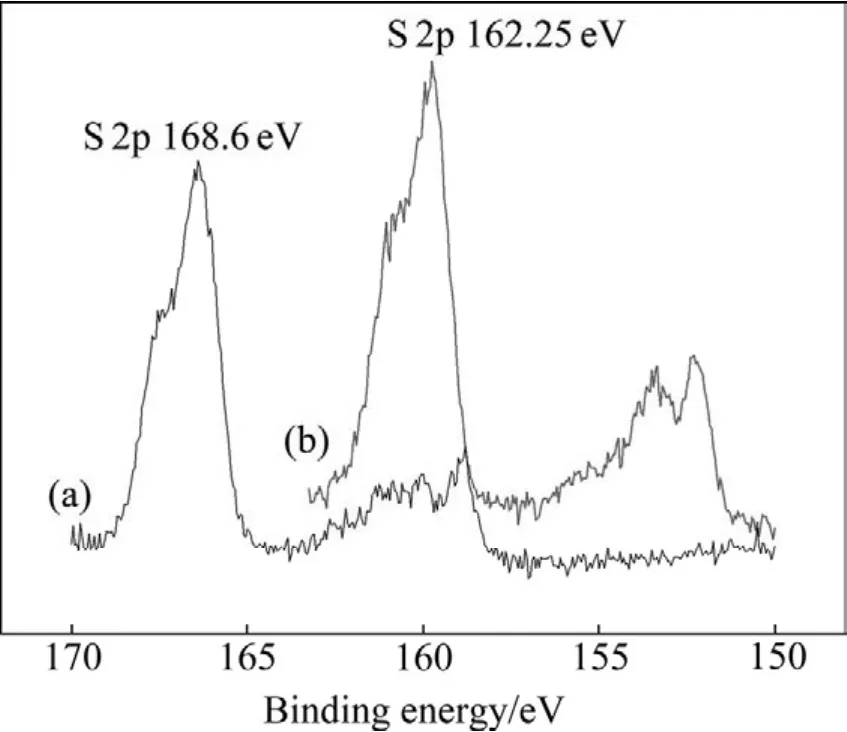
图5 无浮选捕收剂作用下细菌浸出前后黄铜矿表面 S 2p电子结合能Fig.5 Electron binding energies of S 2p on surface of chalcopyrite and leached residue without collectors:(a)Leached residue; (b)Chalcopyrite
蓝和辉铜矿中矿物表面铜结合能的比较,认为黄铜矿中铜离子应为 Cu(Ⅱ),结构式为 Cu2+Fe2+S2;浸渣表面Cu的强峰在931.5 eV处,与黄铜矿原矿的铜结合能相比偏移了-0.75 eV,说明细菌在黄铜矿表面发生了化学吸附,如反应式(1)所示。从图4中可以看出,黄铜矿原矿表面Fe 2p电子结合能为709.8 eV,浸渣表面Fe 2p电子结合能为711.4 eV,偏移了1.6 eV,峰的强度有所减弱,浸渣与黄铜矿原矿相比,矿物表面铁的强度降低,结合能增高,这是因为黄铜矿原矿表面 Fe(Ⅱ)(709.8 eV)被氧化成 Fe(Ⅲ)(711.4 eV),如反应式(2)所示,使 Fe(Ⅲ)峰强度增高,Fe(Ⅱ)峰强度降低,表明浸渣表面吸附有少量Fe3+[13]。图5所示为S 2p电子结合能,经过细菌作用后,矿物表面 S 2p峰从162.25 eV上升到168.6 eV。S的分谱中S 2p各种不同键能的物种分布在161.0~168.5 eV之间,各物种的分布区域不明显,部分叠加。低价态的硫被氧化为单质硫或多聚物沉淀在矿物表面,因此黄铜矿浸渣表面出现S0和SO42-的峰,如反应式(3)和(4)所示。

图6~8所示分别为乙基黄药和异戊基黄药对细菌浸出黄铜矿所得浸渣表面Cu 2p、Fe 2p和S 2p电子结合能的影响,并与无药剂的细菌浸渣进行对比。结果表明,乙基黄药的作用后浸渣表面Cu 2p、Fe 2p和S 2p的电子结合能位移分别为 931.5-931.75=-0.25 eV、711.4-710.6=0.8 eV和168.6-167.7=0.9 eV;在异戊基黄药存在的细菌浸矿体系中,浸渣表面Cu 2p、Fe 2p和 S 2p的电子结合能位移分别为931.5-931.7=-0.2 eV、711.4-710.9=0.5 eV和 168.6-168.15=0.45 eV。结合能位移在误差范围之外,说明黄药类捕收剂影响了细菌与黄铜矿的作用,使浸渣表面特征元素Cu、Fe和S的化学环境发生了变化,且不同黄药类捕收剂的影响程度不同。
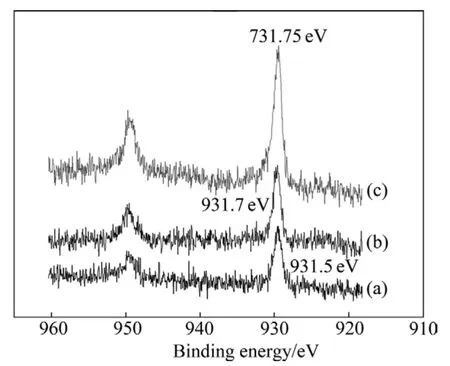
图6 不同黄药类捕收剂作用下黄铜矿浸渣表面Cu 2p电子结合能Fig.6 Electron binding energies of Cu 2p on surface of leached residues with different xanthate collectors: (a)Blank;(b)Isoamyl xanthate; (c)Ethyl xanthate
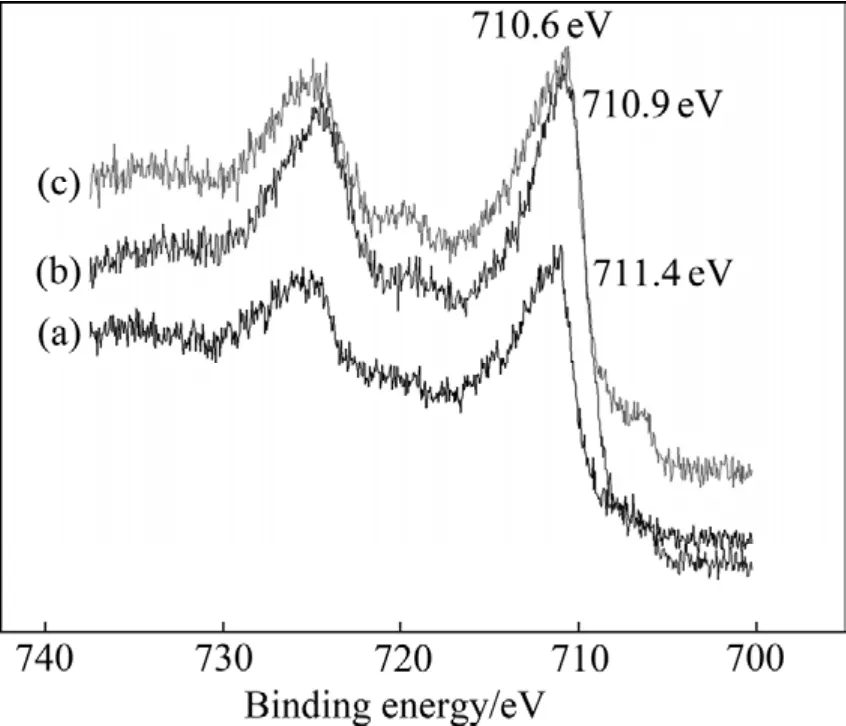
图7 不同浮选药剂作用下黄铜矿浸渣表面Fe 2p电子结合能Fig.7 Electron binding energies of Fe 2p on surface of leached residues with different xanthate collectors: (a)Blank;(b)Isoamyl xanthate; (c)Ethyl xanthate
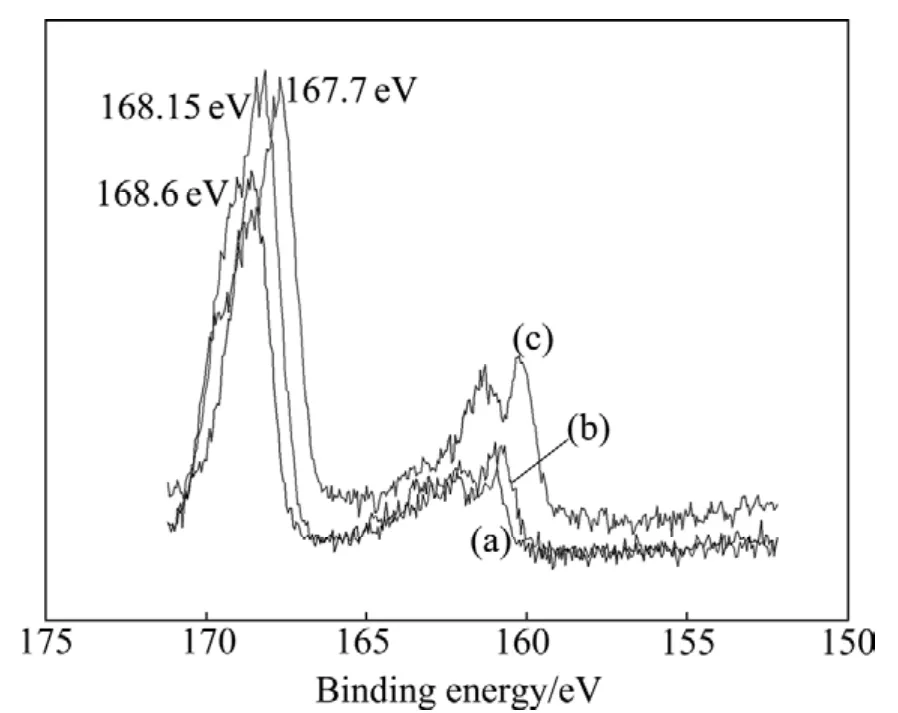
图8 不同浮选药剂作用下黄铜矿浸渣表面S 2p电子结合能Fig.8 Electron binding energies of S 2p on surface of leached residues with different xanthate collectors: (a)Blank;(b)Isoamyl xanthate; (c)Ethyl xanthate
从以上分析可以发现,在乙基黄药和异戊基黄药作用下,均会引起黄铜矿浸渣表面Cu 2p的电子结合能向高能量方向偏移,这是因为细菌的生长及活性受到抑制,阻碍了细菌与黄铜矿的作用,导致Cu 2p电子结合能的降低程度减小,故与无浮选药剂作用的细菌浸渣相比,Cu 2p电子结合能向高能量方向偏移,且乙基黄药作用下Cu 2p电子结合能向高能量方向偏移更多;而Fe 2p和S 2p 电子结合能向低能量方向偏移,同样是由于乙基黄药和异戊基黄药对细菌的生长、活性以及铜浸出率的抑制作用,使Fe(Ⅱ)被氧化成Fe(Ⅲ)以及低价态硫被氧化成高价态硫的程度降低,且乙基黄药的抑制作用更明显,使浸渣表面Fe 2p和S 2p电子结合能向低能量方向偏移较多。
表2所列为黄铜矿和不同条件下浸渣表面铜、铁和硫含量。结果表明,与黄铜矿原矿相比,无浮选药剂作用所得浸渣表面铜含量由22.96%降低至18.78%,铁含量从24.47%升高至25.66%,硫含量也有所升高,从52.68%升高到了55.56%。与无药剂作用的浸渣相比,黄药类捕收剂的加入会使浸渣表面铜的相对含量增加,且乙基黄药作用下的增加程度较大,这是乙基黄药对细菌活性和浸矿效率抑制作用较大所导致。
2.3 浮选药剂作用下浸渣的FTIR分析
采用傅立叶变换光谱仪测试菌种、黄铜矿和浸渣的红外光谱,比较有黄药类捕收剂作用浸渣红外光谱特征吸收峰的变化,从而分析黄药类捕收剂对细菌浸铜体系的抑制机理。

表2 黄铜矿和不同条件下浸渣表面铜、铁和硫的含量Table 2 Contents of copper, iron and sulfur of chalcopyrite and leached residues under different conditions
图9所示为At.fLD-1菌的红外光谱。对谱带进行归属分析[14]可知:3 400~3 300 cm-1范围出现—OH、—NH2或—NH基团的吸收峰;2 930 cm-1附近有来自核酸、蛋白质和脂类的—CH3、—CH2的对称及反对称伸缩运动产生的吸收峰;1 650.80 cm-1处谱带主要为蛋白质酰胺Ⅰ峰的C=O伸缩振动峰,1 530.02 cm-1处为—CONH2的变形振动蛋白质酰胺Ⅱ峰;1 450 cm-1处为附近的蛋白质分子中—CH3反对称变形振动峰和—CH2变形产生的吸收峰;1 200 cm-1附近有磷酸二酯基团的对称和反对称伸缩振动以及C—O的伸缩运动;1 087.67 cm-1处S=O的伸缩运动、C—O的伸缩运动、C—O—C的伸缩运动均引起吸收峰的产生。At.fLD-1菌红外光谱分析结果充分表明,嗜酸氧化亚铁硫杆菌细胞成分中含有—OH、—NH2、C=O、C—O和—CONH2等活性基团,它们在吸附过程中起重要作用[15]。
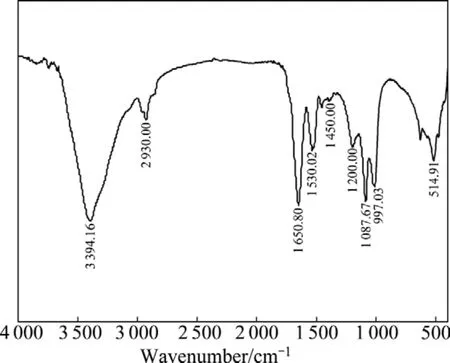
图9 At.f LD-1菌的红外光谱Fig.9 FTIR spectrum of At.f LD-1 bacteria
图10和11所示分别为无黄药类捕收剂作用下黄铜矿细菌浸出前后的红外光谱。比较图10和11可以看出,黄铜矿与细菌作用前后的红外光谱明显不同,黄铜矿与细菌作用后,其表面在3 409.89、1 192.24、1 081.24、1 000.92、628.62和508.06 cm-1处出现了吸收峰,这些吸收峰都属于At.fLD-1菌特征峰范围,同时黄铜矿本身在3 770.00、1 622.65和1 440.16 cm-1处吸收峰分别偏移至3 750.00、1 640.46和1 424.99 cm-1,而2 920.00 cm-1处的吸收峰消失,这表明At.fLD-1菌在黄铜矿表面发生了化学吸附[16-17]。

图10 黄铜矿的红外光谱Fig.10 FTIR spectrum of chalcopyrite
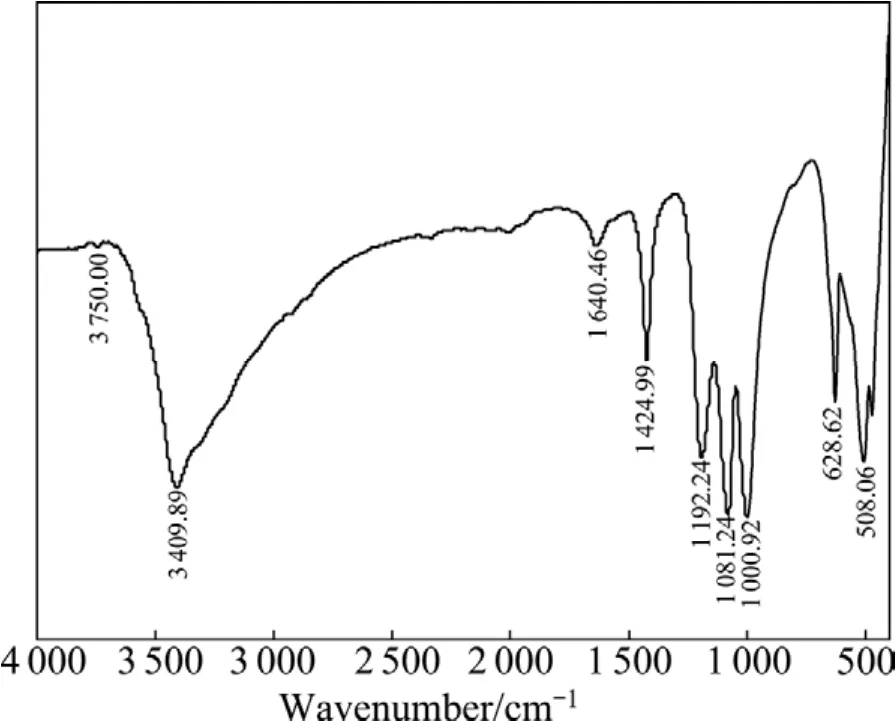
图11 无浮选捕收剂作用下细菌浸出后黄铜矿浸渣表面的红外光谱Fig.11 FTIR spectrum of leached residues without collectors
图12所示为乙基黄药和无浮选药剂作用下细菌浸出黄铜矿所得浸渣的红外差谱。结果表明,乙基黄药的作用使浸渣表面的特征吸收峰发生了偏移。原因是乙基黄药在黄铜矿表面发生化学吸附,生成产物双黄药和黄原酸铜;采用At.fLD-1菌浸出被乙基黄药作用后的黄铜矿,浸出体系基本保持pH值为2.0左右,在酸性条件下,黄铜矿表面的双黄药和黄原酸铜会与稀硫酸发生反应,双黄药在酸性溶液中所形成的黄原酸盐和一硫代碳酸盐都迅速分解,黄原酸盐迅速分解生成醇类和CS2,一硫代碳酸盐分解生成OCS。黄原酸铜在pH值为2.0的酸性条件下,发生如下反应:
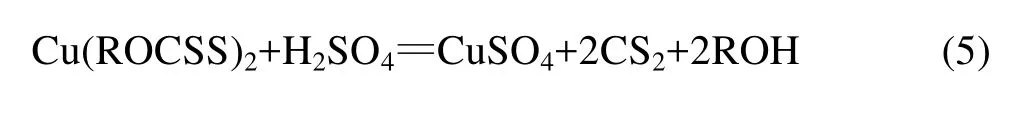
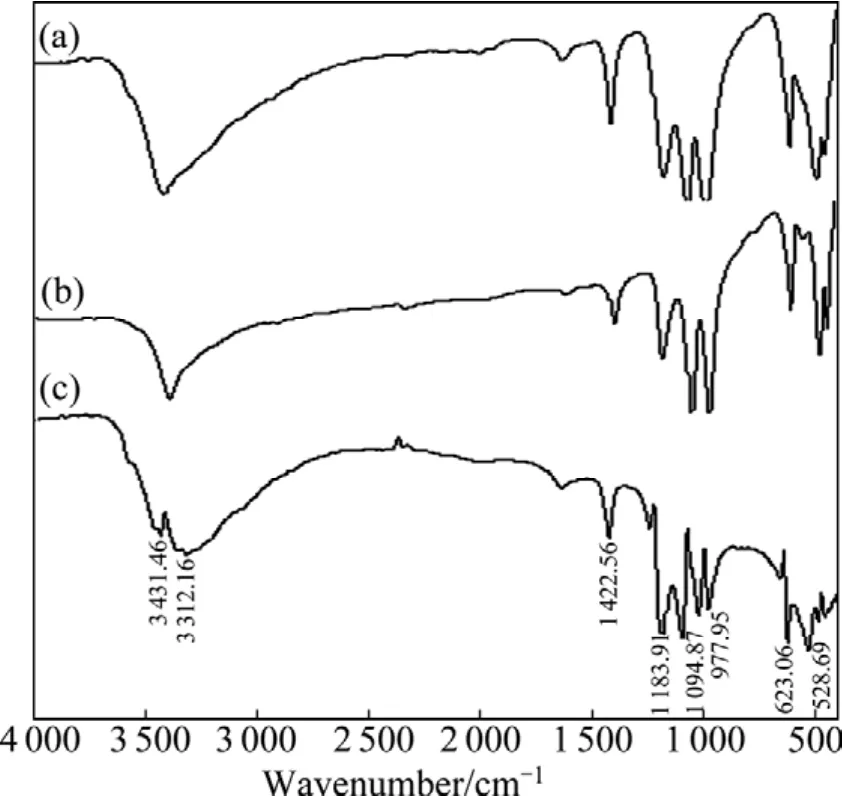
图12 乙基黄药和无药剂作用下细菌浸出黄铜矿浸渣的红外差谱Fig.12 Difference between FTIR spectra of leached residues under different conditions: (a)Without collectors; (b)Ethyl xanthate; (c)Differential spectrum
生成产物烃基醇和CS2均会引起细菌氧化活性降低。图12中3 431.46和1 192.24 cm-1处出现了差谱,是因为生成产物醇类在浸渣表面的吸附使—OH的伸缩振动峰发生了偏移;同时,由于醇类和 CS2对At.fLD-1菌产生毒害作用,降低其氧化酶活性、引起蛋白质变性、表面基团发生变化等,导致浸渣表面—NH2、C=O、C—O和—CONH2等基团的红外特征吸收峰发生偏移或消失。因此,乙基黄药的作用使浸渣表面的特征吸收峰发生了偏移。
3 结论
1)乙基黄药、异丙基黄药、丁基黄药和异戊基黄药4种黄药类捕收剂均会降低At.fLD-1菌浸出黄铜矿浸矿体系的铜浸出率。其中,乙基黄药的抑制作用较强。
2)黄药类捕收剂使浸矿细菌的生长及活性受到抑制,阻碍了细菌与黄铜矿的作用,引起浸渣表面Cu 2p、Fe 2p和S 2p电子结合能的变化,且黄药类捕收剂对细菌浸矿效率抑制作用越大,电子结合能变化程度越大。浸渣表面的铜、铁和硫的含量也发生变化。
3)At.fLD-1菌在黄铜矿表面发生了化学反应;黄药类捕收剂在酸性条件下的生成产物吸附在矿物表面,对菌种造成毒害作用,从而使浸渣表面红外特征吸收峰发生偏移。
[1]BRIERLEY J A.A perspective on developments in biohydrometallurgy [J].Hydrometallurgy, 2008, 94(1/4): 2-7.
[2]尹升华, 吴爱祥, 王洪江, 韩 斌.微生物浸出低品位矿石技术现状与发展趋势[J].矿业研究与开发, 2010(1): 46-49.YIN Sheng-hua, WU Ai-xiang, WANG Hong-jiang, HAN Bin.Current status and present situation and developing trend of low-grade ore bioleaching technology [J].Mining Research and Development, 2010(1): 46-49.
[3]BALAZ P, KUSNIEROVA M, VARENCOVA V I, MISURA B.Mineral properties and bacterial leaching of intensively ground sphalerite and sphalerite-pyrite mixture [J].International Journal of Mineral Processing, 1994, 40(3/4): 273-285.
[4]YANG Song-rong, XIE Ji-yuan, QIU Guan-zhou, HU Yue-hua.Research and application of bioleaching and biooxidation technologies in China [J].Minerals Engineering, 2002, 15(5):361-363.
[5]POULIN R, LAWRENCE R W.Economic and environmental niches of biohydrometallurgy [J].Minerals Engineering, 1996,9(8): 799-810.
[6]ZHANG Yan-sheng, QIN Wen-qing, WANG Jun, ZHEN Shi-jie,YANG Cong-ren, ZHANG Jian-wen, NAI Shao-shi, QIU Guan-zhou.Bioleaching of chalcopyrite by pure and mixed culture [J].Transactions of Nonferrous Metals Society of China,2008, 18(6): 1491-1496.
[7]LOON H Y, MADGWICK J.The effect of xanthate flotation reagents on bacterial leaching of chalcopyrite byThiobacillus Ferrooxidans[J].Biotechnology Letters, 1995, 17(4): 997-1000.
[8]BRIERLY J A, BRIERLY C L.Present and future commercial applications in biohydrometallurgy [J].Hydrometallurgy, 2001,59(3): 233-239.
[9]覃文庆, 王 军, 蓝卓越, 陈永海.浮选药剂对浸矿细菌活性的影响 [J].中南大学学报: 自然科学版, 2004, 35(5):759-762.QIN Wen-qing, WANG Jun, LAN Zhuo-yue, CHEN Yong-hai.Effect of flotation reagents on activity of bacteria in bioleaching[J].Journal of Central South University: Science and Technology,2004, 35(5): 759-762.
[10]董颖博, 林 海, 傅开彬, 莫晓兰, 温洪伟.浮选药剂对嗜酸氧化亚铁硫杆菌浸出低品位铜尾矿的影响[J].中国有色金属学报, 2011, 21(9): 2291-2297.DONG Ying-bo, LIN Hai, FU Kai-bin, MO Xiao-lan, WEN Hong-wei.Effect of flotation reagents on bioleaching of low grade copper tailings byAcidthiobacillus ferrooxidans[J].The Chinese Journal of Nonferrous Metals, 2011, 21(9): 2291-2297.
[11]DONG Ying-bo, LIN Hai, WANG Han, MO Xiao-lan, FU Kai-bin, WEN Hong-wei.Effects of ultraviolet mutation on bioleaching of low-grade copper tailings [J].Minerals Engineering, 2011, 24(8): 871-875.
[12]TODD E C, SHERMAN D M, PURTON J A.Surface oxidation of chalcopyrite (CuFeS2)under ambient atmospheric and aqueous (pH 2-10)conditions: Cu, Fe L-and O K-edge X-ray spectroscopy [J].Geochimica et Cosmochimica Acta, 2003,67(12): 2137-2146.
[13]FADLEY C S.X-ray photoelectron spectroscopy: Progress and perspectives [J].Journal of Electron Spectroscopy and Related Phenomena, 2010, 178(5): 2-32.
[14]朱淮武.有机分子结构波谱解析[M].北京: 化学工业出版社,2005: 156-158.ZHU Huai-wu.Spectral analysis of organic molecular structure[M].Beijing: Chemical Industry Press, 2005: 156-158.
[15]SHARMA P K, DAS A, HANUMANTHA RAO K, FORSSBERG K S E.Surface characterization ofAcidithiobacillus ferrooxidanscells grown under different conditions [J].Hydrometallurgy, 2003, 71(1/2): 285-292.
[16]LEPPINEN J O, BASILIO C I, YOOH R H.In-situ FTIR study of ethyl xanthate and sorption on sulfide minerals under conditions of controlled potential [J].International Journal of Mineral Processing, 1989, 26(3/4): 259-274.
[17]LIU Hui, GU Guo-hua, XU Yang-bao.Surface properties of pyrite in the course of bioleaching by pure culture ofAcidithiobacillus ferrooxidansand a mixed culture ofAcidithiobacillus ferrooxidansandAcidithiobacillus thiooxidans[J].Hydrometallurgy, 2011, 108(1/2): 143-148.

