角质形成细胞PAR-2基因siRNA的筛选
袁磊 金蓉 张艳 张余光
蛋白酶激活受体-2(PAR-2)是一种7次跨膜的G蛋白偶联受体分子。在人体表皮中,角质形成细胞膜上存在着PAR-2,而在黑素细胞中不表达。Seiberg等[1]发现,在黑素细胞和角质形成细胞三维双相共培养体系中,存在于角质形成细胞中的PAR-2激活后参与黑素小体的转运,能促进皮肤色素沉着。使用大豆胰蛋白酶抑制剂抑制PAR-2的激活,可完全抑制紫外线(UVR)引起的皮肤“晒黑”效应。目前,PAR-2被认为在黑素小体传输过程中起关键的调节作用。
但是,以往针对PAR-2在黑素小体传输过程中作用的研究,均未针对其基因水平特异性的报道。RNA 干扰(RNA interference,RNAi)是正常生物体内抑制特定基因表达的一种现象,是指细胞产生内源性双链 RNA(Double stranded RNA,dsRNA)或导入外源性dsRNA后,与dsRNA同源的内源性mRNA发生特异性的降解,从而导致基因表达沉默的现象。因这种现象发生在转录后水平,故又称为转录后基因沉默(Post-transcriptional genesilencing,PTGS)[2-3]。RNA干扰作用与靶基因的抑制剂作用相比,具有高度的特异性,从而更能阐明PAR-2在传输过程中的作用和色素传输的机制。
我们使用软件针对PAR-2基因设计siRNA序列,利用化学合成法合成siRNA片段,并转入角质形成细胞后,通过半定量RT-PCR和Western Blot方法检测其对PAR-2 mRNA和蛋白表达的抑制作用,以期找到可靠的抑制PAR-2基因表达的siRNA片段,为进一步研究PAR-2的功能奠定基础。
1 材料与方法
1.1 主要试剂
兔抗人PAR-2多克隆抗体(Santa Cruz公司,美国);羊抗兔二抗(Dako公司,丹麦);转染试剂盒lipofectamine 2000(Invitrogen 公司,美国);角质形成细胞生长添加物和dK-SFM培养基(Cascade Biologics公司,美国);Trizol RNA 抽提试剂盒(Gibco公司,美国);RT-PCR试剂盒(Takara公司,日本);PCR引物由上海生工生物工程有限公司合成。
1.2 细胞培养
角质形成细胞取自临床小儿包皮环切手术后的废弃包皮组织。培养基为添加角质形成细胞生长添加物的dK-SFM,在37℃、5%CO2培养箱中培养,0.25%的胰酶常规消化传代,取纯化后生长状态良好的第3代细胞作为实验细胞。
1.3 siRNA的设计与合成
首先根据基因库中报道的人类PAR-2基因序列(GI:55065),并采用Ambion公司的网上设计软件,设计3对针对人PAR-2基因不同位点的siRNA靶序列,另设计1对阴性对照siRNA序列。4段序列经BLAST检索证实与其他基因无同源性,送上海吉玛制药技术有限公司化学合成,合成的阴性对照siRNA带有FAM标记(表1)。
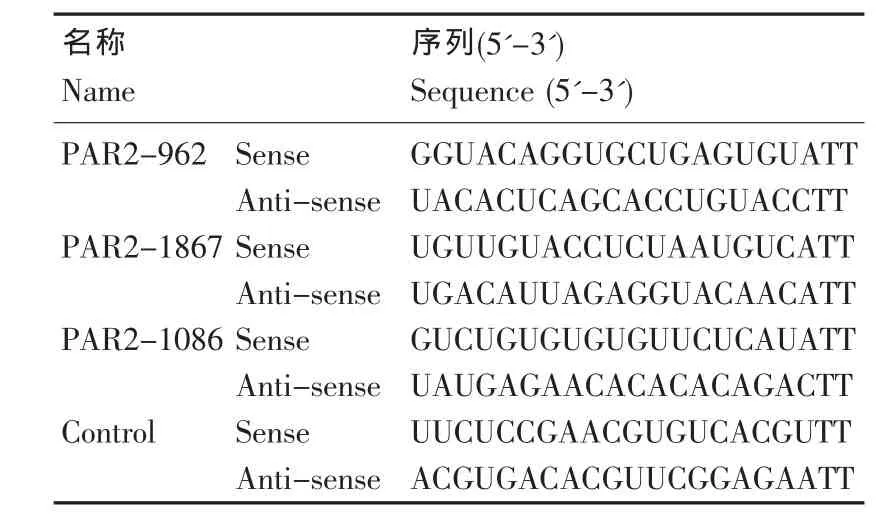
表1 PAR-2mRNA的siRNA序列Table 1 siRNA sequence of targeted PAR-2 mRNA
1.4 siRNA转染角质形成细胞
转染前一天,以5×104cells/mL的密度,将细胞接种于24孔培养板中,每孔加入约500μL无抗生素的角质细胞培养液,并使转染时细胞到达70%融合。实验细胞分为3组,每组8孔,分别为空白对照组(未经转染的细胞)、阴性对照组(转染非特异性的siRNA)、实验组(转染特异性的siRNA)。先转染FAM标记的阴性对照siRNA,分别以20 nmol/L、40 nmol/L、80 nmol/L和100 nmol/L的浓度转染细胞,并在荧光显微镜下观察转染效率,以摸索最佳转染条件。按照转染试剂盒lipofectamine 2000使用说明,将化学合成的siRNA转入角质形成细胞,6 h后即可在倒置荧光显微镜下观察转染效率。
1.5 半定量RT-PCR检测PAR-2 mRNA转录水平
于转染后48 h,收集6孔板培养的细胞,按照Trizol RNA抽提试剂盒说明,提取RNA。采用RTPCR试剂盒,检测PAR-2 mRNA的表达量。应用Primer 5.0设计合适的PAR-2引物,再由上海生工生物工程有限公司合成。PAR-2引物序列为:上游引物5'-CCGAACTAAGAAGAAGCACC-3',下游引物5'-AGAAAAAGCCAATAAGCACACAT-3'。内参GAPDH引物序列为:上游引物5'-ACCACAGTCCATGCCATCAC-3',下游引物5'-TCCACCACCCTGTTGCTGTA-3'。PAR-2扩增产物为 355 bp,GAPDH扩增产物为 452 bp。PCR产物 20μL经1.5%琼脂糖凝胶、80 V电压电泳1 h(100 bp的DNA marker作为外参照),用天能凝胶分析系统拍照观察,并对PAR-2 mRNA的表达进行半定量分析,以PAR-2与GAPDH基因扩增产物电泳条带的灰度扫描比值表示目的基因的相对表达水平。
1.6 Western blot检测PAR-2的表达
于转染后48 h裂解各组细胞提取总蛋白,福林-酚法蛋白定量。以各组总蛋白为模板,GAPDH为内对照进行SDS-PAGE电泳,转膜,一抗,二抗杂交孵育,最后显色剂显色,成像系统曝光检测。以GAPDH(67 KDa)作为内参照,检测各组PAR-2蛋白(44 KDa)的相对表达量,拍照,灰度分析,计算PAR-2蛋白表达水平的相对抑制率。
1.7 统计学分析
所有数据以(均数±标准差)表示,使用SPSS 12.0软件进行方差分析和t检验。P<0.05表示差异显著,P>0.05表示无统计学差异。
2 结果
2.1 siRNA转染效率的检测
FAM荧光标记阴性对照siRNA分别以20 nmol/L、40 nmol/L、80 nmol/L和100 nmol/L的浓度转染角质形成细胞,转染后6 h各浓度组在倒置荧光显微镜下均可观察到细胞质内有点状绿色荧光出现,表明转染成功。随机计数5个视野下的细胞数量和荧光细胞数目,计算转染效率,结果显示40 nmol/L终浓度转染时效率最高,约为70%。因此,本实验选择40 nmol/L作为siRNA的转染浓度(图1)。
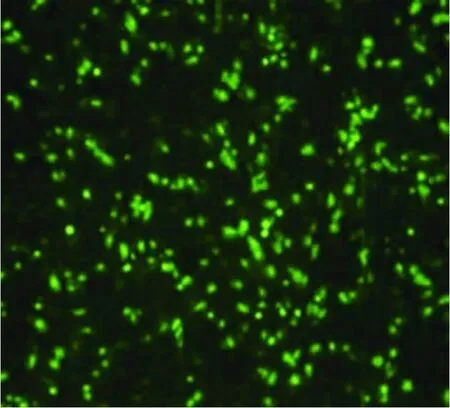
图1 阴性对照组细胞转染情况(荧光显微镜,40×)Fig.1 The transfection efficiency in control group(fluorescence microscopy,40×)
2.2 RT-PCR检测siRNA干扰后对角质形成细胞中PAR-2 mRNA表达的影响
与未转染siRNA的细胞比较,siRNA1、siRNA2和siRNA3转染靶细胞48 h后对PAR-2的mRNA的转录表达均具有抑制作用,siRNA2的作用效果最明显(P2<0.01,P1、P3均<0.05)(图 2)。
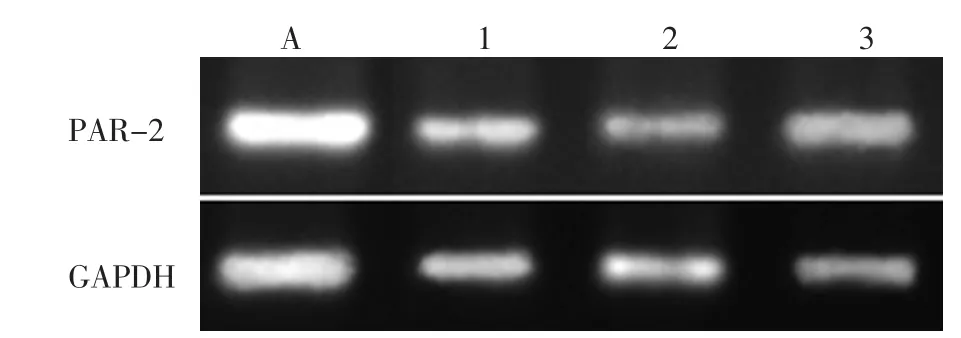
图2 各组细胞PAR-2的mRNA表达Fig.2 The mRNA expression of PAR-2 in each groups
2.3 Western blot检测siRNA干扰后对角质形成细胞中PAR-2蛋白表达的影响
与未转染siRNA的细胞比较,不同的siRNA对目的基因均具有抑制效果,其中siRNA序列2对目的基因的抑制作用最明显(P2<0.01,P1、P3均<0.05)(图3)。
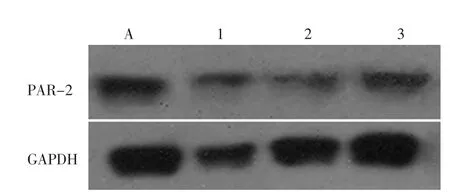
图3 各组细胞PAR-2的蛋白表达Fig.3 The expression of PAR-2 in each groups
3 讨论
人体皮肤的角质形成细胞是紫外线辐射损伤的靶点。已有研究表明,中波紫外线(UVB)可诱导HKC分泌多种细胞因子及表达某些自身抗原,进而引发一系列生物学效应[4-5]。人角质形成细胞在皮肤受到外界刺激后,参与机体的炎症和免疫反应[6-7]。炎症信号常由人角质形成细胞最先发出,并通过接受各种外界刺激,激活细胞内复杂的炎症信号传递机制,表达和分泌许多重要的炎症细胞因子,如IL-1IL-6、IL-8、IL-10、GM-CSF等,将外界刺激信号向其他免疫细胞(中性粒细胞、单核/巨噬细胞、淋巴细胞等)传递[8-9]。
PAR-2分子存在于不同系统的多种类型的细胞中,参与多种生理和病理过程,通过介导激活Rho蛋白家族的功能,完成细胞的吞噬功能。Scott等[10-11]研究发现,人角质形成细胞中偶联G蛋白的PAR-2激活后,能激活GTP结合蛋白Rho家族分子,激活的Rho通过参与细胞骨架的重塑来介导吞噬过程,从而启动角质形成细胞对黑素小体的吸收,促进黑素由MC的树突向角质形成细胞中转运。经紫外线照射后,PAR-2可表达于整个表皮层;体外培养的角质形成细胞经紫外线照射后,其PAR-2的酶切激活能力增强,从而增强色素转运。另外,在组织损伤时期,PAR-2作为损伤性因子可引发炎症反应,而皮肤炎症反应中PAR-2、胰蛋白酶和/或类胰蛋白酶表达的增加,可能会促进炎症皮肤部位的黑素转运。因此,皮肤炎症后的色素沉积与PAR-2及胰蛋白酶的表达增加有关。所以,有可能通过抑制角质形成细胞中PAR-2基因的表达,而达到减少色素沉着的目的。
Gil等发现向哺乳动物转染大于29 nt的长dsRNA时会导致细胞内发生非特异性的基因沉默。Elbashir等[12]发现转染21 nt的siRNA近似物,能够在哺乳动物细胞内产生RNAi效应,且不激活PKR途径,因而不会导致非特异性的基因沉默。所以,有研究尝试通过化学合成19~21 nt的siRNA类似物,然后再转染哺乳动物细胞的方法来实现RNAi,并取得成功。化学合成法成本高于其他方法,而且周期较长,根据不同的合成和纯化要求需4~12 d。其优点是操作简单,只需根据目的基因设计2~4条siRNA序列,然后进行合成,合成的siRNA可直接转染靶细胞。与核酶及反义RNA相比,siRNA抑制效率更高、特异性更好;与载体siRNA相比,化学合成siRNA纯度高,更具实用性及开发前景。然而,化学合成的siRNA也有着自身的缺点,即只能产生短暂(通常1~2周)的效应,并且对靶mRNA的特定序列有着很强的选择偏向性,需要多次实验才能筛选出有较强作用的siRNA。
RNA干扰的靶位识别是一个有着高度序列特异性的过程,同一mRNA内不同部位核苷酸组成的siRNA会产生不同的基因沉默效应,siRNA的有效性高度依赖于靶点位置[13-14]。Holen等[14]的实验所设计的siRNA只有部分能有效抑制基因表达,不同靶点的抑制效果不同。即便仅1个核苷酸的改变,实验过程中都有可能检测不到靶基因的RNA干扰现象。Yoshinari等[15]的研究也发现,即使siRNA的序列起始位置只错后1或2个碱基,其抑制效果也大大降低。因此,在RNA干扰实验中,siRNA序列的选择极其重要。我们用Ambion公司在线设计软件确定针对人角质形成细胞中PAR-2基因的特异靶序列,设计选取了3条siRNA。本研究证实选取合适的siRNA序列可以有效地抑制角质形成细胞中PAR-2基因的表达,为后续应用RNAi技术研究黑色素传输机制以及如何减少色素沉着奠定了实验基础。
[1]Seiberg M,Paine C,Sharlow E,et al.The protease-activated receptor 2 regulates pigmentation via keratinocyte-melanocyte interactions[J].Exp Cell Res,2000,254(1):25-32.
[2]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[3]Brantl S.Antisense-RNA regulation and RNA interference[J].Biochem Biophys Acta,2002,1575(1-3):15-25.
[4]Yarosh D,Both D,Kibitel J,et al.Regulation of TNF α production and release in human and mouse skin after UVB irradiation[J].Photodermatol Photoimmunol Photomed,2000,16(6):263-270.
[5]Grewe M,Gyufko K,Krutmann J.Interleukin-10 production by cultured human keratinocytes:regulation by ultraviolet B and ultraviolet A1 radiation[J].Invest Dermatol,1995,104(1):3-6.
[6]Kondo S.The roles of keratinocyte-derived cytokines in the epidermis and their possible responses to UVA-irradiation[J].Invest Dermatol Symp Proc,1999,4(2):177-183.
[7]Clingen PH,Berneburg M,Petit-Frere C,et al.Contrastiong effects of an ultraviolet B and A tanning lamp on Interleukin 6,tumour necrosis factor-alpha and intercellular adhesion molecu-lar-1 expression[J].Br J Dermatol,2001,145(1):54-62.
[8]Kondo S.The roles of cytokines in photoaging[J].Dermatol Sci,2000,23(1):S30-S36.
[9]Park KC,Jung HC,Hwang JH,et al.GM-CSF production by epithelial cell line:upregulation by ultraviolet A[J].Photodermatol Photoimmunol Photomed,1997,13(4):133-138.
[10]Scott G,Leopardi S,Parker L,et al.The proteinase-activated receptor-2 mediates phagocytosis in a Rho-dependent manner in human keratinocytes[J].J Invest Dermatol,2003,121(3):529-541.
[11]Scott G,Deng A,Rodriguez-Burford C,et al.Protease activated receptor2,a receptor involved in melanosome transfer,is up regulated in human skin by ultraviolet irradiation[J].J Invest Dermatol,2001,117(6):1412-1420.
[12]Elbashir SM,Harborth J,Lendeckel W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,411(6836):494-498.
[13]Elbashir SM,Harborth J,Weber K,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199-213.
[14]Holen T,Amaizguioui M,Weiger MT,et al.Positional effects of short interfering RNA targeting the human coagulation trigger tissue factor[J].Nucleic Acids Res,2002,30(8):1757-1766.
[15]Yoshinari K,Miyagishi M,Taira K,et al.Effects on RNAi of the tight structure,sequence and position of the targeted region[J].Nucleic Acids Res,2004,32(2):691-699.

