颅缝早闭症相关实验荧光定量PCR内参基因的选择研究
杨娴娴 Jodie T Hatfield Susan J Hinze 穆雄铮 Peter J Anderson Barry C Powell
实时荧光定量PCR(RT-qPCR)作为检测基因 表达谱的高通量、高精度的方法,在生物学研究中已得到广泛应用。采用稳定的内参基因对反应进行标准化,可以增加该方法的敏感度、可重复性和动态范围,理想的内参基因在所研究的组织、细胞和实验条件下均恒定表达。管家基因是维持细胞最低限度功能必不可少的基因,在所有类型细胞中都表达,是广泛应用的内参基因,如β-actin(肌动蛋白)、GAPDH(甘油醛-3-磷酸脱氢酶)、B2M(微球蛋白)及18S RNA等[1]。然而,很多研究表明,管家基因在不同组织、细胞以及不同条件下,表达量并非永远恒定,甚至差别很大,至今尚未发现在所有条件下均恒定表达的管家基因[2-4]。因此,对特定基因表达研究中候选管家基因的表达稳定性进行评价,筛选出最为稳定的管家基因作为内参,对于保证研究结果的真实可靠至关重要。目前已有不少相关的统计分析软件,如 geNorm、Norm Finder、Bestkeeper等用于内参基因的筛选[2,5-6]。
目前,在颅骨成骨与颅缝闭合过程中基因表达的研究方面,RT-qPCR分析并未根据所研究组织细胞的种类或不同的实验条件而选择合适的内参基因,多数仍简单采用β-actin或GAPDH作为内参。
本实验选择与颅骨成骨、颅缝闭合相关的常用的3组实验标本,分别为:Fgfr2cC342Y/+小鼠颅缝组织、颅缝早闭患者体外培养颅缝原代细胞和体外培养的小鼠Kusa 4b 10成骨细胞株,以常用的候选管家基因作为研究对象,利用geNorm软件对RT-qPCR结果进行分析,以筛选出在不同组织细胞中表达最为稳定的管家基因作为内参。
1 材料与方法
1.1 主要试剂与仪器
RNase ZAP、DEPC、 青链霉素、Alizarin Red S、Tris(Sigma-Aldrich 公司,美国);Trizol、SuperScriptTMⅢ逆转录试剂盒、FBS、α-MEM 培养液、10 mM dNTPs(Invitrogen 公司,美国);10× PCR Buffer、25 mM MgCl2、AmpliTaqGold DNA polymerase(Applied Biosystems公司,美国);KAPA SYBR FAST qPCR 试剂盒 (Kapa Biosystems公司,美国);geNormTM Housekeeping Gene Selection试剂盒(Primer Design公司,英国);其余试剂均为分析纯。
GeneAmp PCR System 9700基因扩增仪(PE Applied Biosystems公司, 美国);Rotor-Gene 6000 Real-Time PCR 仪(Corbett Reserach,Qiagen公司,德国);高速台式离心机5415D(Eppendorf公司,德国);G:BOX凝胶成像分析仪(Syngene公司,英国);NanoVue超微量分光光度计(GE公司,美国);解剖显微镜(Motic公司,香港);倒置相差显微镜(Leica公司,德国)。
1.2 实验动物与细胞
Fgfr2cC342Y/+雄性小鼠 (美国华盛顿大学Chad Perlyn教授惠赠),Swiss雌性小鼠(购自阿德莱德妇女儿童医院动物实验中心)。
颅缝原代细胞取材来源于7名接受经颅径路颅缝早闭症手术的患者,预先均按照规定签署实验研究知情同意书。
Kusa 4b 10细胞株为小鼠骨髓基质来源的成骨前体细胞[7](澳大利亚St.Vincent医学研究所惠赠)。
1.3 方法
1.3.1 标本取材与分组
1.3.1.1 Fgfr2cC342Y/+小鼠颅缝组织
Fgfr2cC342Y/+雄性小鼠与Swiss雌性小鼠配种繁殖。子代中将出现野生型(WT,+/+)或杂合子(Het,+/-)2种基因型。提取鼠尾组织抽提基因组DNA进行基因型鉴定,并进行鼠耳标记。孕鼠经剖宫获取胎鼠,切取实验用颅缝组织后,提取鼠尾组织进行基因型鉴定。按“QIAGEN全血和组织DNA抽提试剂盒”进行操作,PCR扩增突变基因外显子,引物序列为Forward:5'-CAAGCAAGCTCAACAG GAGAG-3'和 Reverse:5'-GCTGTGCTGCTGAGAGTTTTG-3'。 PCR 产物琼脂糖凝胶电泳分析,根据野生型出现224 bp条带,杂合子出现290 bp突变等位基因条带,确定基因型。
选择胚胎第16.5天、18.5天以及出生后第0、1、5、10天的Fgfr2cC342Y/+小鼠,分别切取冠状缝、后额缝、矢状缝、人字缝复合组织和颅顶骨(颅缝复合组织包括颅缝间质、成骨缘及其下硬脑膜,切取颅缝时尽可能留小于1 mm成骨缘),分管标记置于5 mL EP管中,-80℃保存。选择不同天数、不同基因型、不同个体来源、不同颅缝来源的组织标本共18个(表1)。
1.3.1.2 颅缝早闭症患者体外培养颅缝原代细胞
患者基因型分析检验是否存在FGFR1-3和Twist基因突变[8]。颅缝组织经胶原酶消化、组织块体外培养收集原代细胞[9]。选择不同颅缝来源、正常或早闭颅缝、不同传代数的细胞标本进行geNorm研究(表 2)。
1.3.1.3 体外培养小鼠Kusa 4b 10成骨细胞株
细胞置于T75培养瓶,含10%热灭活的FBS和100 IU/mL青、链霉素的α-MEM培养液,37℃恒温混合气体(5%CO2、95%O2)环境中培养,视细胞生长情况,每隔2~3 d换液一次。镜下观察,约80%生长融合时,细胞传代。
成骨诱导,当细胞数为5000(传代第20代)时,移至3板24孔培养皿,次日加入成骨诱导液(α-MEM,15%FBS,10 mM β-磷酸甘油,50 μg/mL抗坏血酸,100 IU/mL青、链霉素)培养,3 d换液一次,诱导培养21 d,收集细胞进行茜素红(Alizarin Red S)钙结节染色:细胞经70%乙醇固定后,加入0.1%Alizarin Red S溶液染色10min,水洗,室温下干燥,染色后细胞加入乙酸∶甲醇(1∶1)脱染色 30min,提取的染料由分光光度仪A450定量分析。分别收集诱导(诱导后 3 d、7 d、14 d和 21 d)与非诱导细胞(培养 0 d、3 d、7 d、14 d 和 21 d)进行 geNorm 分析。
1.3.2 RNA抽提与逆转录
颅缝组织与细胞标本按Trizol法抽提总RNA,加入糖原充分混匀共沉淀,应用20μL DEPC蒸馏水55℃促溶10min获得RNA标本;胚胎颅缝标本极小,将相同基因型、2只小鼠的同一颅缝来源标本置于同一EP管中进行抽提以增加RNA产量。A260/A280、1%琼脂糖凝胶电泳进行RNA纯度及浓度测定。
分别取500 ng Fgfr2cC342Y/+小鼠颅缝组织RNA、250 ng人颅缝细胞RNA和1 μg Kusa 4b 10细胞RNA,采用SuperScriptTMⅢFirst-Strand Synthesis System试剂盒20μL体系进行逆转录反应。
Fgfr2cC342Y/+小鼠颅缝组织cDNA经不含RNase/DNase的高压水1∶3比例稀释,人颅缝细胞cDNA 1∶4稀释,Kusa 4b 10细胞cDNA 1∶10稀释。所有反应均设定相应No-RT阴性对照(即逆转录反应中,由高压水替代SuperscriptⅢ逆转录酶)。
1.3.3 geNorm分析
针对不同的标本类型,设计三组单独的geNorm分析实验,分别采用小鼠或人geNormTM Housekeeping Gene Selection试剂盒(提供候选内参基因PCR扩增引物)。RT-qPCR反应采用KAPA SYBR FAST qPCR Kit试剂盒,10μL qPCR 反应体系包含5μL 2× Kapa Master Mix,0.5μL 基因特异性 20×引物,1.43μL cDNA 和 3.07μL 高压水。 在 Rotor-Gene 6000 Real-time PCR仪上进行PCR反应,反应程序按①95℃ 3min,②95℃ 3 sec,③60℃ 25 sec,回到步骤②,共40个循环。
每一个RNA标本均设3复孔,每一板PCR反应均设定空白对照(NTCs),反应结束后通过熔解曲线分析、凝胶电泳以及测序等鉴定产物的特异性。采用geNorm V3.5软件进行候选管家基因稳定性分析[2]。通过该软件计算出每个管家基因的表达稳定值M,以及每个管家基因的表达相对于其他每一个待测管家基因表达的变异平均值V。M值越小,代表基因表达越稳定,M<0.5视为稳定内参基因的典型阈值[10];V确定用作校准的最佳管家基因数目,软件建议V<0.15为选择阈值[2]。
1.3.4 目的基因表达水平与所选内参基因的相关性研究
Fgfr2cC342Y/+小鼠颅缝组织实验中,选择出生后第0、1、5、10天的野生型和突变型小鼠各6只,分别取材获得冠状缝标本共48个,进行RT-qPCR实验,检测成骨标志骨钙素(OC)和碱性磷酸酶(ALP)的表达水平。OC,Forward:5'-ACCTCACAGATGCCAA GCC-3',Reverse:5'-ATCTGGGCTGGGGACTGAG-3';ALP,Forward:5’-GGGACGAATCTCAGGGTACA-3',Reverse:5'-AGTAACTGGGGTCTCTCTCTTT-3’。PCR反应前行目的基因扩增效率检测,即标准曲线建立,扩增效率应满足100%±5%要求。分别选择geNorm分析所得的针对本类标本①单个最稳定管家基因,②最稳定基因组合以及③最不稳定基因进行结果分析,采用qBasePLUS软件[10],可同时选多个内参基因,并考虑每一反应的扩增效率进行结果校对。
2 结果
2.1 候选管家基因选择
geNormTM Housekeeping Gene Selection试剂盒针对小鼠或人不同种类,各提供12个管家基因作为候选内参。两种试剂盒中所含候选基因基本一致,仅小鼠试剂盒中Canx和Ubc基因(表3),在人试剂盒中替换为SF3A1和TOP1基因(表4)。
本实验选择与颅骨成骨、颅缝闭合相关的常用3组实验标本,分别为:①Crouzon综合征Fgfr2cC342Y/+小鼠颅缝组织;②颅缝早闭症患者体外培养颅缝原代细胞;③小鼠Kusa 4b 10成骨细胞株。经体外成骨诱导培养21 d,茜素红钙结节染色验证细胞是否存在成骨矿化。结果显示,细胞在诱导培养2周后(14 d、21 d),与非诱导培养细胞或第0天细胞相比,矿化显著增加,P<0.05(图 1)。
2.2 RNA与qPCR质量控制
检测实验标本RNA纯度与浓度(表5)。严格选择凝胶电泳中含清晰18S与28S核糖体两条条带的RNA标本进行RT-qPCR反应,PCR扩增效率均在100%±5%范围内。通过熔解曲线分析、凝胶电泳以及测序等鉴定产物的特异性。此外,通过阈值设定对每一标本的3个副孔原始Ct值进行挑选,排除SD>0.1标本组;排除>10%基因组DNA污染的no-RT标本。
2.3 geNorm程序分析结果
从http://medgen.ugent.be/~jvdesomp/genorm网站下载geNorm程序,对各个管家基因的表达稳定性进行统计学分析,从而选择最合适的内参。根据3组实验标本进行geNorm分析。
结果显示,Fgfr2cC342Y/+小鼠颅缝组织,Cyc1-Gapdh-Canx为最佳组合,在分析数据时,推荐选取这3个管家基因Ct值的几何平均值作为内参来对目的基因表达进行校正;颅缝早闭症患者体外培养颅缝原代细胞,18S rRNA和ATP5B为最佳组合;体外培养的小鼠Kusa 4b 10成骨细胞株,18S rRNA和Canx为最佳组合(图2、表6)。
2.4 选择不同内参基因对目的基因RT-qPCR的结果影响显著
骨钙素(OC)由分化晚期的成骨细胞分泌,作为成熟成骨细胞的功能标志物[11];碱性磷酸酶(ALP)为成骨细胞分化的早期标志[12]。在Fgfr2cC342Y/+小鼠颅缝组织实验中,随颅骨发育、颅缝闭合,二者表达水平逐渐增加[13-14]。geNorm 分析结果显示:Cyc1 或 Gapdh为最稳定管家基因,18S rRNA为最不稳定基因,Cyc1-Gapdh-Canx为软件推荐的最稳定基因组合。

表1 Fgfr2cC342Y/+小鼠颅缝组织geNorm分析标本Table 1 RNA sample list of geNorm assay of mouse suture tissues
表2 颅缝早闭患者体外培养颅缝原代细胞geNorm分析标本Table 2 RNA sample list of geNorm assay of human suture cells

表3 geNorm分析试剂盒候选管家基因(鼠)Table 3 geNormTM housekeeping gene selection kit candidates(Mouse)
分别选择①Cyc1、②18S rRNA、③Cyc1-Gapdh-Canx组合作为内参基因,对目的基因PCR结果进行校对,分析出生后第0、1、5、10天OC和ALP的表达趋势(图3)。当选择Cyc1或Cyc1-Gapdh-Canx组合作为内参时,OC的表达趋势基本一致(图3a、b);相反,以18S rRNA进行校对时,出生后第5天和第10天的OC表达水平与前二者相比约下降1/2(图3c)。选择单个最稳定基因或组合时,出生后第10天的OC表达水平显著增加,为出生后第0天的30倍,若选择最不稳定基因,则表达水平仅增加达10倍,反映出最不稳定基因对结果统计的显著影响(图3g)。ALP表达水平表现出相似的影响趋势(图3d-f、h):当选择 3 基因组合时,出生后第 0、1、10 天,突变型较野生型ALP表达显著增加。当选择18S rRNA,ALP突变型与野生型仅出生后第0天存在显著差异;选择Cyc1,则二者无差异。

表4 geNorm分析试剂盒候选管家基因(人)Table 4 geNormTM housekeeping gene selection kit candidates(Human)
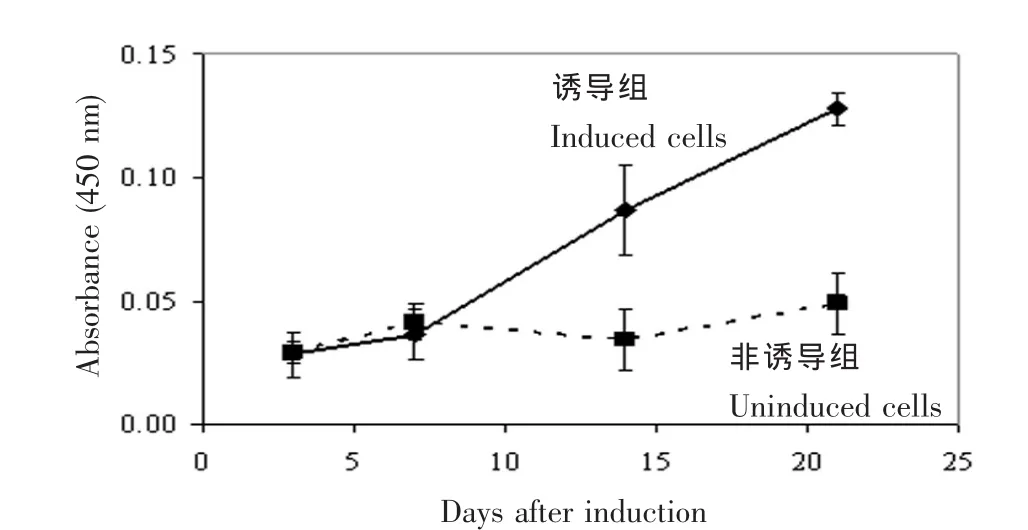
图1 Kusa 4b 10细胞茜素红矿化染色检测Fig.1 Induction of mineralization in Kusa 4b 10 cells
表5 RNA质量与产量Table 5 RNA quality and quantity
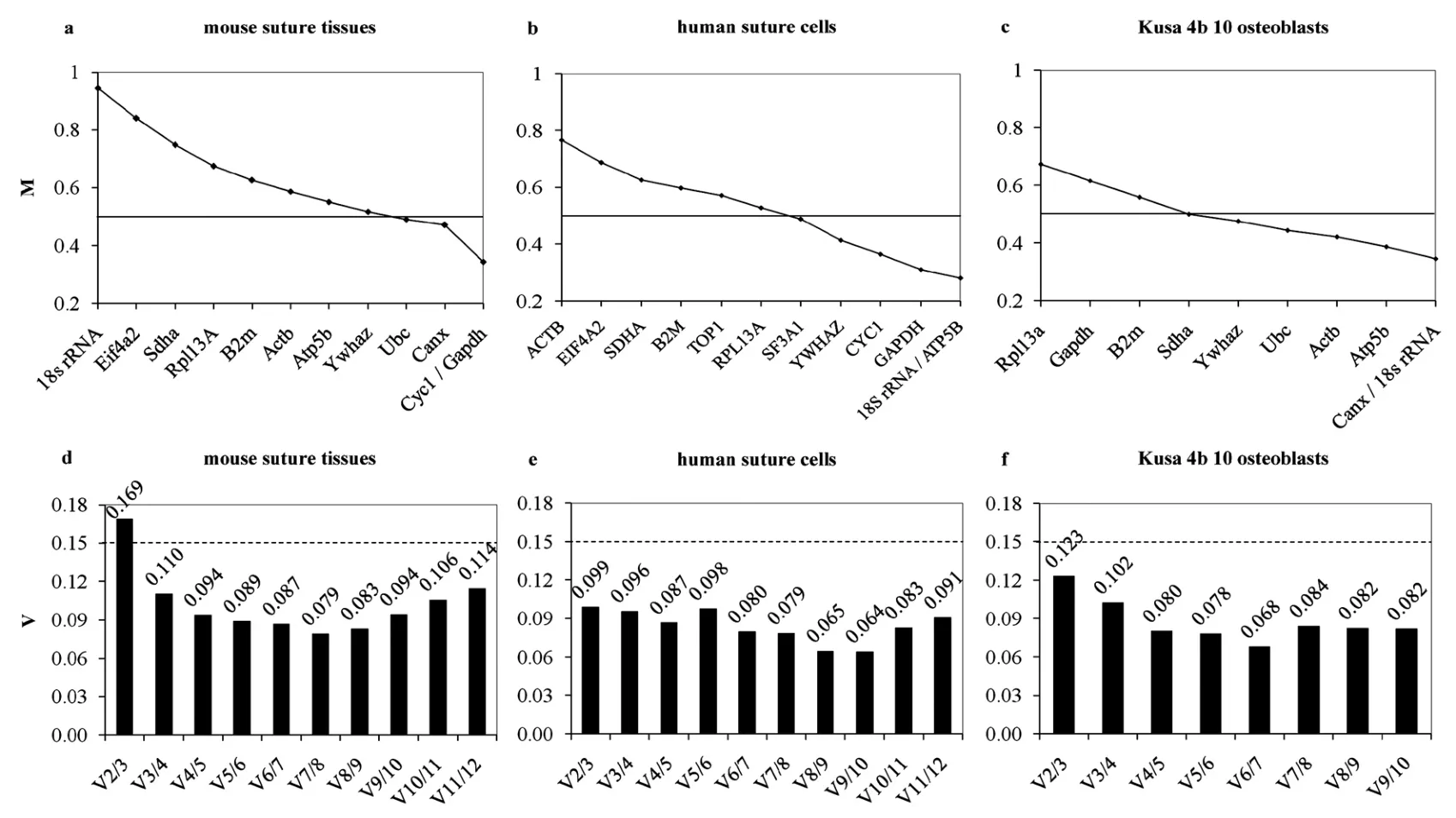
图2 颅缝早闭症相关实验管家基因稳定性geNorm分析Fig.2 Housekeeping gene stability in craniosynostosis-related mouse suture tissues and human suture cells and Kusa 4b 10 osteoblasts using geNorm analysis
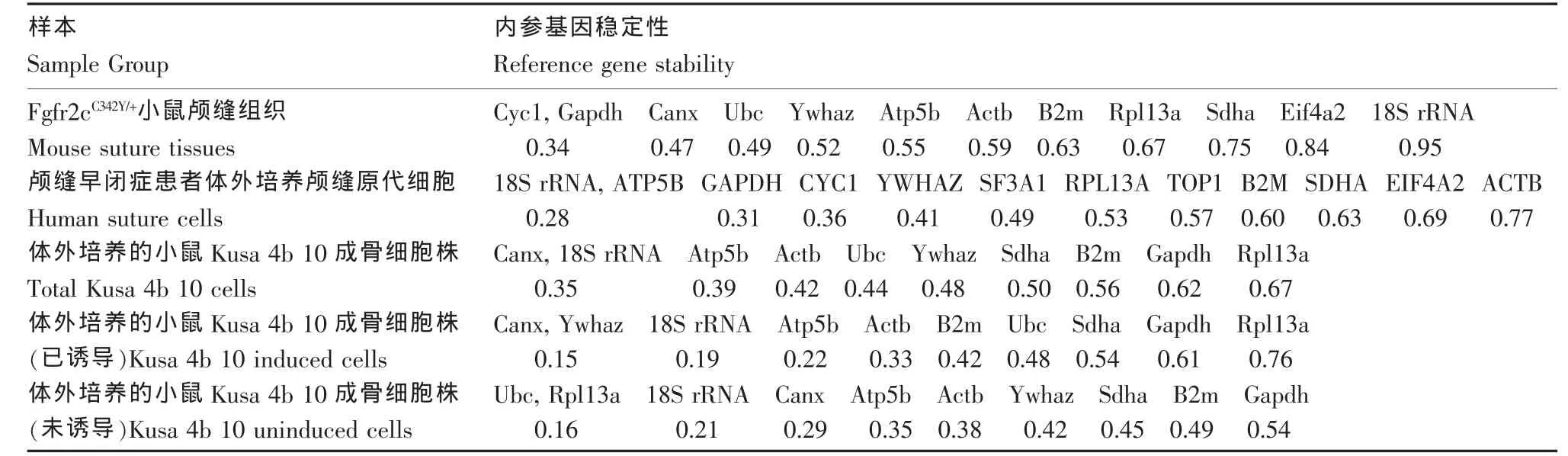
表7 geNorm分析总结Table 7 Summary of geNorm results
3 讨论
实时定量荧光PCR研究中内参基因的选择是一个极其重要的环节,内参基因选择是否恰当将对分析结果带来很大的影响。证据表明,若在任何情况下都不加选择地使用单一的内参基因,将会给实验带来很大的误差。Vandesompele等[2]研究认为,单独使用一个内参基因在25%的样品中导致了3倍的表达误差,在10%的样品中误差甚至达到6.4倍。因此,在利用定量PCR进行基因表达分析之前,首先要根据特定的实验材料和实验条件选择合适的管家基因作为内参基因,用于筛选最适管家基因的软件相继推出,如 geNorm、Norm Finder和 BestKeeper等[6,15]。
geNorm是一款用来从多个管家基因中选择最适合特定实验材料和反应条件内参基因的统计学分析软件,该软件能够计算出每个管家基因的表达稳定值M,以及每个管家基因的表达相对于其他每一个待测管家基因表达的变异平均值V。M值越低,管家基因的表达越稳定。在有些情况下,由于实验条件及实验材料复杂,可能无法找出非常稳定表达的单个管家基因,或因对表达定量的精确度要求很高,或因在检测一些表达量变化不太显著的目的基因时,使用单个管家基因不能符合实验的要求,此时需要利用多个管家基因来共同作为内参基因进行校正,以尽量减少校正过程中的误差。同时使用2个或2个以上稳定表达的管家基因,来对目的基因的表达进行校正,已成为定量PCR研究中的一个新的准则[10]。各管家基因的配对变异度V值可以指导内参基因的数目选择,Vandesompele等[2]建议,当配对变异度V<0.15时,则无需加入更多的管家基因来进行校正,如V2/3<0.15,表明只需选择2个内参基因作标准化指标。
在颅缝早闭症基因表达的定量研究中,目前尚未选择内参基因,多数随机选取传统ACTB、GAPDH或18S rRNA作为内参。本研究选取了3组代表性标本,分别选择不同种属geNorm试剂盒来筛选合适的内参基因。实验组RNA取材应尽量涵盖各种不同类型的标本,使选择出的内参基因更为符合实际实验设计需求。例如:小鼠颅缝组织标本选择,包括不同类型颅缝、颅缝发育不同时期和不同基因型(野生型或突变型)标本;人颅缝细胞标本选择包括来源于不同畸形患者的不同类型颅缝、不同传代数细胞;Kusa 4b 10细胞株标本选择包括体外诱导与非诱导成骨两种条件下、不同诱导天数的培养细胞。
本实验中Biogazelle公司开发的qbasePLUS分析软件[10]基于传统2-ΔΔCt原理,结合geNorm分析可设定多个管家基因,软件自动将管家基因的几何平均值作为内参对目的基因进行校对,同时结合每一次PCR反应的扩增效率,获得目的基因的最终相对定量,节省了计算时间,分析结果也更为精确。
有趣的是,虽然实验选取的3组代表性标本均与颅缝相关,但是每一个单独geNorm分析所列出的内参基因稳定性列表却完全不同,而且不同标本GAPDH、ACTB和18S rRNA在稳定性列表中的排名存在较大的差异。上述结果提示,在设计RT-qPCR实验之前,应针对所选择的标本类型与种类,进行管家基因稳定性分析。其他学科的PCR研究也验证了这一观点,即未经过筛选的管家基因用于结果校对,缺乏可信度,将使实验存在较大误差[16-18]。
[1]Bustin SA.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].J Mol Endocrinol,2000,25(2):169-193.
[2]Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3(7):RESEARCH0034.
[3]Radonic A,Thulke S,Mackay IM,et al.Guideline to reference gene selection for quantitative real-time PCR[J].Biochem Biophys Res Commun,2004,313(4):856-862.
[4]Czechowski T,Stitt M,Altmann T,et al.Genome-wide identification and testing of superior reference genes for transcript normalization in Arabidopsis[J].Plant Physiol,2005,139(1):5-17.
[5]Andersen CL,Jensen JL,Trntoft TF.Normalization of real-time quantitative reverse transcription-PCR data:a model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cancer Res,2004,64(15):5245-5250.
[6]Pfaffl MW,Tichopad A,Prgomet C,et al.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper--Excel-based tool using pair-wise correlations[J].Biotechnol Lett,2004,26(6):509-515.
[7]Allan EH,Ho PW,Umezawa A,et al.Differentiation potential of a mouse bone marrow stromal cell line[J].J Cell Biochem,2003,90(1):158-169.
[8]Anderson PJ,Cox TC,Roscioli T,et al.Somatic FGFR and TWIST mutations are not a common cause of isolated nonsyndromic single suture craniosynostosis[J].J Craniofac Surg,2007,18(2):312-314.
[9]Coussens AK,Hughes IP,Wilkinson CR,et al.Identification of genes differentially expressed by prematurely fused human sutures using a novel in vivo-in vitro approach[J].Differentiation,2008,76(5):531-545.
[10]Hellemans J,Mortier G,De Paepe A,et al.qBase relative quantification framework and software for management and automated analysis of real-time quantitative PCR data[J].Genome Biol,2007,8(2):R19.
[11]Yousfi M,Lasmoles F,Lomri A,et al.Increased bone formation and decreased osteocalcin expression induced by reduced Twist dosage in Saethre-Chotzen syndrome[J].J Clin Invest,2001,107(9):1153-1161.
[12]Braga V,Gatti D,Rossini M,et al.Bone turnover markers in patients with osteogenesis imperfecta[J].Bone,2004,34(6):1013-1016.
[13]De Pollack C,Renier D,Hott M,et al.Increased bone formation and osteoblastic cell phenotype in premature cranial suture ossification(craniosynostosis)[J].J Bone Miner Res,1996,11(3):401-407.
[14]Eswarakumar VP,Horowitz MC,Locklin R,et al.A gain-offunction mutation of Fgfr2c demonstrates the roles of this receptor variant in osteogenesis[J].Proc Natl Acad Sci USA,2004,101(34):12555-12560.
[15]Strby LA,Andersen SN,Bukholm IR,et al.Evaluation of suitable reference genes for normalization of real-time reverse transcription PCR analysis in colon cancer[J].J Exp Clin Cancer Res,29:144.
[16]Jacob TR,Laia ML,Ferro JA,et al.Selection and validation of reference genes for gene expression studies by reverse transcription quantitative PCR in Xanthomonas citri subsp.citri during infection of Citrus sinensis[J].Biotechnol Lett,2011,33(6):1177-1184.
[17]Piek CJ,Brinkhof B,Rothuizen J,et al.Leukocyte count affects expression of reference genes in canine whole blood samples[J].BMC Res Notes,2011,4:36.
[18]Martínez-Beamonte R,Navarro MA,Larraga A,et al.Selection of reference genes for gene expression studies in rats[J].J Biotechnol,2011,151(4):325-334.

