绿僵菌发酵液灭杀粘虫活性的研究
柳 东,高丙利,朱 振,李兴林
(1. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2. 中国科学院上海生命科学研究院湖州现代农业生物技术产业创新中心,湖州 313000);3. 浙江东奇生物科技有限公司,湖州 313000)
传统化学农药具有高残留、易产生抗药性、不易分解等特点,给人类、社会、环境等带来了严重危害.生物农药将成为解决这些问题的主要途径之一,其开发和应用的前景已逐步受到重视.
自从 l879年梅契尼柯夫最先从奥地利金龟子上分离到金龟子绿僵菌以来,该菌已有100多年的研究历史.绿僵菌是一类重要的生防真菌,可寄生于多种昆虫,在生产中已得到广泛的应用.据不完全统计,全世界约有 200多种昆虫能被这种真菌感染致死[1],该菌致病力强、效果好,对人、畜和农作物无毒害,是当前世界上研究应用最多的虫生真菌之一.但另一方面,同细菌、病毒杀虫剂相似,金龟子绿僵菌也存在杀虫效果慢、受环境影响较大和效果不稳定等缺点,因而在一定程度上限制了真菌杀虫剂的大规模应用.
Kodaira[2]在1961年首次报道从绿僵菌中发现毒素 A、B.其后,一些结构类似物被陆续发现,但主要毒素还是DtxA、DtxB与DtxE,占培养物滤液毒素总量的 70%以上[3-5].Wang Chengshu等[6]证明绿僵菌发酵液中毒素 DtxA、DtxB与 DtxE的含量与发酵液中碳氮比有关,各种毒素之间的含量也呈现出不同的相关性.本实验通过对本实验室保藏的 4株绿僵菌进行杀虫效果的测试,发现其中1株在发酵液除去菌丝和孢子后仍具有较高的杀粘虫活性.本文对此株菌株的发酵液进行室内毒力测试和高效液相色谱(HPLC)分析,为进一步开发应用该菌株及其代谢产物提供了实验依据.
1 材料与方法
1.1 材料
1.1.1 菌种
绿僵菌(Metarhizium anisopliae),由中国科学院上海植物生理生态研究所提供,中国科学院上海生命科学研究院湖州现代农业生物技术产业创新中心保藏.
1.1.2 供试虫源
东方粘虫(Mythimna separata),由浙江化工研究院有限公司提供,实验室内用玉米叶连续饲养和传代,饲养室温为(25±1)℃,空气湿度为70%~80%.
1.1.3 培养基(g/L)
培养基Ⅰ:蛋白胨 30,K2HPO41,MgSO40.5,KCl 0.5,FeSO40.01,pH 6.7,121,℃灭菌 20,min.
培养基Ⅱ:蛋白胨 30,K2HPO41,MgSO40.5,KCl 0.5,FeSO40.01,β–丙氨酸 0.1,pH 6.7,121,℃灭菌 20,min.
培养基Ⅲ:蔗糖30,蛋白胨5,NaNO32,K2HPO41,MgSO40.5,KCl 0.5,FeSO40.01,pH 6.7,121,℃灭菌 20,min.
培养基Ⅳ:蔗糖30,蛋白胨5,NaNO32,K2HPO41,MgSO40.5,KCl 0.5,FeSO40.01,β–丙氨酸 0.1,pH 6.7,121,℃灭菌 20,min.
1.1.4 主要试剂
高效氯氰菊酯(有效成分含量为 4.5%),南京红太阳股份有限公司.
绿僵菌4种毒素标样,由中国科学院上海植物生理生态研究所提供.
1.2 培养方法
挑取 1环平板保存的菌种,接种于 50,mL发酵培养基中(250,mL三角瓶),24,℃、110,r/min培养7,d.
1.3 发酵滤液的制备
将初筛的菌株Ma977在24,℃、pH 6.7的条件下发酵培养 7,d后,先用垫有 9,cm定性滤纸的布氏漏斗抽滤,去除培养基和凝结的菌丝体,再将发酵滤液收集,24,℃、10,000,r/min离心 10,min,取上清液,再过 0.22,µm 的滤膜,获得不含有菌株 Ma977菌丝或孢子的发酵滤液.分别从菌株 Ma977固体平板上挑取菌丝,在显微镜下观察形态;从处理后的发酵液中吸取样品,在显微镜下检测有无菌丝或孢子存在.
1.4 室内毒力测定
采用“浸叶法”[7]测定微生物发酵液对粘虫的胃毒活性.根据初筛和复筛的不同要求,将经过处理的发酵液配成一系列的浓度工作液,用于浸渍苗期玉米叶;每次浸渍 1片,3~5,s,每药样浸渍 9片,待药液干后,放入直径 10,cm 垫有滤纸的培养皿中,接入 3龄幼虫 10头;阳性对照用高效氯氰菊酯溶液浸渍的玉米叶饲喂幼虫,阴性对照用蒸馏水浸渍的玉米叶饲喂幼虫.在96,h检查结果,以粘虫幼虫绝对死亡为计算标准,即触之不动者为死亡.初筛重复 3次,复筛重复 30次.同时设有阳性对照(高效氯氰菊酯溶液)、阴性对照(蒸馏水).

1.5 HPLC分析
HPLC 分析条件:色谱分离柱为 Agilent C18(5,µm,150,mm×4.6,mm),流动相为 V乙腈﹕V水=60﹕40,流量 1.0,mL/min,柱温 30,℃,进样量 10,µL,检测波长214,nm.
标准曲线的制作:见参考文献[8].
样品处理:取 1.0,mL发酵液 10,000,r/min离心5,min,取上清液,然后用 0.22,µm 微孔滤膜过滤,所得滤液取5,µL直接进样测定.
2 结果与分析
2.1 发酵液灭杀粘虫活性的初步筛选
以实验室饲养的东方粘虫为靶标,进行室内毒力测定.96,h后,“浸叶法”的测定结果表明,其中 1株绿僵菌的发酵液对粘虫致死率为 100%,而其余 3株绿僵菌的发酵液对粘虫的致死率为0%.
培养 96,h后的虫体形态如图所示,图 1(a)为阳性对照的结果,试虫死亡(48,h内),虫体干瘪;图1(b)为发酵原液的结果,试虫死亡(96,h内),卷曲;图1(c)为阴性对照的结果,试虫存活,个体肥大.

图1 3种处理的粘虫形态Fig.1 Three kinds of the armyworm pattern tested
2.2 发酵滤液的分析
为进一步验证此株绿僵菌对粘虫的致死效果,从发酵滤液、稀释倍数、样本数量等因素开展复筛实验.分别在显微镜下观察绿僵菌Ma977和其发酵滤液.菌株Ma977孢子和菌丝的镜检结果如图2所示.

图2 菌株Ma977孢子和菌丝Fig.2 Spores and mycelium of Ma977
图2(a)为平板上培养的菌株Ma977直接制片在显微镜下观察到的孢子形态,其大小一般为(4~6)μm×(2~3)μm;图 2(b)为菌株 Ma977的菌丝形态.处理后的发酵液滤液在显微镜下观察,发现所制备的发酵液滤液不含有菌丝和孢子.
2.3 发酵滤液室内毒力测试
制备菌株 Ma977发酵滤液的 1、2、4、8倍的稀释液,设阳性对照和阴性对照,每个样品设有 30个重复.
按照上述浓度梯度的工作液,挑选大小一致的 3龄幼虫进行室内毒力测定,以高效氯氰菊酯溶液为阳性对照,蒸馏水为阴性对照,结果见表1.
在96,h后,阳性对照和阴性对照对粘虫的致死率分别为 100%和 0.67%.发酵滤液原液对粘虫的致死率为100%,稀释2倍后对粘虫的致死率为85.9%,表明该菌株除去菌丝和孢子的高浓度发酵滤液对粘虫具有明显的杀虫效果,其发酵滤液原液的杀虫效果与阳性对照一致;发酵滤液稀释4倍后,对粘虫的致死率降至10%以下,杀虫效果明显下降,表明发酵滤液有效成分的浓度与灭杀粘虫的效果有显著的相关性.

表1 不同稀释浓度的发酵滤液对粘虫的致死效果Tab.1 Lethal effect of different dilutions from the filtrate of the fermentation broth on Armyworm
2.4 发酵滤液杀虫活性成分分析
依据毒素 DtxE、DtxA、DtxB2和 DtxB的相关报道[6],在 190~1,000,nm 范围对其标样进行全波长扫描,结果表明,在214,nm处,这4种毒素均有较高的吸收峰.因此,HPLC分析发酵液滤液毒素成分将选用214,nm为其扫描波长.
标准品的 HPLC 分析表明,在 4.082、8.111、11.857、17.178,min处出现相应峰值(图 3(a)),它们分别是毒素 DtxE、DtxA、DtxB2和 DtxB.Ma977菌株发酵滤液中的 HPLC结果见图 3(b).同标准样相比,毒素DtxE、DtxA、DtxB2和DtxB均有出现,其峰的保留时间稍有降低,分别为3.987、7.842、11.423和16.484,min,与标准品的保留时间基本一致.由此表明,绿僵菌 Ma977的发酵液中存在毒素 DtxE、DtxA、DtxB2和DtxB.
经过多次摇瓶发酵,将滤液测试分析后,发现毒素 B2的产生非常不稳定,其有无和含量的高低对粘虫的致死没有影响,产生作用效果的主要是毒素DtxE、DtxA、DtxB.

图3 4种毒素标准品和发酵液的高效液相色谱图Fig.3 HPLC results of 4 toxin standard samples and the filtrate of fermentation broth
2.5 菌株Ma977发酵条件的优化
2.5.1 发酵时间对毒素产生的影响
培养时间与菌株 Ma977毒素的产生有着直接的关系.随着接入培养基中孢子的萌发、菌丝的正常生长,毒素也随着时间而逐渐产生与积累.
为了进一步确定最佳发酵时间,进行了时间对毒素产生的影响实验.等体积接种孢子悬液于 50,mL发酵培养基Ⅰ中(250,mL三角瓶),于 24,℃、110,r/min振荡培养,每天取样进行HPLC分析,其结果如图4所示.

图4 发酵时间对毒素产生的影响Fig.4 Effect of fermentation time on toxin production
由图 4可知,发酵的前 5,d,毒素 DtxE、DtxA、DtxB均没有产生,到第7天时,三种毒素的含量达到最大,所以发酵时间定7,d比较合适.
2.5.2 温度对发酵液中毒素含量的影响
菌株Ma977的最适生长温度在24~26,℃之间,为了进一步确定最佳发酵温度,进行了温度对毒素产生的影响实验.在 21、24、27、30,℃时用培养基Ⅰ,110,r/min振荡培养7,d,考察温度对菌株Ma977产毒素的影响,其HPLC分析结果如图5所示.

图5 发酵温度对毒素产生的影响Fig.5 Effect of fermentation temperature on toxin production
由图 5可以看出,较低温度时,毒素的产生明显受到抑制,过高温度对毒素的产生也有不利影响,菌株Ma977发酵温度为27,℃时比较合适.
2.5.3 初始pH对发酵液中毒素含量的影响
为了进一步确定最佳初始 pH,进行了 pH对毒素产生的影响实验,用培养基Ⅰ,27,℃、110,r/min条件下振荡培养7,d,其结果如图6所示.
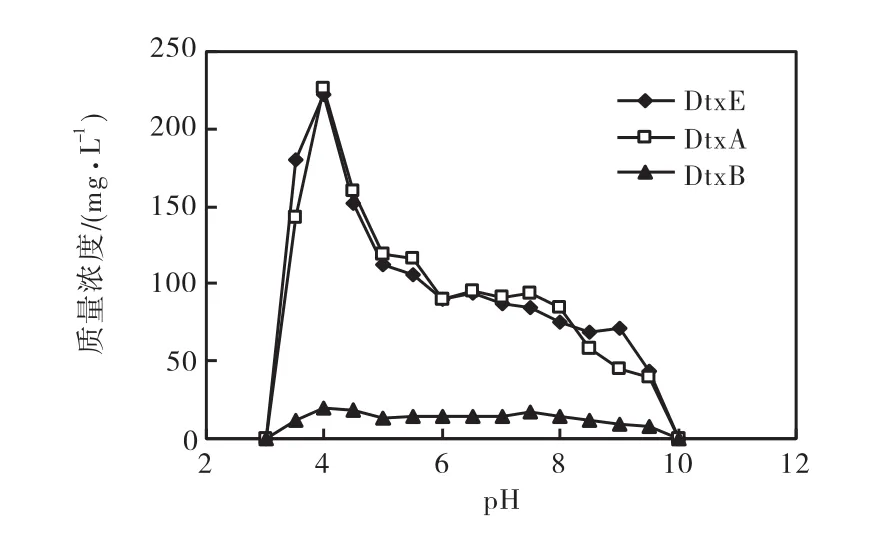
图6 初始pH对发酵液中毒素含量的影响Fig.6 Effect of initial pH value on toxin content of fermentation broth
由图6可知,当pH为3和10时,发酵7,d后,菌株Ma977没有任何毒素产生.当pH为4时,发酵液中的毒素 DtxE、DtxA、DtxB产量达到最大.总体而言,酸性条件更有利于菌株Ma977产生毒素,最适初始pH定为4.
2.5.4 培养基组分对发酵液中毒素含量的影响
发酵培养基不仅是供给菌体生长繁殖所需的能源,而且也是构成尿苷的物质来源.要积累大量的毒素,就必须要有足够的碳源和能源.β–丙氨酸是毒素合成的必需组分,且绿僵菌自身代谢不能合成,必须依靠外界摄取.在初始 pH 为 4、27,℃、110,r/min条件下,分别在 4种培养基中进行摇瓶发酵培养,7,d后HPLC分析结果如图7所示.
由图 7可知,当发酵培养基选为培养基Ⅳ时,即察氏培养基中添加β–丙氨酸,可以显著提高毒素E和A的产量,并且毒素B的含量较高.因此,发酵培养基选择培养基Ⅳ.此时,毒素DtxE、DtxA、DtxB的产量达到最大,分别为 244.08,mg/L、257.18,mg/L和38.51,mg/L.

图7 培养基组分对发酵液中毒素含量的影响Fig.7 Effect of medium components on toxin content of fermentation broth
3 讨 论
从实验室保藏的 4株绿僵菌中初步筛选出 1株具有杀粘虫活性的绿僵菌菌株 Ma977,除去其菌丝和孢子后,发酵滤液的原液对粘虫致死率可以达到100%,稀释 2倍后,仍具有较强的杀虫活性.此项结果具有重要的应用价值.
在国外,Wekesa 等[9]、Chandler 等[10]、Brooks等[11]、Kirkland等[12]进行了绿僵菌和白僵菌的实验,结果均显示绿僵菌对叶螨的防治效果较好.Pirali-Kheirabadi等[13]、Alonso-Diaz 等[14]分别进行了绿僵菌的感染实验,其对微小牛蜱(Boophilus microplus)和具环牛蜱(Rhipicephalusannulatus)的致死率均在90%以上.在国内,许多学者对绿僵菌防治常见农林害虫进行研究,李增智等[15]、宋漳等[16]、叶斌等[17]进行了绿僵菌对马尾松毛虫的感染实验,结果显示绿僵菌的一些菌株对马尾松毛虫具有毒力,且有一定的耐高温和耐旱性.陈祝安等[18]、单乐天等[19]测定了不同来源绿僵菌对稻水象甲、云斑金龟蛴螬和桃蚜的毒力,筛选出了相应的高致病力菌株.真菌杀虫剂剂型和相关应用技术伴随着虫生真菌的逐步深入研究而得到了很大的发展[20].目前,已研制出的真菌杀虫剂的剂型主要有:颗粒剂、乳悬液、混合剂、油剂、粉剂、干菌丝、可湿性粉剂、微胶囊和无纺布菌条等剂型.国内外研究开发的绿僵菌制剂约 10余种,其中,影响最大且最成功的范例是英国CABI Bioscience蝗虫生物防治国际合作项目(LUBILOSA)研制的杀蝗绿僵菌生物农药,已在非洲注册登记、投产,大面积用于沙漠蝗的防治,成为有效的蝗虫生防制剂.
借助接触传染和创伤传染两种方式,绿僵菌的孢子通过空气、桑叶等媒体附着于蚕体表面后钻入蚕体内寄生,形成绿僵病,如不及时防治传染很快,死亡率较高.因此,在中国养蚕业较为发达的长江三角洲不适合使用传统的绿僵菌产品.菌株 Ma977发酵液因不含有菌丝和孢子,对粘虫致死效果较好,可以用于养蚕地区的虫害防治,具有较好的应用开发前景.
本研究的后续工作将采用廉价的培养基原料,优化此菌株的培养基及扩大培养,以显著提高有效毒素的含量,为该菌的商业化开发提供基本参数.
[1] 刘爱英. 中国虫生真菌研究与应用[M]. 北京:中国农业科技出版社,l991:159–164.
[2] Kodaira Y. Biochemical studies on the muscardine fungi in the silkworms,Bombyx mori[J]. Faculty of Textile Science and Technology,1961,5:1–68.
[3] Loutelier C,Cherton J C,Lange C,et al. Studies on the dynamics of the production of destruxins by Metarhizium anisopliae:Direct high-performance liquid chromatographic and fast atom bombardment mass spectrometric analysis correlated with biological activity tests[J]. Journal of Chromatography A,1996,738(3):181–189.
[4] Pedras M S,Irina Z L,Ward D E. The destruxins:Synthesis,biosynthesis,biotransformation,and biological activity[J]. Phytochemistry,2002,59(6):579–596.
[5] Strasser H,Vey A,Butt T M. Are there any risks in using entomopathogenic fungi for pest control,with particular reference to the bioactive metabolites of Metarhizium,Tolypocladium and Beauveria species ? [J]. Biocontrol Science and Technology,2000,10(6):717–735.
[6] Wang Chengshu,Skrobek A,Butt T M. Investigations on the destruxin production of the entomopathogenic fungus Metarhizium anisopliae[J]. Journal of Invertebrate Pathology,2004,85(3):168–174.
[7] 张宗炳. 杀虫药剂的毒力测定[M]. 北京:科学出版社,1988:18-19.
[8] 陈立仁,蒋生祥. 高效液相色谱基础与实践[M]. 北京:科学出版社,2001:114–120.
[9] Wekesa V W,Maniania N K,Knapp M,et al. Pathogenicity of Beauveria bassiana and Metarhizium anisopliae to the tobacco spider Mite Tetranychus evansi[J]. Experimental & Applied Acarology,2005,36(1/2):41–50.
[10] Chandler D,Davidson G,Jacobson R J. Laboratory and glasshouse evaluation of entomopathogenic fengi against the two-spotted spider mite,Tetranychus urticae(Acari:Tetranychidae),on tomato,Lycopersicon esculentum[J].Biocontrol Science and Technology,2005,15(1):37–54.
[11] Brooks A,Wall R. Horizontal transmission of fungal infection by Metarhizium anisopliae in parasitic Psoroptesmites(Acari:Psoroptidae)[J]. Biological Control,2005,34(1):58–65.
[12] Kirkland B H,Cho E M,Keyhani N O. Differential susceptibility of Amblyomma maculatum and Amblyomma americanum(Acari:Ixodidea)to the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae[J]. Biological Control,2004,31(3):414–421.
[13] Pirali-Kheirabadi K,Haddadzadeh H,Razzaghi-Abyaneh M,et al. Biological control of Rhipicephalus(Boophilus)annulatus by different strains of Metarhizium anisopliae,Beauveria bassiana and Lecanicillium psalliotae fungi[J]. Parasitology Research,2007,100(6):1297–1302.
[14] Alonso-Diaz M A,Garcia L,Galindo-Velasco E,et a1.Evaluation of Metarhizium anisopliae (Hyphomycetes)for the control of Boophilus microplus(Acari:Ixodidae)on naturally infested cattle in the Mexican tropics[J].Veterinary Parasitology,2007,147(3/4):336–340.
[15] 李增智,程双龙,鲁绪祥. 绿僵菌、黄僵菌对松毛虫的室内杀虫及固体生产试验初报[J]. 安徽农学院学报,1985(2):85-90.
[16] 宋漳,景云,蔡和谦,等. 应用绿僵菌防治马尾松毛虫初探[J]. 福建林学院学报,1997,17(2):107–109.
[17] 叶斌,江英成,林文清,等. 金龟子绿僵菌对马尾松林节肢动物群落多样性的影响[J]. 福建农林大学学报,2005,34(2):239–243.
[18] 陈祝安,黄基荣. 不同来源绿僵菌对云斑金龟蛴螬致病力评价[J]. 微生物学通报,1997,24(2):81–83.
[19] 单乐天,冯明光. 不同寄主及地理来源的 16株绿僵菌对桃蚜的毒力比较[J]. 微生物学通报,2006,46(4):602–607.
[20] 王滨,樊美珍,李增智. 真菌杀虫剂剂型的研究与应用[J]. 农药快讯,2003,30(2):19-20.

