贵州绿僵菌液体培养提取物抑菌活性研究
华 梅 王 垚 肖支叶 原晓龙 虞 泓 王 娟 杨宇明 王 毅
(1. 云南省林业科学院,云南省森林植物培育与开发利用重点实验室/国家林业局云南珍稀濒特森林植物保护和繁育实验室,云南 昆明 650201;2. 云南大学中草药生物资源研究所云百草实验室,云南 昆明 650091;3. 西南林业大学材料工程学院,云南 昆明 650224)
天然产物是新药物分子和先导化合物的重要来源,目前大量天然产物已被发现,已知物屡被重复分离的现象直接制约着新药物的发展。虫生真菌[1]能产生萜类、生物碱、甾体、醌类、肽类、内酯、酚类等化合物,具有抗肿瘤、抗菌、抗疟、抗动脉粥样硬化、抗真菌、抗癌等多种生物活性[2-3]。Li等[4]从直翅目中分离出层生镰刀菌 (Fusariumproliferatum),并从其发酵培养液乙酸乙酯提取物中分离并鉴定出具有抑菌活性的聚酮类物质。杨新洲等[5]从斑蝥 (Lyttavesicatoria) 体内分离得一株具有显著抗肝癌活性的真菌菌株 (Fusariumoxysporum),表明从菌株发酵液提取物乙酸乙酯部位中分离得到的cyclo (R-Pro-S-Phe) 对2个肝癌细胞株Hep G2和SMMC-7721均有抑制作用。Lu等[6]从蜻蜓体内分离得到土曲霉 (Aspergillusterreus) QT122菌株,并从其中分离出5种具有抗真菌和免疫抑制作用的化合物。对虫生真菌次生代谢产物的研究不仅发现了更多结构新颖的化合物,也有助于具有药理活性的化合物的发掘[7-8]。
虫草无性型之一的绿僵菌 (Metarhizium),是具有潜在开发价值的昆虫病原真菌,现已开发为多种真菌杀虫剂[9-10]。通过对绿僵菌代谢产物中化学成分及活性进行研究发现,绿僵菌代谢产物中含有聚酮化合物[11]、异香豆素苷[12]、苦马豆素[13]、生物碱[14]等化学成分,具有清除自由基、提高免疫力、抑制肿瘤、抗突变、抗辐射、抗氧化等生物活性[15-18];大蝉虫草发酵液的乙酸乙酯萃取物对白色念珠菌 (Candidaalbicans) 有明显的抑制作用[19]。戴氏虫草 (Cordycepstaii) 无性型—戴氏绿僵菌 (Metarhiziumtaii) 88-601菌株菌丝体乙醚浸提液对革兰氏阳性菌,如金黄色葡萄球菌 (Staphyloccusaureus)、枯草杆菌 (Bacillussubtilis) 有明显的拮抗作用[20-21],从戴氏虫草菌丝体培养物中分离并鉴定出具有抗菌活性之一的化合物为烟曲霉酸[22-23]。
目前,对贵州绿僵菌 (Metarhiziumguizhouense) 的研究主要集中在液体深层培养分生孢子[10]和固态发酵产壳聚糖酶[24]方面,尚无对其培养物抗菌活性的研究。前期对虫草中几种绿僵菌培养物的提取物抑菌活性筛选实验中发现,贵州绿僵菌的液体培养提取物也具有一定的抑菌活性。为了进一步对贵州绿僵菌培养物抑菌活性进行深入的研究,在贵州绿僵菌抑菌活性筛选的基础上,采用OSMAC策略,研究不同碳源、氮源、接种量、不同接种时间对贵州绿僵菌菌丝体提取物抑菌活性的影响,同时对贵州绿僵菌产生的抑菌提取物的热、光及酸碱稳定性进行了测定,为寻找贵州绿僵菌中具有抑菌活性的化合物及后续大量培养和分离贵州绿僵菌抑菌化合物奠定基础。
1 材料与方法
1.1 实验材料
1.1.1供试菌株
本实验采用的致病菌有蜡样芽孢杆菌 (B1) (Bacilluscereus)、藤黄微球菌 (B2) (Micrococcusluteus)、缓慢芽孢杆菌 (B3) (Bacilluslentus)、副溶血性弧菌 (B4) (Vibrioparahaemolyticus)、溶血性葡萄球菌 (B5) (Straphylococcushaemolyticus)、铜尿假单胞菌 (B6) (Pseudomonasaeruginosa)、乙型副伤寒沙门氏菌 (B7) (Salmonellaparatyphi)、无乳链球菌 (B8) (Streptcococcusagalactiae)、短小芽孢杆菌 (B9) (Bacilluspumilus)、福氏志贺氏菌 (B10) (Shigellaflexneri)、枯草芽孢杆菌 (B11)、金黄色葡萄球菌 (B12)、大肠埃希菌 (B13) (Escherichiacoli)。
1.1.2培养基
氮源培养基 以6 g/L的葡萄糖 (G)、蔗糖 (S) 为碳源,分别以4 g/L的麦芽浸粉 (M1)、酵母粉 (Y2)、番茄浸粉 (T)、马铃薯浸粉 (P)、大豆蛋白胨 (S)、胰蛋白胨 (Y1)、牛肉浸粉 (B)、酪蛋白胨 (L)、香蕉粉 (B1)、麦芽浸粉肉汤 (M2)、大豆蛋白胨和酵母粉 (SY2) 配制成碳源相同、氮源不同的11种浓度一致液体培养基,即GSM1、 GSY2、 GST、 GSP、 GSS、 GSY1、 GSB、 GSL、 GSB1、 GSM2、 GSSY2。
碳源培养基 以6 g/L S、Y2为氮源,分别以4 g/L的甘露醇 (Man)、麦芽糖 (Mal)、山梨醇 (Sor)、蔗糖 (Suc)、乳糖 (Lac)、葡萄糖 (Glu)、肌醇 (Ino)、果糖 (Fru)、可溶性淀粉 (Sta) 配制成氮源相同、碳源不同的9种浓度一致液体培养基,即ManY2S、 MalY2S、SorY2S、SucY2S、LacY2S、GluY2S、InoY2S、FruY2S、StaY2S。
OMAM液体培养基能同时提供大豆蛋白胨和酵母2种氮源,且碳源用量较大能促进菌丝体快速增长。MY固体培养基用于活化贵州绿僵菌,以利于后续液体培养的研究。
1.2 实验方法
1.2.1贵州绿僵菌初期液体培养基的筛选
配制MY固体培养基,灭菌冷却后,在无菌条件下,钩取已经鉴定好的母种接于斜面培养基上,于25 ℃恒温暗培养,待菌丝长满斜面后用于菌丝体的液体培养。将贵州绿僵菌分别接种于100 mL OMAM、MY、PDA液体培养基中,置于28 ℃,转速为150 r/min摇床中培养10天,并分别设置不接种贵州绿僵菌的100 mL OMAM、MY、PDA液体培养基为CK。
1.2.2贵州绿僵菌液体培养物的提取
分别在贵州绿僵菌液体培养物及CK中加入100 mL乙酸乙酯,振荡混匀,于室温下超声提取1 h。将绿僵菌提取液倒入4层纱布中过滤,去除绿僵菌菌丝体。滤液在分液漏斗中混合均匀,静置过夜分液,后取上层液用旋转蒸发仪浓缩致干,称质量,加入二甲基亚砜 (DMSO) 做抗菌活性筛选。
1.2.3贵州绿僵菌培养物抑菌活性测定
13种供试细菌菌株悬浮液的制备、滤纸片法筛选绿僵菌提取物的抑菌活性及二倍稀释法对最低抑菌活性 (MIC) 测定方法参照文献 [25-26]。
1.2.4贵州绿僵菌抗菌提取物稳定性测定
用DMSO配制15份50 mg/mL贵州绿僵菌提取物溶液,用于贵州绿僵菌抑菌提取物稳定性实验。
光稳定性检测 将5份贵州绿僵菌提取物溶液分别置于紫外灯光下照射30、60、90、120、150 min,测定抑菌活性。
热稳定性检测 将5份贵州绿僵菌提取物分别在30、50、70、90、100 ℃下水浴处理30 min,测定抑菌活性。
酸碱稳定性实验 将5份贵州绿僵菌提取物的pH分别调为3、5、7、9、11,测定抑菌活性。稳定性试验均平行做3次,取平均值用于试验数据统计处理。
1.2.5不同培养条件下菌丝体提取物抑菌实验
采用OSMAC策略的方法,将贵州绿僵菌分别接种于11种不同氮源培养基和9种不同碳源培养基中,于28 ℃、150 r/min摇床中培养10天,提取培养物做活性实验,用于不同碳氮源培养基的筛选。称取1.5 g菌丝体,打碎,用10 mL灭菌蒸馏水稀释,获得菌丝体悬浊液。在100 mL OMAM培养液中分别加入300 μL、500 μL、1 mL、1.5 mL、2.0 mL菌丝体悬浊液,用于研究接种量对菌丝体提取物抗菌活性的影响。在OMAM培养基中接种贵州绿僵菌5份,分别培养5、10、15、20、25 d,用于研究培养时间对菌丝体抑菌活性的影响。将不同培养处理的培养液用乙酸乙酯等体积超声萃取3次,经旋转蒸发仪浓缩后,将每份提取物称量,分别配制成50 mg/mL的DMSO溶液,用纸片法检测其活性。
2 结果与分析
2.1 贵州绿僵菌提取物抑菌活性及最低抑制浓度
贵州绿僵菌分别经OMAM、MY、PDA液体培养基培养,培养过程中发现贵州绿僵菌在OMAM培养基中生长的最快。菌丝体培养液经乙酸乙酯超声处理后,OMAM、MY、PDA培养基中干提取物得率分别为121、85、77 mg/100 mL。将OMAM培养后得到的提取物进行抑菌试验,结果表明贵州绿僵菌粗取物能对B1、B3、B5产生抑制作用,抑菌圈直径分别为10.2、11.3、10.0 mm,可见贵州绿僵菌经OMAM液体培养后能产生具有抑菌活性的化合物。贵州绿僵菌提取物对3种细菌的最低抑制浓度分别为6.25、1.56、6.25 mg/mL,其中对B3的最低抑制浓度最低,可见贵州绿僵菌培养物中抑菌化合物对B3具有较高的敏感性。
2.2 贵州绿僵菌抗菌提取物稳定性分析
2.2.1光稳定性分析
由图1可知,光照处理后,贵州绿僵菌的提取物对3种细菌依然具有活性。随着光照时间的增加,贵州绿僵菌提取物对B1和B5的抑菌效果有所降低,但对B3的抑菌效果几乎没有影响,可见贵州绿僵菌提取物对B3较为敏感。当紫外光照时间为150 min时,3种细菌产生的抑菌圈直径依然为8.1、9.5、10.3 mm,说明贵州绿僵菌提取物几乎不受紫外灯照时间的影响,提取物光稳定性较强。
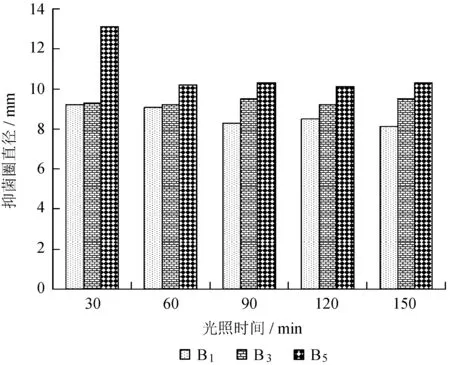
图1光照对贵州绿僵菌提取物抗菌活性的影响
Fig.1 Effcets of illumination time on antibacterial activity of extracts ofM.guizhouense
2.2.2热稳定性分析
由图2可知,随着处理温度的升高,贵州绿僵菌提取物产生的抑菌圈直径减小,抑菌活性有所降低,对B5的抑菌效果几乎没有影响;当处理温度为100 ℃时,抑菌圈直径依然在7 mm以上,表明贵州绿僵菌提取物依然具有较好的抑菌活性,其抗热能力较强。

图2不同温度处理对贵州绿僵菌提取物抗菌活性的影响
Fig.2 Effcets of different temperature on antibacterial activity of extracts ofM.guizhouense
2.2.3酸碱稳定性分析
由图3可知,随着酸碱度的增加,抑菌圈直径出现不规律的上下浮动趋势,但均无明显增幅或减幅;在较高的pH下,贵州绿僵菌提取物产生的抑菌圈直径依然在7 mm以上,对3种细菌依然具有抗菌活性,表明具有一定的耐酸碱能力。
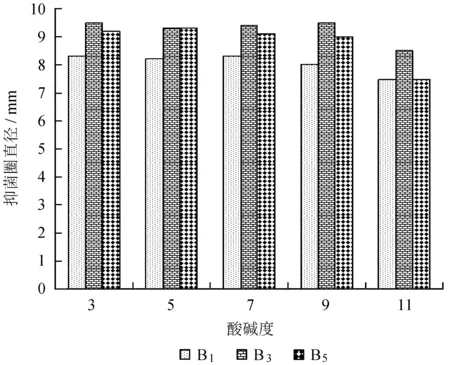
图3酸碱度对贵州绿僵菌提取物抗菌活性的影响
Fig.3 Effcets of pH on antibacterial activity of extracts ofM.guizhouense
2.3 不同氮源培养基中贵州绿僵菌提取物抑菌活性比较
不同氮源培养基培养后贵州绿僵菌提取物对B1、B3、B5抗菌结果见图4,图中数字1~11分别代表GSM1、GSY2、GST、GSP、GSS、GSY1、GSB、GSL、GSB1、GSM2、GSSY2培养基培养后提取物浸泡过的滤纸片,空白滤纸为阴性对照。从图4可以看出,阴性对照滤纸片周围长满细菌,1~11号滤纸片周围无细菌生长,形成了透明的抑菌圈,且不同培养条件下抑菌圈的大小及直径不同。可见,不同氮源培养基培养的贵州绿僵菌提取物的抑菌效果差异明显。
贵州绿僵菌提取物产生的抑菌圈直径越大,抑菌效果越好。由表1可以看出,添加不同氮源的液体培养基,经其培养后,贵州绿僵菌培养液的提取物均能对B1、B3和B53种细菌产生大小不同的抑菌圈,表明这11种氮源均能使贵州绿僵菌代谢产生抑菌化合物。在提取物浓度均为50 mg/mL时,不同氮源培养的提取物对同种细菌处理所得的抑菌圈直径为9.6~16.2 mm。其中,B3抑菌圈直径为10.7~17.3 mm,B5抑菌圈直径为10.71~15.2 mm,表明不同氮源培养基培养的贵州绿僵菌提取液的抑菌能力差别明显。从抑菌圈直径大小看出,抑菌效果最好的培养基为GSP培养基,说明马铃薯能刺激贵州绿僵菌产生具有更高抑菌活性的化合物。

图4不同氮源培养基对贵州绿僵菌提取物抑菌活性的影响
Fig.4 Effcets of different nitrogen source media on antibacterial activities of extract ofM.guizhouense
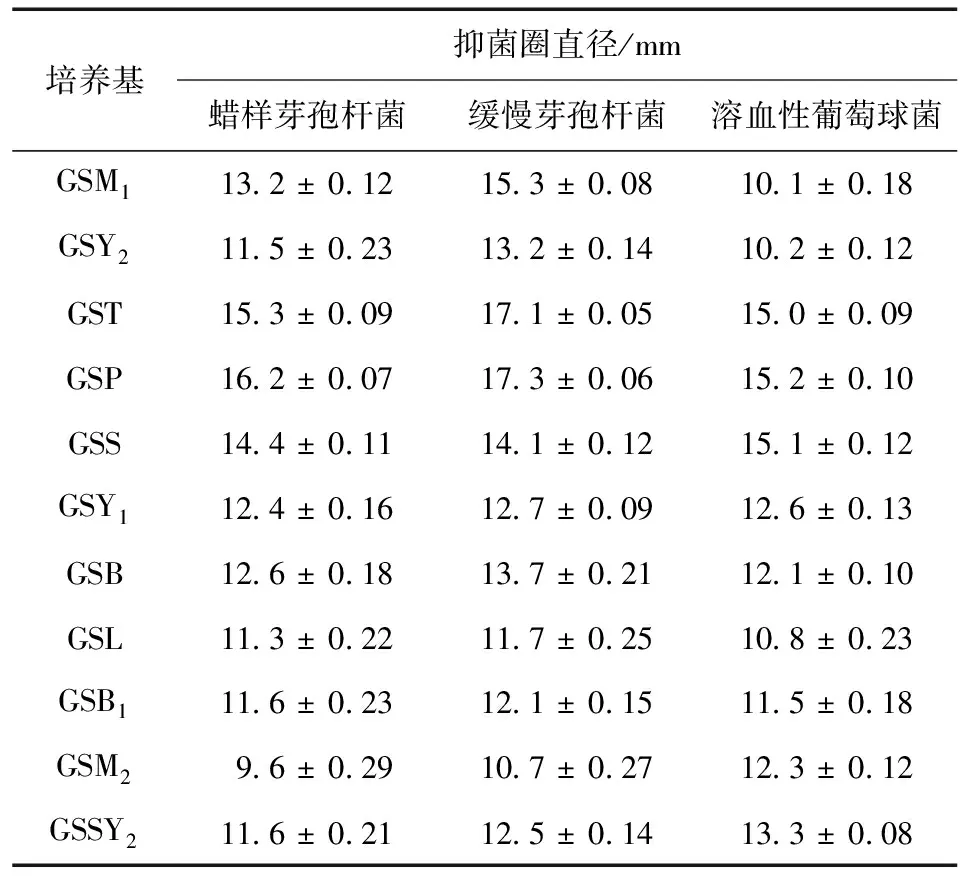
表1 不同氮源培养基对提取物抑菌活性的影响Table1 Effcets of different nitrogen sources on antibacterial activity of extracts
2.4 不同碳源培养基中贵州绿僵菌提取物抑菌活性比较
由表2可知,不同碳源培养基培养的贵州绿僵菌提取液中均能产生抗菌化合物,对B1和B3,StaY2S培养基培养的提取物具有较好的活性,而ManY2S培养基对B5具有较高刺激贵州绿僵菌产生抑菌化合物的能力。同时,碳源比氮源对培养物的影响更大,能刺激贵州绿僵菌菌丝体产生更多的代谢产物。
2.5 接种量对贵州绿僵菌提取物抑菌效果的影响
贵州绿僵菌菌丝体在生长过程中,较低接种量有利于菌丝体生长,菌丝体体积更大。接种500 μL菌丝体悬浊液,菌丝体经萃取后得到的提取物最多,为75.4 mg/100 mL。从表3可知,相同浓度的提取物下 (50 mg/mL),不同接种量对贵州绿僵菌提取物的抑菌活性影响不大。
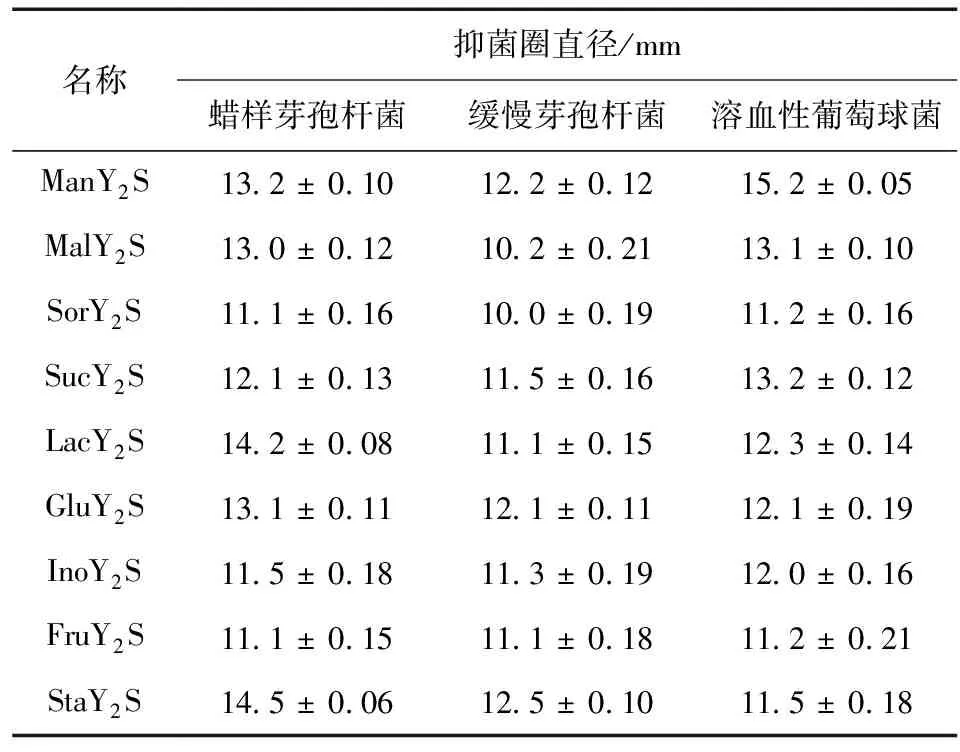
表2 不同碳源培养基对提取物抑菌活性的影响Table 2 Effcets of different carbon sources on antibacterial activity of extracts
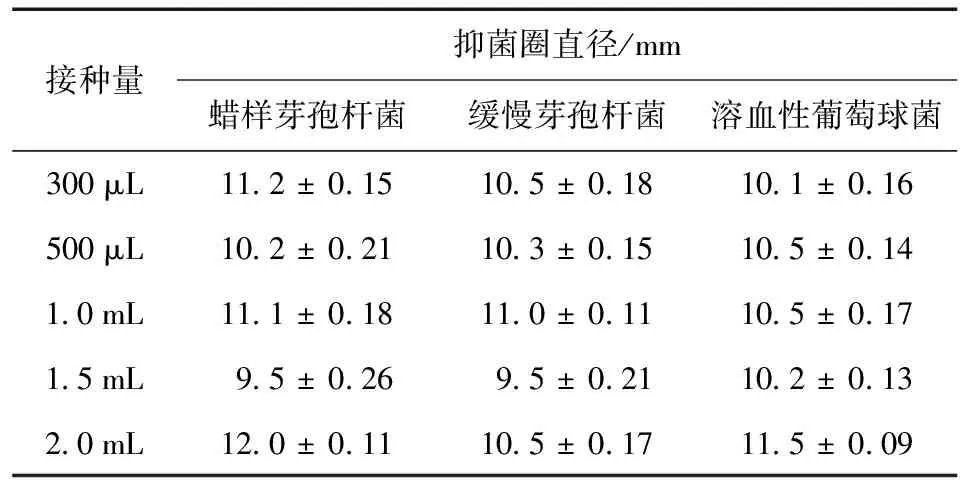
表3 不同接种量对提取物抑菌活性的影响Table 3 Effcets of different inoculation amount on antibacterial activity of extracts
2.6 培养时间对贵州绿僵菌提取物抑菌效果的影响
由表4可知,贵州绿僵菌在液体培养5 d时,就可产生抑菌化合物。随着培养时间的增加,菌丝体提取物的产量增加,到第10 d时,菌丝体提取物的量最多,为86.4 mg/mL,随后产量降低。随着培养时间的增加,菌丝体提取物抑菌活性逐渐增强。当培养25 d时,抑菌圈直径分别达到12.5、13.0、12.5 mm,抗菌效果最好。

表4 不同培养时间对提取物抑菌活性的影响Table 4 Effcets of different incubation time on antibacterial activity of extracts
3 结论与讨论
已有研究表明,绿僵菌属发酵液能对白色念珠菌、金黄色葡萄球菌、枯草杆菌、大肠杆菌、绿脓杆菌 (Pseudomonasaeruginosa)、肺炎杆菌 (Klebsiellapneumoniae)、粪肠球菌 (Enterococcusfaecalis) 产生明显的抑制作用。通过对13种常见致病细菌活性进行筛选,发现贵州绿僵菌菌丝体提取物对B1(MIC: 6.25 mg/mL)、B3(MIC: 1.56 mg/mL) 和B5(MIC: 6.25 mg/mL) 具有抑菌效果,而对B11、B13、B12等均没有活性。通过对比贵州绿僵菌与其他已有研究的绿僵菌所抗细菌种类差异,说明贵州绿僵菌培养物可能产生新的抑菌化合物。从戴氏虫草菌丝体中分离并鉴定出具有抑菌活性的化合物为烟曲霉酸[22-23],Lee等[27]也从金龟子绿僵菌中分离得到烟曲霉酸及其新型衍生物。烟曲霉酸具有抗肿瘤、抗微生物活性,是一种三萜类抗菌素[28]。烟曲霉酸对农杆菌 (Agrobaoteriumtumefaciens)、大肠杆菌、辣椒疮痂病菌 (Xanthomonasvesicatoria)、枯草芽孢杆菌、金黄色葡萄球菌、幽门螺杆菌 (Helicobacterpylori)、溶壁微球菌 (Micrococcuslysodeikticus)、铜绿假单胞菌、藤黄八叠球菌、乳酸链球菌 (Streptococcuslactis) 均具有抑制作用[29-30]。采用专用显色剂Godin试剂对贵州绿僵菌提取物进行薄层色谱检识,发现具有抑菌活性的贵州绿僵菌菌丝体提取物中有大量萜类物质,由此推断贵州绿僵菌的抑菌化合物有可能为一种新的萜类化合物。
OSMAC通过改变培养条件,培养方法和添加酶抑制剂等手段,激活微生物中沉默的生物合成基因簇,从而获得结构新颖、活性高的新化合物[31]。OSMAC策略对微生物中大量代谢途径的表达有促进作用,改变微生物发酵条件可促使其产生多种类型的化合物,在微生物次生代谢产物的研究中具有广泛的适用性[32]。采用OSMAC策略,研究不同氮源、碳源、接种量及不同接种时间对贵州绿僵菌菌丝体产生抑菌化合物及抑菌效果的影响,结果表明不同碳源和氮源对贵州绿僵菌产生的代谢产物的抑菌活性影响明显,在提取物浓度相同的情况下,抑菌效果有明显差异,说明OSMAC策略确实刺激某些基因的表达,从而获得多种具有抑菌活性的化合物。贵州绿僵菌最佳抑菌效果培养条件的研究,为后续大量培养获得抑菌提取物及其分离鉴定奠定基础。
致谢:感谢云南大学中草药生物资源研究所云百草实验室虞泓教授对试验材料贵州绿僵菌的馈赠;感谢昆明市食品药品检验所赠送的13种供试菌种。
[参考文献]
[1] 王四宝, 刘竞男, 黄勃, 等. 大别山地区虫生真菌群落结构与生态分布[J]. 菌物学报, 2004, 23(2): 195-203.
[2] 戈惠明, 谭仁祥. 共生菌: 新活性天然产物的重要来源[J]. 化学进展, 2009, 21(1): 30-46.
[3] 徐帮, 邹坤, 郭玲芝, 等. 中华剑角蝗共生真菌Penicilliumoxalicum中苯并吡喃酮二聚体类化合物的研究[J].天然产物研究与开发, 2014, 26(4): 517-520.
[4] Li S, Shao M W, Lu Y H. Phytotoxic and antibacterial metabolites fromFusariumproliferatumZS07 isolated from the gut of long-horned grasshoppers[J]. Journal of Agricultural and Food Chemistry, 2014, 62(36): 8997-9001.
[5] 杨新洲, 吕静南, 郝吉, 等. 昆虫共生真菌FusariumoxysporumBM2的代谢产物及其抗肝癌活性研究[J]. 中南民族大学学报 (自然科学版), 2016, 35(3): 42-47.
[6] Lu Y H, Jin L P, Kong L C. Phytotoxic, antifungal and immunosuppressive metabolites fromAspergillusterreusQT122 Isolated from the gut of dragonfly[J]. Current Microbiology, 2017, 74(1): 84-89.
[7] 谭周进, 肖启明, 谢丙炎, 等. 昆虫内共生菌研究概况[J]. 微生物学通报, 2005, 32(4): 140-143.
[8] 杨义婷, 郭建洋, 龙楚云, 等. 昆虫内共生菌及其功能研究进展[J]. 昆虫学报, 2014, 57(1): 111-122.
[9] 张学玲. 一株绿僵菌的生物学特性和杀虫活性的研究[D]. 泰安: 山东农业大学, 2005.
[10] 宋漳. 液体深层培养贵州绿僵菌分生孢子的研究[J]. 福建林学院学报, 1997, 17(3): 205-208.
[11] Kong X, Ma X, Xie Y. Aromatic polyketides from a sponge-derived fungusMetarhiziumanisopliaemxh-99 and their antitubercular activities[J]. Archives of Pharmacal Research, 2013, 36(6): 739-744.
[12] Tian J F, Li P J, Li X X. New antibacterial isocoumarin glycosides from a wetland soil derived fungal strainMetarhiziumanisopliae[J]. Bioorganic and Medicinal Chemistry Letters, 2016, 26(5): 1391-1396.
[13] 李锡杰. 金龟子绿僵菌菌丝体及发酵液中苦马豆素的提取与分离[D]. 杨凌: 西北农林科技大学, 2009.
[14] 孔平, 李倩, 李永娟, 等. 金龟子绿僵菌代谢产物成分预试验及其生物碱的获得[J]. 湖北农业科学, 2008, 47(2): 226-228.
[15] 胡丰林, 李增智. 虫草及相关真菌的次生代谢产物及其活性[J]. 菌物学报, 2007, 26(4): 607-632.
[16] 何亚琼, 胡丰林, 王利, 等. 虫草及其无性型中的抗肿瘤细胞活性成分[J]. 生物学杂志, 2008, 25(1): 1-4.
[17] 张晓杰. 戴氏绿僵菌抗肿瘤活性及其次生代谢产物的测定与分离纯化[D]. 遵义: 遵义医学院, 2012.
[18] 庄梦敏. 几株绿僵菌清除自由基活性物质及代谢组学的研究[D]. 合肥: 安徽农业大学, 2013.
[19] 胡凯, 程文明, 李春如. 大蝉虫草发酵液抗真菌活性成分的分离与结构鉴定[J]. 菌物学报, 2017, 36(3): 332-338.
[20] 焦彦朝, 梁宗琦. 戴氏虫草无性型的研究—Ⅰ. 抗生素[J]. 西南农业学报, 1992, 5(4): 46-48.
[21] 肖代敏, 肖建辉, 张志敏, 等. 戴氏绿僵菌抗微生物潜力的评估[J]. 中药材, 2010, 33(6): 952-957.
[22] Li X G, Pan W D, Lou H Y. New cytochalasins from medicinal macrofungusCrodycepstaiiand their inhibitory activities against human cancer cells[J]. Bioorganic and Medicinal Chemistry Letters, 2015, 25(9): 1823-1826.
[23] 李小刚, 刘振华, 刘如明, 等. HPLC测定戴氏虫草菌丝体中的活性成分烟曲霉酸[J]. 华西药学杂志, 2015, 30(5): 590-591.
[24] 杨俐, 张涛, 李晓红, 等. 固态发酵贵州绿僵菌产壳聚糖酶的亲和层析纯化及其性质研究[J]. 四川大学学报 (医学版), 2007, 38(4): 713-716.
[25] 赵能, 原晓龙, 华梅, 等. 地衣型真菌次级代谢产物抗菌活性初步研究[J]. 广西植物, 2017, 37(2): 242-247.
[26] 刘泽星, 阿依佳玛丽·依玛尔, 惠建超, 等. 陕西核桃内生真菌代谢产物抑菌活性分析[J]. 西南林业大学学报, 2017, 37(4): 126-131.
[27] Lee S Y, Kinoshita H, Ihara F, et al. Identification of novel derivative of helvolic acid from Metarhizium anisopliae grown in medium with insect component[J]. Journal of Bioscience and Bioengineering, 2008, 105(5): 476-480.
[28] Dou Y, Xiao J H, Xia X X, et al. Effect of oxygen supply on biomass and helvolic acid production in submerged fermentation ofCordycepstaii[J]. Biochemical Engineering Journal, 2013, 81: 73-79.
[29] Zhao J, Mou Y, Shan T, et al. Antimicrobial metabolites from the endophytic fungusPichiaguilliermondiiisolated fromParispolyphyllavar.yunnanensis[J]. Molecules, 2010, 15(11): 7961-7970.
[30] Zhang M, Wang W L, Fang Y C, et al. Cytotoxic alkaloids and antibiotic nordammarane triterpenoids from the marine-derived fungus Aspergillus sydowi[J]. Journal of Natural Products, 2008, 71(6): 985-989.
[31] Bode H B, Bethe B, Höfs R, et al. Big effects from small changes: possible ways to explore nature′s chemical diversity [J]. Chembiochem, 2015, 3(7): 619-627.
[32] 韦洪娟, 林贞建, 李德海, 等. 单菌多次级代谢产物方法及其在微生物代谢产物研究中的应用[J]. 微生物学报, 2010, 50(6): 701-709.

