转Al N H X 1基因大豆后代遗传稳定性及耐盐性分析
刘建凤,崔栗,安利佳
(1.河北大学生命科学学院,河北保定 071002;2.大连理工大学生命科学与技术学院,辽宁大连 116024;3.河北省植保植检站防治科,河北石家庄 050011)
转Al N H X1基因大豆后代遗传稳定性及耐盐性分析
刘建凤1,2,崔栗3,安利佳2
(1.河北大学生命科学学院,河北保定 071002;2.大连理工大学生命科学与技术学院,辽宁大连 116024;3.河北省植保植检站防治科,河北石家庄 050011)
为了获得耐盐性有所提高的转Al N H X1基因大豆后代材料,以已获得的转Al N H X1基因的6个株系中的3个株系后代为研究对象,通过分别对这3个株系转基因大豆各后代进行PCR分子检测并结合耐盐性鉴定,以分析外源基因在转基因大豆中遗传稳定性和耐盐性.结果表明:Al N H X1基因在转基因植株的后代中遗传;选取3个株系中部分阳性植株做耐盐性检测,结果表明:转基因大豆耐盐性状均好于野生型大豆.在150 mmol/L NaCl胁迫下,转基因大豆叶片中维持了相对较高的K+/Na+比值,相对含水量较野生型提高了9%,而渗透势降低了39%,表明转基因大豆具有较好的吸水和保水能力;在盐胁迫下,超氧化物歧化酶(SOD)与过氧化物酶(POD)活性较野生型大豆分别提高了45%与69%.综上,通过耐盐筛选获得的转Al N H X1基因大豆具有较强的耐盐性.
Al N HX1基因;转基因大豆;遗传稳定性;耐盐指标
目前全世界约有3.8×108hm2土地存在不同程度的盐碱化,其中我国约有0.3×108hm2[1].随着耕地盐碱化的逐渐加剧,大豆的种植将不得已利用盐碱化的土地,而大豆是双子叶作物中对盐分较敏感的作物[2].采用基因工程分子技术培育耐盐性强的大豆品种,充分利用和开发大面积的盐碱化土地,将具有广阔的应用前景.其中,Na+/H+逆向运输蛋白倍受人们关注,是植物耐盐的关键因子之一[3-4].本课题组首次从真盐生作物——獐茅(Aeluropuslittoralis)中克隆得到Na+/H+逆向运输蛋白基因(Al NHX1),GenBank登录号AY745739[5],并构建到了载体p UC-119中,采用子房滴注转化方法进行了大豆栽培品种铁丰29的遗传转化[6],已在分子水平上检测到外源Al N H X1基因成功整合到大豆基因组并在转录水平上表达,本研究以这些转基因材料为实验材料与研究基础,进一步选取其转基因后代进行了分子水平的检测与盐胁迫实验.研究转基因后代植株是否由于外源Al N H X1基因的导入而改善了大豆的耐盐能力,为今后将该耐盐基因转入其他经济作物,提高植物的抗盐碱能力,开展抗耐盐碱基因工程奠定基础.
1 材料与方法
1.1 材料
供试材料铁丰29大豆(野生型大豆)由辽宁农科院提供,以铁丰29为受体的转Al N H X1基因大豆株系为:S4来源于铁丰29-T0-4,S10来源于铁丰29-T0-10,S24来源于铁丰29-T0-24.
1.2 方法
1.2.1 PCR检测
在大豆4叶期,用CTAB法提取转基因大豆T1和T2代植株叶片的基因组DNA[5],并以80 ng基因组DNA为模板,进行转基因植株的PCR分析,检测引物是F1/R1(GCACCTTCCTTGGAGTGTTTGCT/GGTACCGTCAAGTCTTCGTTTTCTCTCA),扩增片段全长476 bp;引物F2/R2(AGAGGGTGAAGGTGATGC/CAAGAAAATCCCCAACCTCCAGTG),扩增片段全长535 bp.PCR反应条件为94℃,5 min;94℃,30 s;55℃,45 s;72℃,1 min;30个循环;72℃,10 min.10 g/L琼脂糖凝胶电泳检测扩增产物.
1.2.2 转基因大豆后代遗传性分析
当代(T0代)转基因植株自花授粉获得T1代种子,随后T1代种子继续自交获得T2代种子,分别对3个株系来源的T1代(208株)与T2代(651株)各植株进行PCR检测后,对所检测株系中阳性与阴性植株的比例与遗传学上孟德尔分离规律预期的理论值进行比较,用卡方检测研究其是否达到差异显著性.
1.2.3 植株的盐胁迫处理
在盐胁迫处理实验之前,先将未转化植株在不同盐处理浓度(50,100,150,200 mmol/L)下培养,筛选到大豆幼苗适宜的预处理浓度150 mmol/L.随后将大豆转基因植株和野生型植株,分别移栽到装有MS液体培养基塑料钵中,每个处理3钵,每钵培养3株,放置于室温,昼夜温度为26~28℃,使其恢复生长10 d.待苗恢复生长健壮时,用含150 mmol/L NaCl的盐水进行浇灌,为避免盐冲击造成不良效应,采用每天递增1/4盐浓度的处理方式,直至预定的处理浓度(150 mmol/L NaCl).2周后取样进行测定各项指标.
1.2.4 渗透势的测定
3个株系分别取同一部位叶片,在去离子水中浸泡8 h,取出,去离子水冲洗3~5遍后,用滤纸吸净叶片表面水分,放入液氮中,冷冻后将叶片组织放于医用注射器中,室温下融化,反复用力挤压注射器,获得0.5 m L汁液即可.使用FM-8P型全自动冰点渗透压计测定渗透势.
1.2.5 叶片相对含水量测定
3个株系各取3株同一部位叶片,去离子水冲洗干净,用滤纸吸干叶片表面水分,称其鲜重,然后在120℃烘箱中杀青30 min,并于80℃鼓风干燥箱烘至恒重,最后称其干重,含水量计算公式
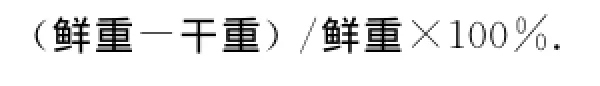
1.2.6 K+/Na+比值测定
将转基因大豆植株的叶片和根部组织放置于恒温干燥箱中,120℃杀青2 h后,80℃烘干至恒重.称取烘干后样品0.1 g置于150 m L三角瓶中,加入10 m L体积比为4∶1的浓硝酸与高氯酸混合液,处理过夜后加热消化,至溶液由棕黄色变为无色,然后冷却至室温,分别加入去离子水定溶至100 m L.空白对照为去离子水,重复3次.使用WFX-120B原子吸收分光光度计测定K+,Na+含量,并计算K+/Na+比值.
1.2.7 SOD与POD活性
叶片SOD与POD活性测定参照Prochazkova等[7]的方法.
1.2.8 统计学分析
采用Origen软件进行统计分析,统计数据以(平均数±标准差)表示.组间差异采用单因素方差分析,2组比较采用Student t-test进行分析.P<0.05表示差异显著,P<0.01表示差异极显著.
2 结果
2.1 转基因植株后代(T1与T2代)遗传分析
对3个转基因株系后代(T1与T2代)进行遗传稳定性分析.T1代PCR检测结果如图1a和表1所示,在检测的S4(60株),S10(70株)和S24(78株)转基因株系中,均检测到大量PCR阳性植株,其阳性率分别为80%,76%和77%,且各株系PCR+/PCR-比值经卡方检测符合孟德尔分离比(表1).对T2代转基因株系进行PCR检测,如图1b和表2所示,S4(239株),S10(231株)和S24(181株)T2代转基因株系中,也均检测到PCR阳性植株,其阳性率分别为76%,73%和77%,各株系PCR+/PCR-比值也均符合孟德尔分离比(表2).表明该外源基因以单插入位点整合到大豆植株的基因组中,且外源基因可以稳定遗传.
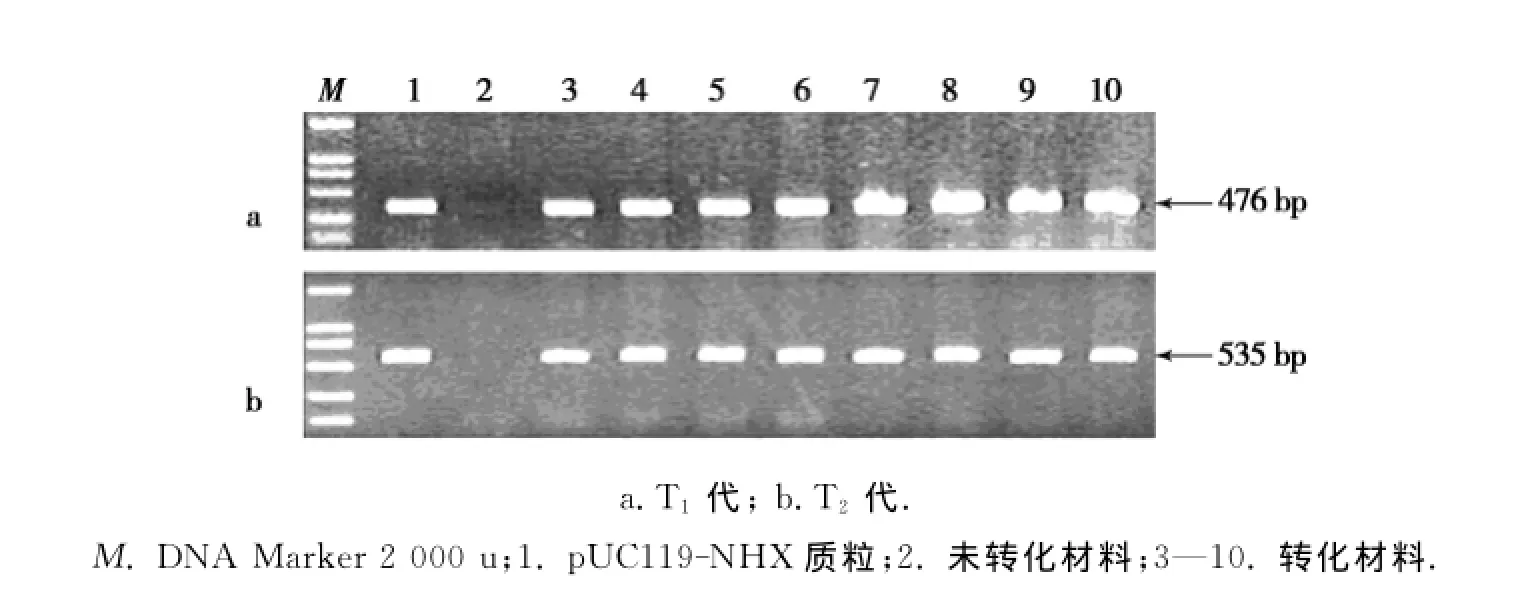
图1 PCR检测转化Al NHX1基因大豆材料结果Fig.1 PCR analysis of the presence of Al NHX1 gene of transgenic plants
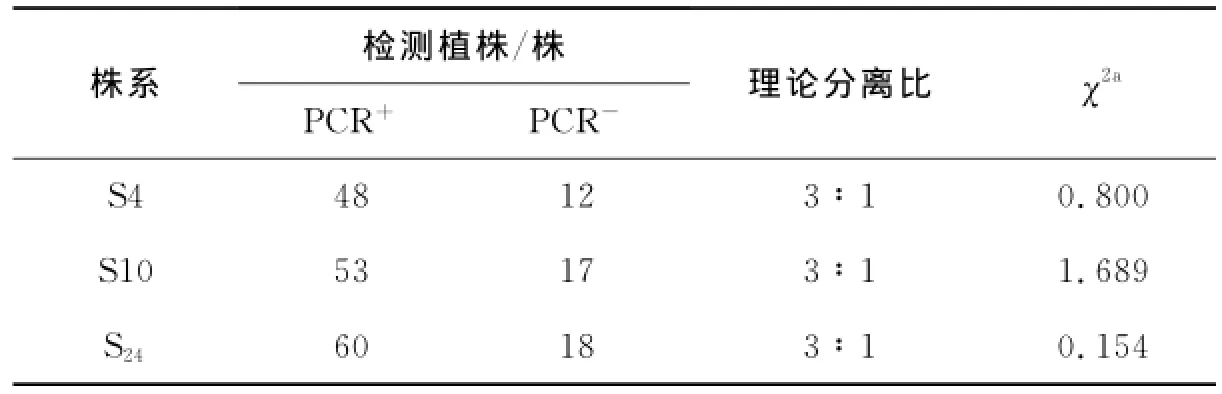
表1 T1代转基因(Al NHX1)大豆遗传分析Tab.1 Segregation of Al NHX1 in T1 generation of transgenic lines
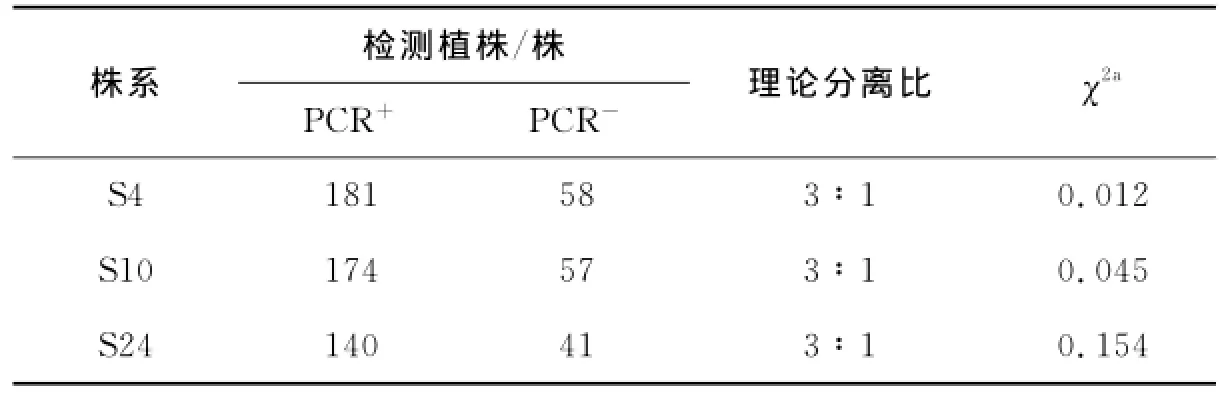
表2 T2代转基因(Al NHX1)大豆遗传分析Tab.2 Segregation of Al NHX1 in T2 generation of transgenic lines
2.2 盐胁迫对转基因大豆K+/Na+比值的影响
由图2可以看出,在150 mmol/L NaCl盐胁迫处理15 d后,野生型大豆植株长势较弱,且出现部分叶片黄化和死亡的现象,而转基因大豆植株仍然生长正常.同时在非盐条件下,转基因植株与野生型植株离子含量差异不明显,但除了S4株系外其他转基因植株的K+/Na+比值普遍略低于野生型对照,这有可能是该外源基因的表达是受盐胁迫诱导表达的结果,具体原因还有待进一步分析.而在150 mmol/L NaCl盐胁迫条件下,转基因和野生型大豆的叶片和根部K+/Na+均有降低,但转基因大豆的K+/Na+要明显高于野生型对照(图3),表明Al N H X1基因在大豆植株中表达可以提高植物细胞内的K+/Na+比值,使转基因大豆植株生长正常,表现出其耐盐性提高.
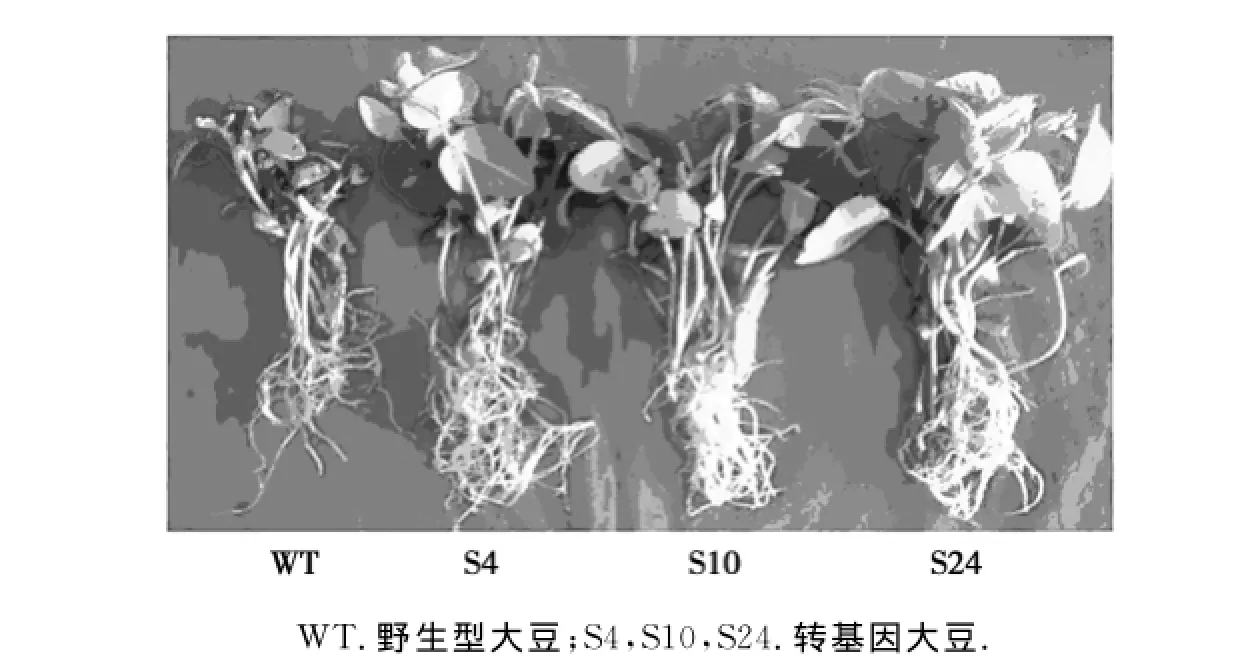
图2 盐胁迫15 d后T2代转基因大豆植株的生长表现Fig.2 Effect of NaCl stress on transgenic soybeans(T2)with salt stress for 15 d
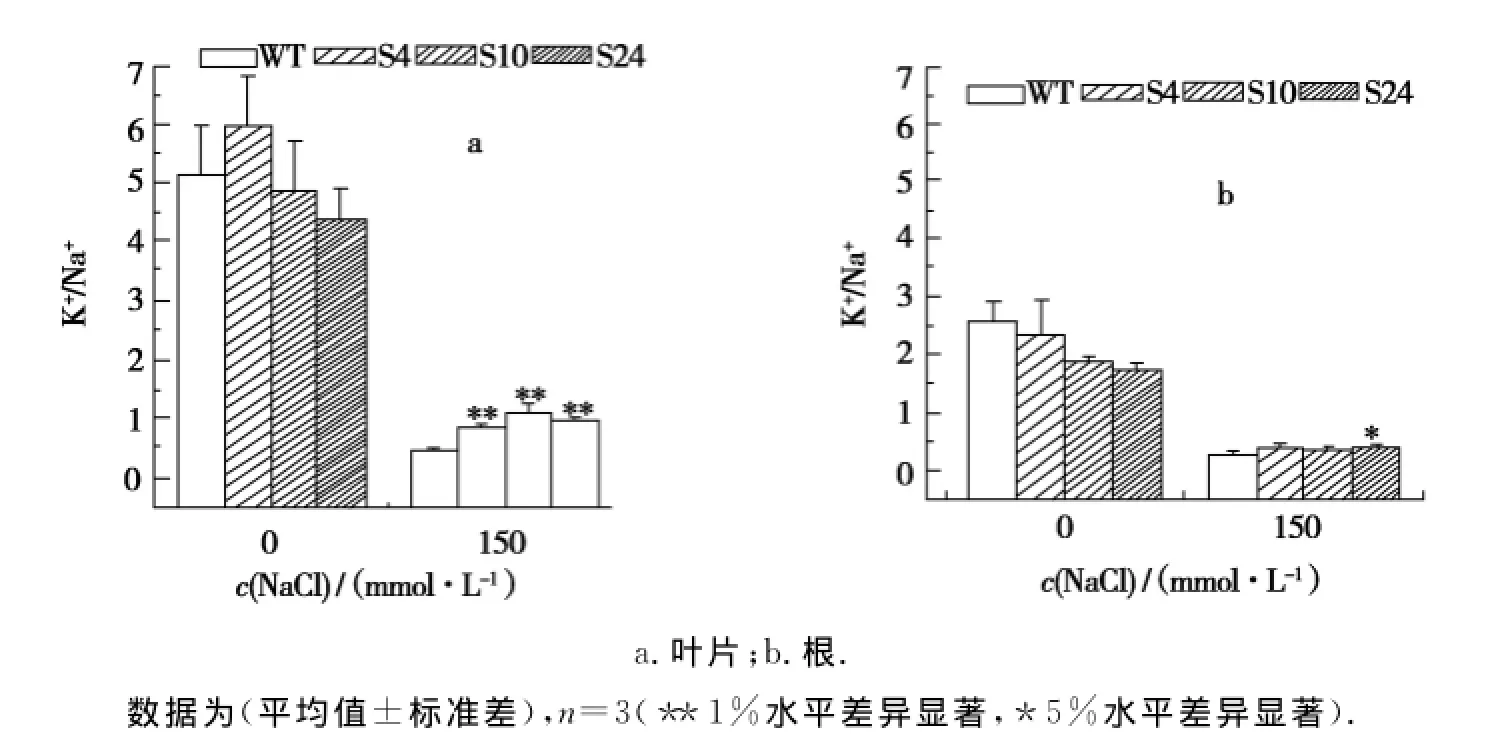
图3 盐胁迫下T2代转基因大豆中的K+/Na+Fig.3 K+/Na+in soybeans(T2 generation)under salt stress
2.3 盐胁迫对转基因大豆叶片渗透压与相对含水量的影响
如图4a所示,转基因大豆的叶片渗透压测量值高于相应盐浓度处理下的野生型对照大豆的测量值,一般转基因大豆的渗透压是野生型大豆的1.13~1.55倍.说明转基因大豆能够相对较好地吸收水分.从图4b可以看到,转基因大豆与野生型大豆叶片相对含水量之间比较,差异达到了显著或极显著水平(P<0.01,P<0.05).转基因大豆的相对含水量是野生型大豆的1.05~1.08倍,进一步表明转基因植株叶片的保水能力明显高于野生型植株,故其耐盐能力较强.正常生理条件下二者渗透压的大小以及相对含水量差别不明显.
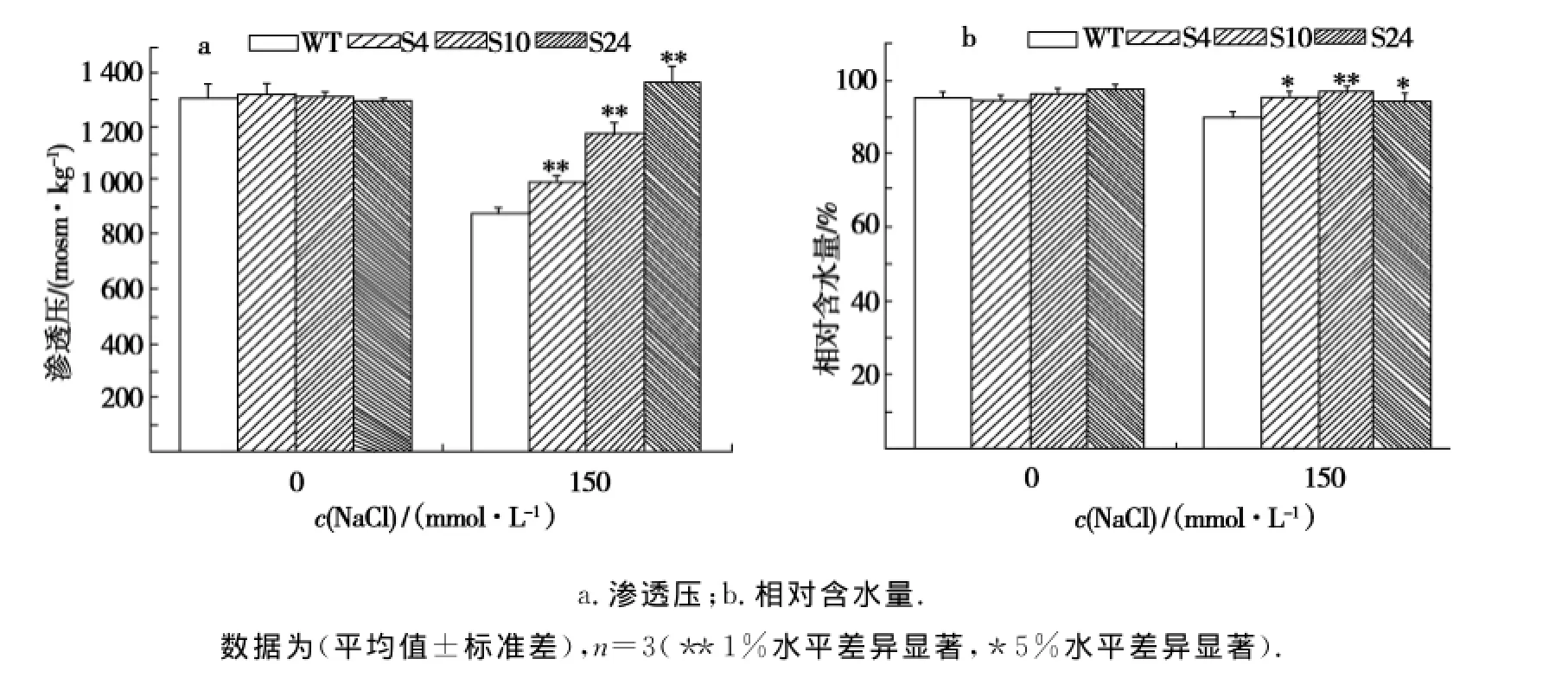
图4 盐胁迫下转Al NHX1基因(T2代)与野生型大豆渗透压与相对含水量的变化Fig.4 Osmotic potential and relative water content(RWC)in leaves of T2 of transgenic soybeans under salt stress
2.4 盐胁迫对转基因大豆POD/SOD活性的影响
如图5所示,SOD活性在无盐胁迫下野生型与转基因植株相差不大,但盐胁迫后,野生型急剧下降,而转基因植株略有下降,转基因大豆SOD活性为野生型大豆的1.34~1.45倍.结果表明,在盐胁迫条件下,转入獐茅Al N HX1基因的大豆膜受到的氧化伤害较小,在一定程度上反映了细胞抗胁迫代谢过程.与无盐处理的对照相比,盐胁迫后野生型的POD下降明显,转基因大豆POD活性为野生型大豆的1.46~1.69倍,转基因植株除S10略升高外,另2个均下降,但下降幅度小,表明在一定程度上外源Al N H X1基因在大豆中的成功表达提高了转基因植株自身清除体内超氧离子的能力.
3 讨论
液泡膜Na+/H+逆向转运蛋白基因(NHX)在改良植物耐盐性方面具有重要作用,且已越来越受到人们的广泛关注.前人的研究表明,转化外源Na+/H+逆向转运蛋白基因能够明显地改善植物的耐盐性[8-12].但是,研究表明,不同植物来源的基因和转化目的不同的植物,对转基因植物的耐盐性也有明显的影响.1999年Apse等[13]首次将拟南芥液泡膜Na+/H+逆向转运蛋白基因(At N HX1)遗传转化到拟南芥中并在植株中过量表达,获得的转基因拟南芥植株在200 mmol/L NaCl盐胁迫条件下生长不受任何影响,植株生长正常.Zhang和Blumwald[10]在番茄中也成功表达了At N H X1基因,且发现转基因番茄可以在200 mmol/L NaCl条件下正常生长,同时叶片中Na+含量高,但番茄果实中含量却很低.继而,Ragopal等[11]人在油菜(Brassianapus)中过量表达了At NHX1基因,发现转基因油菜植株体内的含盐量占到了其植株干重的6%左右,但在高盐(200 mmol/L NaCl)胁迫下对转基因植株的生长仅造成了轻微影响,且作物产量和品质均没有受到盐渍土壤的影响.将双子叶盐生植物滨藜(Atriplexgmelini)的液泡膜Na+/H+逆向转运蛋白基因Ag N H X1在水稻中高效表达,发现转基因水稻可以在300 mmol/L NaCl处理3 d后仍然存活,而野生型对照植株死亡[8].在本研究中,通过大豆子房滴注转化法将耐盐Al N HX1基因成功整合到大豆基因组中并表达,各株系后代植株经PCR检测分析表明,外源Al NHX1基因可以按着孟德尔遗传方式稳定遗传.转基因大豆耐盐性生理指标检测表明在150 mmol/L盐胁迫处理15 d后,转基因大豆植株的生长状况明显好于野生型对照大豆植株,此结果表明,外源Al N HX1基因是一个非常有效的耐盐基因,大大改善了转基因大豆植株的耐盐性,为培育耐盐性强的大豆品种提供了重要的种质资源.
细胞内维持较高的K+/Na+对于植物进行正常的生命活动具有重要作用.因此,限制Na+从根部向地上部的转运是植物在高盐胁迫下维持植物叶片细胞最佳离子状态的有效途径之一[14].在本研究中,通过对150 mmol/L NaCl盐胁迫处理2周的转基因大豆植株叶片和根部的K+/Na+含量的测定可以看出转基因大豆的叶片内K+/Na+高于野生型对照大豆植株.在转水稻Os N HX1基因的转基因黑麦草和转拟南芥At-N H X1基因的转基因小麦中,其植株叶片内K+/Na+比值明显高于野生型对照植株[12,15],此结果与本课题组的实验结果基本类似.另外,Saqib等[16]研究指出耐盐小麦品种表现了较高的液泡膜Na+/H+转运蛋白基因表达量,且其植株由根部向地上部运输的Na+含量也明显高于盐敏感基因型小麦.由于耐盐植物獐茅具有发达的根系,推测獐茅中的液泡膜Na+/H+逆向转运蛋白可能是通过根部细胞的液泡来进行盐离子区隔的,从而使易于受伤害的植株叶片减少Na+的毒害作用.渗透压与叶片含水量的多少,在一定程度上反映了植株的生长状况.在相同盐浓度处理条件下,转基因大豆的叶片含水量与渗透压较野生型大豆有明显提高.且SOD与POD活性也均有明显提高.这些实验结果与Yamaguchi等[17]的研究结果一致.本实验结果进一步表明,通过转单一的Na+/H+逆向运输蛋白基因可以明显提高植物的耐盐性,也说明了利用基因工程的分子育种手段改善植物的耐盐性,是有效的耐盐育种基因工程策略.
[1]MAAS E V,HOFFMAN G J.Crop salt tolerance current assessment[J].J Irrig and Drain Div ASCE,1977,103:115-134.
[2]LAUNCHLI A.Salt exclusion:an adaptation of legumes for crops and pastures under saline conditions[M]//STAPLES R C,TOENIESSEN G H.Salinity tolerance in plants,strategies for crop improvement.Wiley,New York:[s.n.],1984:171-187.
[3]陈观平,王慧中,施农农,等.Na+/H+逆向转运蛋白与植物耐盐性关系研究进展[J].中国生物工程杂志,2006,26(5):101-106.
CHEN Guanping,WANG Huizhong,SHI Nongnong,et al.Na+/H+antiporter and its relationship with plant salt tolerance[J].China Biotechnology,2006,26(5):101-106.
[4]BLUMWAL E.Sodium transport and salt tolerance in plants[J].Cell Biology,2000,12:431-434.
[5]ZHANG Gaohua,SU Qiao,AN Lijia,et al.Characterization and expression of a vacuolar Na+/H+antiporter gene from the monocot halophyteAeluropuslittoralis[J].Plant Physiology and Biochemistry,2008,46:117-126.
[6]LIU Jianfeng,SU Qiao,AN Lijia,et al.Transfer of a minimal linear marker-free and vector-free smGFP cassette into soybean via ovary-drip transformation[J].Biotechnol Lett,2009,31(2):295-303.
[7]PROCH AZKOVA R K D,SAIRAM G C.SRIVASTAVA D V.Single oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science,2001,161:765-771
[8]WANG Zining,ZHANG Jinsong,GUO Beihua.Cloning and characterization of the Na+/H+antiport genes fromTriticumaestivum[J].Acta Botanica Sincia,2002,44(10):1203-1208.
[9]OHTA M,H AYASHI Y,NAKASHIMA A.Introduction of a Na+/H+antiporter gene from the halophyteAtriplex gmeliniconfers salt tolerance to rice[J].FEBS Lett,2002,532:279-282.
[10]ZH ANG H X,BLUMWALD E.Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit[J].Nat Biotech,2001,19:765-768.
[11]RAJAGOPAL D,AGARWAL P,TYAGI W.Pennisetum glaucum Na+/H+antiporter confers high level of salinity tolerance in transgenicBrassicajuncea[J].Mol Breeding,2007,19(2):137-151.
[12]ZH AN H X,HODSON J N,WILLIAMS J P.Engineering salt-tolerantBrassicaplants:characterization of yield and seed oil quality in transgenic plants with increased vacuolar sodium accumulation[J].Proc Natl Acad Sci USA,2001,98:12832-12836.
[13]XUE Zheyong,ZHI Daying,XUE Gongping.Enhanced salt tolerance of transgenic wheat(TriticumaestivumL.)expressing a vacuolar Na+/H+antiporter gene with improved grain yield in saline soils in the field and a reduced level of leaf Na+[J].Plant Sci,2004,167:849-859.
[14]VISWANATHAN C,ANDRE J,ZHU J K.Understanding and improving salt tolerance in plants[J].Crop Sci,2005,45:437-448.
[15]WU Yuye,CHEN Qijun,CHEN Min.Salt-tolerant transgenic perennial ryegrass(LoliumperenneL.)obtained byAgrobacteriumtumefaciensmediated transformation of the vacuolar Na+/H+antiporter gene[J].Plant Sci,2005,169:65-73.
[16]SAQIB M,ZORB C,RENGEL Z.The expression of the endogenous vacuolar Na+/H+antiporters in roots and shoots correlates positively with the salt resistance of wheat(TriticumaestivumL.)[J].Plant Sci,2005,169:959-965.
[17]YAMAGUCHI-SHINOZAKI K.Improving plant drought,salt and freezing tolerance by gene transfer of a single stress
inducible transcription factor[J].Novartis Found Symp,2001,236:866-869.
Genetic stability analysis and salt tolerance of the progenies of soybean transformedAl NHX1 gene
LIU Jian-feng1,2,CUI Li3,AN Li-jia2
(1.College of Life Sciences,Hebei University,Baoding 071002,China;2.School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China;3.Preventive Laboratory,The Plant Protection and Quarantine of Hebei,Shijiazhuang 050011,China)
To obtain the progenies ofAl N H X1-expressing soybean with increasing salt-tolerant capacity,three of six transgenic soybean lines and their progenies which introduced the Na+/H+antiporter gene(Al NHX1)were used as materials to perform the genetic stability,analyse their resistance to salt stress.The results showed that theAl N H X1 gene could inherit steadily in transgenic soybean plants.Under 150 mmol/L NaCl salt stresses,a higher ratio of K+to Na+was retaining in the leaves of the transgenic plants.The osmotic potential in the leaves of the transgenic plants decreased by 39%and relative water increased by 9%.Transgenic plants also indicated an increase in SOD(45%)and POD(69%)activities over wild-type plants.The results demonstrated that theAl N H X1 gene was strongly expressed in soybean,with the increasing its salt-tolerant capacity under 150 mmol/L NaCl salt stress.
Al N HX1 gene;transgenic soybean plants;genetic stability; salt-tolerance index
S521
A
1000-1565(2012)02-0173-07
2011-09-10
保定市科学技术研究与发展指导计划项目(11ZF096)
刘建凤(1979-),女,河北衡水人,河北大学讲师,主要从事基因工程方面研究.
安利佳(1955-),男,辽宁丹东人,大连理工大学教授,主要从事生物工程研究.E-mail:bioeng@dlut.edu.cn
赵藏赏)

