脐静脉内皮细胞来源的微囊泡促进腹膜样组织血管化的初步研究
程中良 邹翔宇 吴帅 琚官群 朱英坚
组织血管化是临床成功应用组织工程技术进行组织修复的重要条件之一。如果没有快速高水平的组织血管化,移植物中的种子细胞在移植早期不易存活[1]。目前组织血管化的策略主要包括以下几种:①对支架材料的表面结构进行修饰[2-3];②在材料内复合缓释的生长因子[4-6];③对种子细胞进行基因修饰[7-8]。虽然这些方法在促进新生血管生成方面具有一定的作用和价值,但是存在支架材料的制备工艺复杂、生长因子降解速度快,以及进行基因修饰的种子细胞存活率低等缺点。研究能够促进组织血管化的简单方法是组织工程领域重要研究课题之一[9]。
我们的前期研究发现,腹膜间皮细胞作为种子细胞构建的组织工程腹膜样组织,可用于尿道缺损的替代修复[10-11]。但是一旦尿道缺损面积太大,滋养血管不能充分供给中心区域时,就会导致治疗失败。
血管内皮细胞生长因子(VEGF)是能够促进组织工程组织血管化的一种重要的生长因子。已有文献证实,腹膜间皮细胞在一定条件下也可分泌VEGF[12]。因此,如能寻找到一种促进腹膜间皮细胞分泌VEGF增多并进一步促进腹膜样组织血管化的方法,就可能明显提高腹膜样组织进行组织工程替代的疗效。
近年来,越来越多的研究聚焦于细胞的微囊泡。微囊泡被认为是细胞间信号传递的重要分子,在细胞通讯和细胞相互作用中具有重要作用。微囊泡是各类细胞遭受一系列应激(激活或凋亡)时,从细胞质膜上脱落而释放的膜性小囊泡[13]。已有研究发现,内皮细胞来源的微囊泡能够刺激多种细胞增殖和抑制凋亡[14-15],并能够促进内皮细胞自分泌VEGF[16]和启动血管生成。本研究旨在探讨人脐静脉内皮细胞来源的微囊泡能否促进大鼠腹膜间皮细胞增殖,刺激其分泌VEGF,并促进体内腹膜样组织血管化,为组织工程腹膜样组织的临床应用奠定基础。
1 材料和方法
1.1 材料
SD大鼠、裸鼠(上海第九人民医院动物实验中心),新生婴儿废弃脐带(上海市第一人民医院妇产科无偿获得,均经产妇知情同意),DMEM培养基、EGM-2培养基(Lonze公司),胎牛血清(HyClone公司), 胰蛋白酶(Sigma 公司),CD31、VE-Cad 因子(Abcan 公司),Vimentin、CK-AE1/AE3(Santa Cruz公司),兔抗小鼠二抗(Dako公司),FITC标记的荧光二抗(Dako公司),人VEGF的ELISA试剂盒、大鼠VEGF的试剂盒(R﹠D公司),Ⅰ型胶原酶(Gibco公司),小肠粘膜下层(SIS)。
1.2 实验方法
1.2.1 大鼠腹膜间皮细胞的分离、培养
取4周龄SD雄性大鼠4只,肌肉注射10%水合氯醛0.5~0.8 mL麻醉,向大鼠腹腔内注射0.25%胰蛋白酶20~30 mL和0.02%EDTA消化液。1 h后脱颈处死大鼠,75%乙醇全身浸泡消毒10min。将大鼠仰面置于超净工作台,沿腹白线依次剪开腹壁皮肤及肌肉,吸出腹腔内的消化液,移入15 mL离心管中,加入含20%FBS血清培养基中和胰酶,1500 r/min离心15min,弃上清液,加入含20%FBS的DMEM培养液,轻轻用吹打成细胞混悬液,分装于25 cm2的细胞培养瓶中,加入培养基,使总体积达到4~5 mL,置于37℃、5%CO2的培养箱中培养。每2 d更换1次完全培养基。常规传代,取第2代细胞进行实验和鉴定。
1.2.2 hUVECs原代培养
取胎儿脐带10~30 cm,PBS冲洗,分离脐带组织中管腔大、管壁薄的脐静脉,在脐静脉一端插入钝头灌流玻璃管并固定,PBS冲洗脐静脉腔,直至流出液澄清无血色;夹闭脐静脉另一端,脐静脉内灌注0.1%Ⅰ型胶原酶使其充盈,37℃消化10~12min,收集消化液至50 mL离心管中,并用EGM-2培养液冲洗静脉,将收集液以1500 r/min离心5min,小心弃上清液,以EGM-2培养液将细胞沉淀重新悬浮,调整细胞密度为(2~3)×105cells/mL,转移至 25 cm2的培养瓶内,置于37℃、5%CO2培养箱中进行培养,24h后观察细胞贴壁及生长情况并更换培养液,之后每2天半量换液1次。取第3~5代细胞用于实验以及鉴定。
1.2.3 hUVECs来源的微囊泡分离、定量和投射电镜扫描鉴定
hUVECs培养至80%融合时,弃培养液更换为含0.25%BSA的无血清EGM-2,继续培养24h后,收集上清液,2000 g离心20min,以去除细胞碎片,收集上清放入超高速真空离心机以100000 g、4℃离心1 h,弃上清加入无血清M199洗涤后,再次行超高速真空离心。弃上清,再于2.5%戊二醛溶液固定,4 ℃、2 h以上,PBS(pH7.2)冲洗,1%锇酸固定后,乙醇梯度脱水,100%丙酮浸透,环氧树脂包埋、切片,将切片铺于铜网上,经枸橼酸铅及醋酸双氧铀染色后,透射电镜观察并照相。余微囊泡的重悬于M199培养基中,微囊泡中所含蛋白质用BAD法行蛋白定量,放入-80℃冰箱保存。
1.2.4 微囊泡对rPMC增殖的影响
取对数生长期的rPMC重悬成1×105cells/mL,每孔取100μL种植在96孔板中,待细胞贴壁后试验组每孔加入30 μg/mL含hUVECs来源微囊泡的蛋白,对照组不加,每组细胞6个副孔,37℃、5%CO2培养箱中孵育, 分别培养 0、24、48、72 h 后,弃上清,每孔加入CCK-8试剂10μL,继续培养3 h后,用酶标仪进行450 nm处吸光度值的测量。
1.2.5 RT-PCR检测微囊泡组和对照组rPMC
rPMC以5000个/孔种植在6孔板中,贴壁后MVs组加入30 μg/mL微囊泡,对照组不加,分别在24、48、72 h收集上清液,按ELISA试剂盒说明分别检测大鼠和人来源VEGF浓度。弃上清后,贴壁细胞采用TRIzol一步法提取总RNA,2 μg总RNA进行逆转录合成cDNA,反应体系20μL进行PCR扩增,引物序列包括人VEGF上游引物5'-cccactgaggagtccaacat-3', 下游引物 5'-aaatgctttctccgctctga-3',大鼠 VEGF上游引物5'-gcccatgaagtggtgaagtt-3',下游引物5'-tatgtgctggctttggtgag-3',以β-actin为内参照,扩增后 1.8%琼脂糖凝胶电泳(90 V,30min)进行PCR产物鉴定,电泳图像分析仪扫描分析。
1.2.6 rPMC种植在SIS表面移植裸鼠皮下
收集第2代腹膜间皮细胞,以2×106cells/cm2细胞密度,将rPMC均匀接种至小肠黏膜下层(Small intestine submucosa,SIS)支架(第九人民医院组织工程实验室提供)表面,实验组放入含hUVECs来源的微囊泡30 μg/mL的DMEM培养液,对照组为单纯DMEM培养液,置于CO2恒温培养箱中,隔天换液,1周后分别接种于4周龄裸鼠侧背部皮下。2周后取出支架移植物,经4%多聚甲醛固定,石蜡包埋切片,脱蜡、脱水、HE染色,镜下观察拍照,并对微血管样结构计数(光学显微镜下,10×20倍视野下,每张片随机选取不重叠的5个视野进行计数)。
1.2.7 统计学处理
运用SPSS 19.0软件进行t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 rPMC和hUVECs鉴定
刚消化下来的腹膜间皮细胞在光镜下呈分散的小圆型细胞,约24h左右贴壁;融合前相差显微镜观察,细胞呈多样形(梭形、椭圆形、多角形等)。体外培养1周,细胞生长融合,倒置相差显微镜观察,细胞呈多角形,大小一致,“铺路石样”外观(图1a)。细胞免疫组织化学染色显示,抗细胞角蛋白抗原(CKAE1/AE3)和抗波形蛋白抗原(Vimentin)阳性(图1b、C)。hUVECs原代培养后,相差显微镜下可见细胞单层排列,边界清楚,呈圆形、短梭形或扁平形,3~4 d融合成单层,铺路石样排列(图1d)。细胞免疫荧光示CD31和VE-Cad阳性表达(图1e、f)。
2.2 透射电镜观察微囊泡
透射电镜下可见有完整膜结构的微囊泡(图2)。
2.3 微囊泡对腹膜间皮细胞增值的影响
微囊泡组在 24、48、72、96 h 与对照组相比,增殖效应明显增强(P<0.05)(图 3)。
2.4 腹膜间皮细胞上清液VEGF蛋白质水平
培养的rPMC经微囊泡干预后与对照组相比,在24、48、72 h分别采取ELISA方法对细胞培养上清液行大鼠VEGF检测,发现加入hUVECs来源的微囊泡组上清液中,大鼠来源VEGF含量与对照组相比显著升高(P<0.05)(图4),未检测到人来源VEGF表达。
2.5 腹膜间皮细胞VEGF mRNA的表达
培养的rPMC经hUVECs来源的微囊泡干预后与对照组相比,大鼠VEGF的mRNA行RT-PCR检测,在 24、48、72 h 的表达均明显高于对照组(图 5)。两组均未检测到人来源的VEGF的mRNA表达。
2.6 微囊泡对SIS支架内新生微血管样结构的影响
被覆rPMC的SIS支架移植入裸鼠皮下2周后,HE染色可见MVs组移植物中含大量红细胞的新生微血管样结构。加入hUVECs来源的微囊泡组中新生血管密度较对照组显著增多(P<0.05)(图6)。
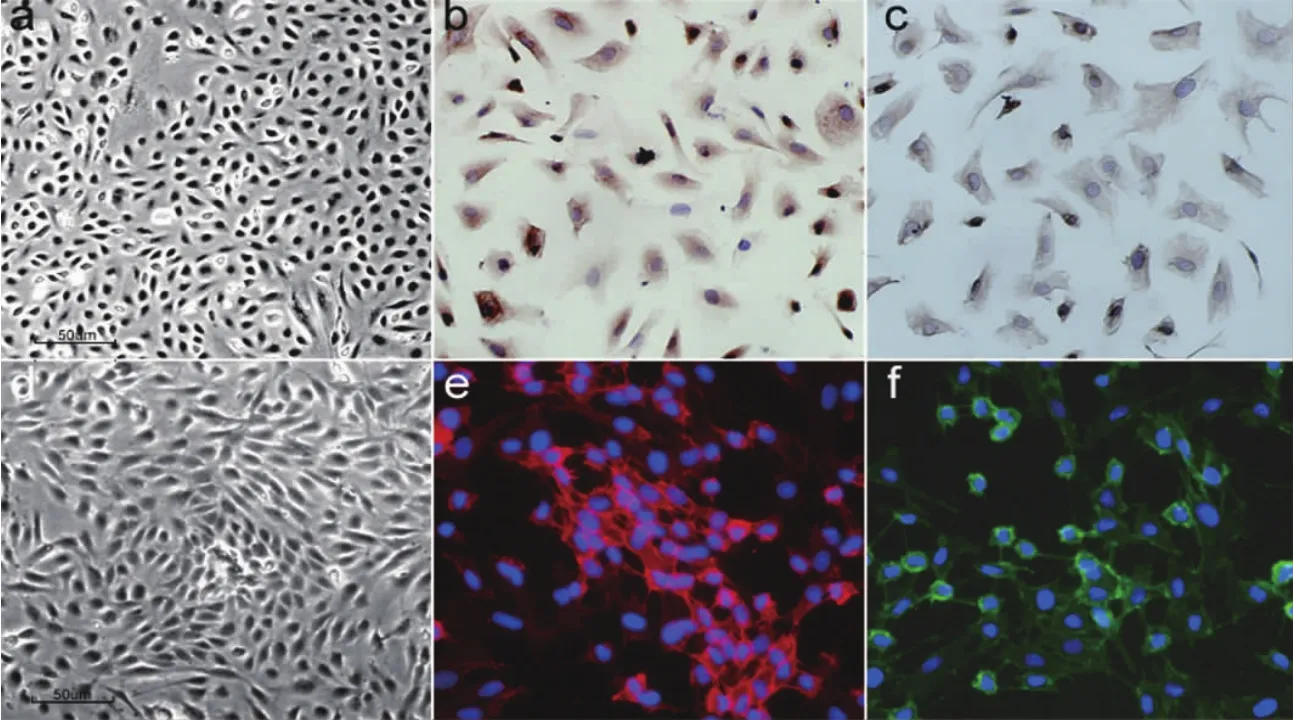
图1 腹膜间皮细胞与人脐静脉内皮细胞形态学观察和鉴定Fig.1 The morphological features and identifications of peritoneal mesothelial cells and human umbilical vein endothelial cells

图2 人脐静脉内皮细胞来源的微囊泡透射电镜观察(80 KV,30000×)Fig.2 The TEM observations of microvesicles(MVs)derived from human umbilical vein endothelial cells(80 KV,30000×)
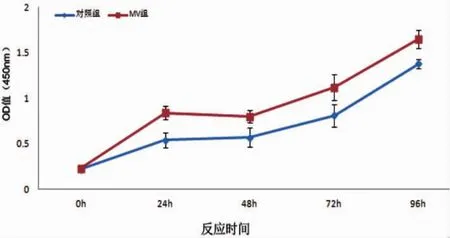
图3 微囊泡对腹膜间皮细胞增殖的影响Fig.3 The effects of MVs on growth ability of rat peritoneal mesothelial cells
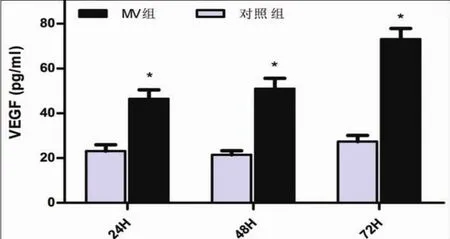
图4 ELISA检测24、48、72 h上清液中大鼠VEGF的表达(*:P<0.05)Fig.4 The rat VEGF expression of supernatant in MVs group and control group at 24,48,72 h were tested by ELISA(*:P<0.05)
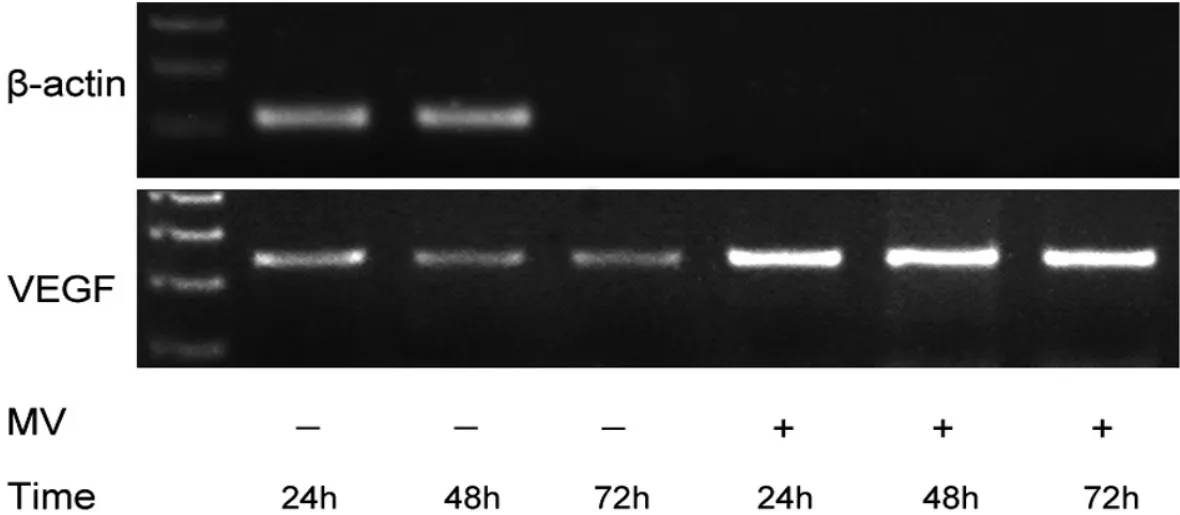
图5 RT-PCR检测MVs组和对照组大鼠VEGF表达Fig.5 The rat VEGF expression in MVs group and control group were tested by RT-PCR
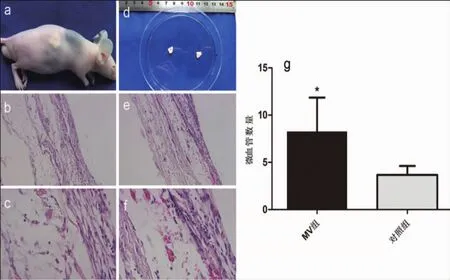
图6 移植裸鼠皮下及取出后HE染色观察微血管样结构的数量Fig.6 Transplanted subcutaneously into nude mice,and the number of microvessel-like structures by HE staining
3 讨论
先天或后天原因所导致的尿道狭窄和缺损,尤其是大于2 cm的长段尿道缺损和复杂性尿道狭窄的尿道重建,仍然是困扰泌尿外科的难题之一。组织工程学为此提供了全新的思路。在尿道组织工程中,种子细胞的选择仍然是研究热点。自体尿路移行上皮细胞是理想的种子细胞来源。但是,尿路上皮细胞的来源有限,体外培养和扩增较为困难。腹膜间皮细胞来源于中胚层,同时表达间叶细胞和上皮细胞的分子标记,易在体外培养和扩增。同时,大网膜和腹膜表面覆盖间皮细胞,因此具有量多、易取的特点。应用腹膜间皮细胞覆盖的自体管状组织修复尿道缺损研究取得了良好的效果[10]。同时,应用腹膜间皮细胞作为尿道组织工程的种子细胞进行尿道修复,也取得了预期的效果[11]。目前的研究中,面临的瓶颈就是工程化组织的血管化问题。
近年来,血管化问题的研究取得了一些进展,但仍未达到理想的效果。微囊泡,作为一种新发现的细胞间信号传递分子,可能在促进细胞自分泌生长因子以及促进血管化方面具有一定的作用。已有研究发现,微囊泡与靶细胞之间的作用方式主要表现为以下几种:①通过其表面的配体与靶细胞的受体结合继而激活或者抑制靶细胞内的转导通路[17]。②传递母细胞的蛋白质或mRNA到靶细胞[18]。微囊泡在形成过程中可以将母细胞质中的成分(蛋白质、mRNA或miRNA包裹进去),然后传递到靶细胞中,使其具有新的生物学或遗传特征。③将母细胞膜的受体转移到靶细胞而呈现相关受体表型[16]。④作为载体转移完整的细胞器或者致病因子[19]。最新研究显示,内皮细胞来源的微囊泡被证实能够刺激内皮细胞的增殖并抑制凋亡,同时能够促进内皮细胞自分泌VEGF,并启动血管生成。本实验中,我们成功地从人脐静脉内皮细胞的上清液中分离出微囊泡,并初步证实此微囊泡能够促进腹膜间皮细胞增殖、刺激其释放VEGF,并使移植的组织工程样腹膜组织血管化。同时,我们还发现,人脐静脉内皮细胞来源的微囊泡与大鼠的腹膜间皮细胞共培养后,上清液中的大鼠来源的VEGF表达增高,但未检测出人VEGF蛋白表达,也没有检测到人VEGF的mRNA表达。据此,我们推测,人脐静脉内皮细胞来源的微囊泡可能是通过其表面的配体与靶细胞的受体结合,继而激活或者抑制靶细胞内的转导通路,进而激活腹膜间皮细胞内促进VEGF高表达的信号通路,具体的机制尚需更进一步的研究。
本实验中,我们首次证实了人脐静脉内皮细胞来源的微囊泡在体外能促进大鼠腹膜间皮细胞增殖,同时刺激大鼠来源的VEGF释放。同时,在体内实验验中,发现微囊泡可促进组织工程化腹膜样组织血管化增加,该发现为组织工程组织血管化研究提供了新的实验依据。
[1]Madeddu P.Therapeutic angiogenesis and vasculogenesis for tissue regeneration[J].Exp Physiol,2005,90(3):315-326.
[2]Sarkar S,Lee GY,Wong JY,et al.Development and characterization of a porous micro-patterned scaffold for vascular tissue engineering applications[J].Biomaterials,2006,27(27):4775-4782.
[3]Kim BS,Baez CE,Atala A.Biomaterials for tissue engineering[J].World J Urol,2000,18(1):2-9.
[4]Zisch AH,Lutolf MP,Ehrbar M,et al.Cell-demanded release of VEGF from synthetic,biointeractive cell ingrowth matrices for vascularized tissue growth[J].FASEB J,2003,17(15):2260-2262.
[5]Bauer SM,Bauer RJ,Liu ZJ,et al.Vascular endothelial growth factor-C promotes vasculogenesis,angiogenesis,and collagen constriction in three-dimensional collagen gels[J].J Vasc Surg,2005,41(4):699-707.
[6]Elcin YM,Dixit V,Gitnick G.Extensive in vivo angiogenesis following controlled release of human vascular endothelial cell growth factor:implications for tissue engineering and wound healing[J].Artif Organs,2001,25(7):558-565.
[7]Wenger A,Kowalewski N,Stahl A,et al.Development and characterization of a spheroidal coculture model of endothelial cells and fibroblasts for improving angiogenesis in tissue engineering[J].Cells Tissues Organs,2005,181(2):80-88.
[8]Unger RE,Sartoris A,Peters K,et al.Tissue-like self-assembly in cocultures of endothelial cells and osteoblasts and the formation of microcapillary-like structures on three-dimensional porous biomaterials[J].Biomaterials,2007,28(27):3965-3976.
[9]Kanematsu A,Yamamoto S,Ogawa O.Changing concepts of bladder regeneration[J].Int J Urol,2007,14(8):673-678.
[10]Gu GL,Zhu YJ,Xia SJ,et al.Peritoneal cavity as bioreactor to grow autologous tubular urethral grafts in a rabbit model[J].World J Urol,2010,28(2):227-232.
[11]Gu GL,Xia SJ,Zhang J,et al.Tubularized urethral replacement using tissue-engineered peritoneum-like tissue in a rabbit model[J].Urol Int,2012,89(3):358-364.
[12]Mutsaers SE.Mesothelial cells:their structure,function and role in serosal repair[J].Respirology,2002,7(3):171-191.
[13]Conde-Vancells J,Rodriguez-Suarez E,Embade N,et al.Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes[J].J Proteome Res,2008,7(12):5157-5166.
[14]Cantaluppi V,Biancone L,Figliolini F,et al.Microvesicles derived from endothelial progenitor cells enhance neoangiogenesis of human pancreatic islets[J].Cell Transplant,2012,21(6):1305-1320.
[15]Cantaluppi V,Gatti S,Medica D,et al.Microvesicles derived from endothelial progenitor cells protect the kidney from ischemiareperfusion injury by microRNA-dependent reprogramming of resident renal cells[J].Kidney Int,2012,82(4):412-427.
[16]Al-Nedawi K,Meehan B,Kerbel RS,et al.Endothelial expression of autocrine VEGF upon the uptake of tumor-derived microvesicles containing oncogenic EGFR[J].Proc Natl Acad Sci U S A,2009,106(10):3794-3799.
[17]Taraboletti G,D'Ascenzo S,Borsotti P,et al.Shedding of the matrix metalloproteinases MMP-2,MMP-9,and MT1-MMP as membrane vesicle-associated components by endothelial cells[J].Am J Pathol,2002,160(2):673-680.
[18]Deregibus MC,Cantaluppi V,Calogero R,et al.Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizontal transfer of mRNA[J].Blood,2007,110(7):2440-2448.
[19]Raymond AD,Campbell-Sims TC,Khan M,et al.HIV Type 1 Nef is released from infected cells in CD45(+)microvesicles and is present in the plasma of HIV-infected individuals[J].AIDS Res Hum Retroviruses,2011,27(2):167-178.

