微波辐射对人宫颈癌HeLa细胞的增殖抑制作用及其机制
朱文赫,张 巍,李 妍,徐俊杰,姜艳霞,罗 军,芦晓晶,吕士杰
(吉林医药学院生物化学与分子生物学教研室,吉林 吉林132013)
微波辐射对人宫颈癌HeLa细胞的增殖抑制作用及其机制
朱文赫,张 巍,李 妍,徐俊杰,姜艳霞,罗 军,芦晓晶,吕士杰
(吉林医药学院生物化学与分子生物学教研室,吉林 吉林132013)
目的 :探讨不同强度微波辐射对人宫颈癌HeLa细胞的增殖抑制作用及对氧化应激水平的影响,阐明微波辐射对人宫颈癌 HeLa细胞的增殖抑制作用机制。方法:分别以强度为2.5、5.0、10.0、15.0和20.0mW·cm-2的微波处理HeLa细胞20min作为不同剂量辐射组,同时设立假辐射组 (0mW·cm-2)作为对照组,采用倒置显微镜观察细胞形态改变;MTT法检测微波辐射对细胞增殖的抑制情况;试剂盒测定辐射后细胞超氧化物歧化酶 (SOD)活性和丙二醛 (MDA)含量;Western blotting法检测细胞内核转录因子-κB(NF-κB)和热休克蛋白70(HSP 70)表达水平。结果:各剂量微波辐射组HeLa细胞数量明显减少,细胞皱缩变形,体积缩小,随着辐射强度的增加变化愈明显;2.5、5.0、10.0、15.0和20.0mW·cm-2强度的微波作用细胞24h,HeLa细胞的增殖抑制率均明显高于对照组 (P<0.05);微波辐射后细胞内MDA含量随着辐射强度的增加,与对照组细胞比较呈上升趋势,各剂量辐射组HeLa细胞SOD活性较对照组显著下降 (P<0.05)。Western blotting检测,微波辐射后细胞内HSP 70表达水平呈增加趋势,而NF-κB蛋白的表达水平呈明显的下降趋势。结论:微波辐射对人宫颈癌HeLa细胞增殖具有抑制作用,其可能机制是改变细胞内氧化及抗氧化平衡。
微波辐射;人宫颈癌细胞;增殖抑制作用;超氧化物歧化酶;丙二醛
微波是一种频率为300MHz~300GHz的电磁波。随着现代电磁技术的发展,微波被广泛应用于医药卫生、军事、通讯、工业生产和日常生活等领域,对微波的生物学效应研究也日益受到重视[1]。早在 20 世 纪 70 年 代, Webb 等[2-3]对 人 正常细胞和癌细胞的微波频谱进行研究发现:正常细胞和癌细胞的吸收频谱有差异。微波能通过热效应和非热效应选择性地杀伤肿瘤细胞,引起细胞形态学和功能学改变,导致细胞坏死或者诱导凋亡。由于微波所具有的特性使其作为一种辅助治疗肿瘤的手段应用于临床,微波技术结合放疗、化疗等手段,可明显提高局部肿瘤的治疗效果和患者的生存率,在许多恶性肿瘤的治疗中有一定效果,但是目前就微波的生物学效应的机制研究仍有许多争论[4]。本实验以人宫颈癌HeLa细胞为研究对象,观察不同强度微波辐射对细胞增殖抑制率及氧化应激水平的影响,初步探讨微波对人宫颈癌细胞作用的机制,为微波在临床治疗上的应用提供实验依据。
1 材料与方法
1.1 细胞、主要试剂及仪器 人宫颈癌HeLa细胞由吉林医药学院生物化学教研室保存;小牛血清购于杭州四季青公司,RPMI-1640培养液购于美国Gibco公司,超氧化物歧化酶 (superoxide dismutase,SOD)、丙 二 醛 (malondialdehyde,MDA)购于南京建成生物工程研究所,HSP70抗体购于Sigma公司,NF-κB购于Epitomics公司,BCA (bicinchoninic acid)蛋白含量测定试剂盒购自江苏碧云天生物技术研究所,其他试剂均为国产分析纯;550酶标仪购于美国 Bio-rad公司,MY8C-1型微波功率源购自南京汇研微波系统工程有限公司 (频率为2 450MHz)。
1.2 细胞培养和形态学观察 将人宫颈癌HeLa细胞培养于含10%小牛血清、100U·mL-1青霉素和100μg链霉素的RPMI-1640培养液中,置于37℃、5%CO2饱和湿度的细胞培养箱中培养。每2d更换培养液1次,待细胞长满至培养瓶底,以0.25%胰酶消化传代。取对数生长期细胞进行实验,调整细胞密度为1×105mL-1,接种于60mm培养皿内,24h后分别采用不同强度的2 450MHz微波辐射20min,继续培养24h,显微镜下观察,拍摄。
1.3 MTT法检测HeLa细胞增殖抑制率 将培养的HeLa细胞按1×105mL-1接种于96孔板,细胞分成对照组和各剂量辐照组,每组设5个复孔。培养24h后,各剂量辐照组分别以2.5、5.0、10.0、15.0和20.0mW·cm-2强度的微波进行辐射,辐射时间为20min,继续培养,辐照24h后,弃掉培养液,每孔加入200μL新配制的0.5g·mL-1MTT溶液,37℃孵育4h,小心吸弃孔内液体,每孔再加入二甲基亚枫 (DMSO)150μL,振荡10min,在酶标仪选择490nm波长检测各孔吸光度 (A)值,按公式计算细胞增殖抑制率。细胞增殖抑制率 = (1-实验组A值/对照组A值)×100%。
1.4 HeLa细胞内MDA和SOD活性的测定 取对数生长期HeLa细胞接种于培养皿,培养24h,经不同强度微波辐射后24h,消化离心收集细胞,用预冷的PBS洗涤,0.5mL PBS重悬细胞。立即在4℃超声下破碎细胞,10 000r·min-1离心15min,取上清,采用BCA蛋白含量测定试剂盒测定蛋白含量,按照试剂盒说明操作,以550nm波长测定HeLa细胞SOD活性,在532nm波长处测HeLa细胞MDA水平,每个样本均作3个平行管。
1.5 Western blotting法检测HeLa细胞内核转录因子-κB (NF-κB)和热休克蛋白70 (HSP70)的表达量 微波辐射后,取各组HeLa细胞,0.25%胰酶消化,离心收集细胞,1 000r·min-1离心10min,以PBS洗2次,用PIPA细胞裂解液于冰浴裂解,12 000r·min-1离心5min,收集上清。经BCA法进行蛋白定量后,取等量样品以12%SDS-PAGE进行电泳。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1h后,加入兔抗人NF-κB和HSP70抗体 (1∶100)孵育过夜,再以辣根过氧化酶标记的二抗封闭液孵育1h,用ECL显影,凝胶成像系统处理结果。
1.6 统计学分析 采用SPSS 13.0统计学软件进行数据处理。HeLa细胞增殖抑制率、MDA和SOD检测结果均以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 微波辐射后HeLa细胞增殖抑制率和细胞形态 经2.5、5.0、10.0、15.0和20.0mW·cm-2微波辐射HeLa细胞24h后,显微镜观察细胞形态变化。对照组HeLa细胞生长状态良好,细胞铺展贴壁生长,增殖较快,伸展透亮,细胞之间排列紧密,呈不规则对角形,细胞触角较短,轮廓清晰。经微波辐射后细胞生长缓慢,细胞数量明显减少,细胞皱缩变形,体积缩小,随着辐射强度的增加细胞形态变化也愈明显。2.5mW·cm-2的微波辐射10min,HeLa细胞增殖即表现出抑制,微波辐射强度增加时,细胞增殖抑制显著增加,呈剂量依赖性。见图1(插页四)和表1。
表1 不同强度微波辐射后HeLa细胞增殖抑制率Tab.1 The inhibitory rates of proliferation of HeLa cells after radiated with different intensities of microwave (n=5,±s,η/%)

表1 不同强度微波辐射后HeLa细胞增殖抑制率Tab.1 The inhibitory rates of proliferation of HeLa cells after radiated with different intensities of microwave (n=5,±s,η/%)
* P<0.05compared with control group.
Group Inhibitoryrate Control 0.17±0.09 Radiation 2.5mW·cm-2 10.12±0.98*5.0mW·cm-2 16.12±0.42*10.0mW·cm-2 27.44±0.57*15.0mW·cm-2 59.28±1.29*20.0mW·cm-2 84.86±1.74*
2.2 微波辐射后 HeLa细胞MDA水平和SOD活性 随着微波辐射强度的增高,各辐射组HeLa细胞内MDA水平较对照组呈上升趋势,5.0mW·cm-2辐射组与对照组比较水平略升高;而10.0、15.0和20.0mW·cm-2辐射组的 MDA水平明显升高,与对照组比较差异有统计学意义 (P<0.05)。微波辐射组HeLa细胞中的SOD活性均下降,2.5、5.0、10.0、15.0和20.0mW·cm-2辐射组HeLa细胞的SOD活性下降,与对照组比较差异有统计学意义 (P<0.05)。见表2。
2.3 HeLa细胞内NF-κB和HSP70的表达水平Western blotting检测,随着微波辐射强度的增加,HSP70蛋白的表达水平逐渐升高,而NF-κB蛋白表达水平随着微波辐射强度的增加呈下降趋势。见图2。
表2 不同强度微波辐射后HeLa细胞SOD活性和MDA水平Tab.2 The MDA levels and SOD activities of HeLa cells after radiated with different intensities of microwave [±s,λB/(U·mL-1)]
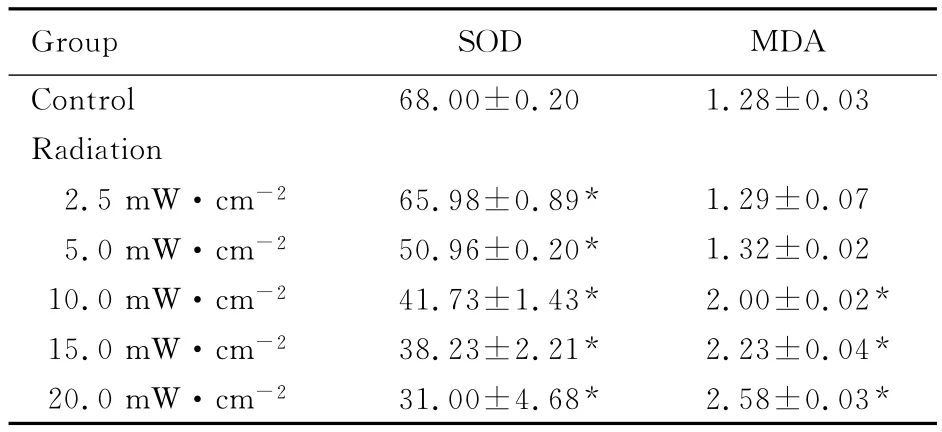
表2 不同强度微波辐射后HeLa细胞SOD活性和MDA水平Tab.2 The MDA levels and SOD activities of HeLa cells after radiated with different intensities of microwave [±s,λB/(U·mL-1)]
* P<0.05compared with control group.
Group SOD MDA Control 68.00±0.20 1.28±0.03 Radiation 2.5mW·cm-2 65.98±0.89* 1.29±0.07 5.0mW·cm-2 50.96±0.20* 1.32±0.02 10.0mW·cm-2 41.73±1.43* 2.00±0.02*15.0mW·cm-2 38.23±2.21* 2.23±0.04*20.0mW·cm-2 31.00±4.68* 2.58±0.03*
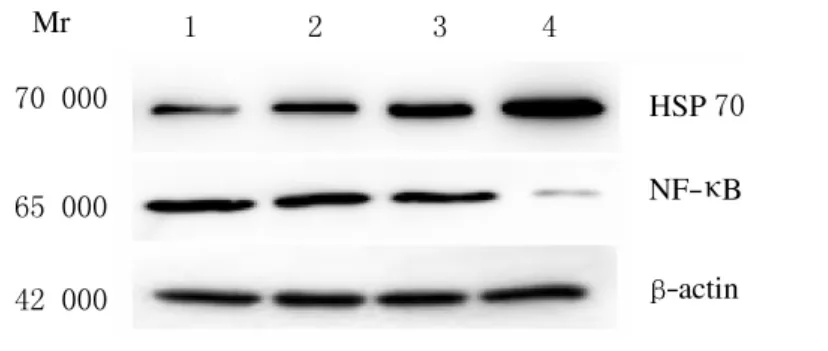
图2 不同强度微波辐射后HeLa细胞内HSP 70和NF-κB蛋白表达电泳图Fig.2 Electrophoregram of expressions of HSP 70and NF-κB protein after radiated with different intensities of microwaveLane 1:Control group;Lane 2-4:5.0,10.0,and 20.0mW·cm-2 radiation groups.
3 讨 论
氧化应激是指外源或内源性活性氧 (reactive oxygen species,ROS)超过细胞的抗氧化能力而对细胞信号转导系统产生全面的影响[5]。活性氧簇被认为是多种调节细胞生存和细胞死亡途径的信号分子。目前有研究[6]显示:在癌变和抑癌过程中活性氧与自由基发挥着重要的作用。SOD是清除氧自由基最重要的酶之一,其活性反映了机体清除氧自由基的能力。活性氧自由基可引起脂质过氧化反应,损伤细胞膜,进而导致细胞死亡,其终产物MDA的含量亦间接反映了机体细胞被自由基损伤的程度[7]。微波辐射能够通过影响生物体的氧化应激水平导致氧化和抗氧化系统失调,使细胞受损[8-9]。微波对氧化应激的影响提示微波辐射可以进行合理的临床应用。
本研究结果表明:微波辐射对HeLa细胞的增殖具有抑制作用,随着微波辐射强度的增高,微波对HeLa细胞的增殖抑制率也愈大,呈现明显的剂量依赖性。辐射后HeLa细胞的形态也发生明显的改变,表现细胞数量明显减少,细胞皱缩变形,胞核和胞质结构不清的形态。微波辐射HeLa细胞后,通过测定MDA和SOD的活性变化可以反映氧自由基的损失情况。本实验结果表明:经2.5、5.0、10.0、15.0和20.0mW·cm-2微波辐射后细胞内SOD活性下降,而MDA水平明显增高。说明经微波辐射后,机体的脂质过氧化反应也逐渐加重,SOD消耗过多。MDA活性升高则是由于细胞损伤促进了氧自由基的产生。
HSPs也称应激蛋白,是一类结构上高度保守的蛋白,对氧自由基引起的细胞损害具有保护自由作用。经不同强度微波辐射后,细胞内HSP70的表达量发生改变,随着辐射强度的提高,HSP70蛋白表达明显上调[10-11]。NF-κB是一种多效性的转录因子,与细胞增生、转化和凋亡等重要的病理生理过程密切相关[12]。NF-κB是应激与炎症反应的中枢调节,与抑制性蛋白 (IκB)结合呈非活性状态。氧自由基可引起转录因子激活物NF-κB和IκB的解离,激活NF-κB。本实验结果表明:随着微波辐射强度的增加,细胞内NF-κB的表达水平呈下降趋势。
综上所述,2 450MHz微波辐射对HeLa细胞增殖具有明显的抑制作用,其机制可能是使细胞内氧化及抗氧化的平衡失调。微波辐射可导致细胞内MDA含量升高而SOD活性降低,同时使细胞内应激蛋白HSP70及NF-κB的表达水平发生改变。
[1]Lu HH,Zhou J,Xiong SB,et al.Effects of low-intensity microwave radiation on Tribolium castaneum physiological and biochemical characteristics and survival[J].Insect Physiol,2010,56(9):1356-1361.
[2]Webb SJ,Booth AD.Microwave absorption by normal and tumor cell[J].Science,1971,174(400):72-74.
[3]Nikfarjam M,Muralidharan V,Christophi C.Mechanisms of focal heat destruction of liver tumors[J].J Surg Res,2005,127(2):208-223.
[4]Pocard M,Boige V.Cytoreductive surgery and hyperthermic int raperitoneal chemotherapy for peritoneal colorectal carcinomatosis;a newly validated standard whose contribution remains to be assessed [J].Bull Cancer,2005,92 (2):151-154.
[5]Trivedi RK,Patel MC.Development of a stability-indicating RP-UPLC method for rapid determination of metaxalone and its degradation products in solid oral dosage form [J].Sci Pharm,2012,80(2):353-366.
[6]Ishii N.Role of oxidative stress from mitochondria on aging and cancer[J].Cornea,2007,26(9Suppl 1):53-59.
[7]Hyland GJ.Physics and biology of mobile telephony [J].Lancet,2000,356(25):1833-1836.
[8]Jing J,Yu HZ, Yang XQ,et al. The influence of microwave radiation from cellular phone on fetal rat brain [J].Electromagn Biol Med,2012,31(1):57-66.
[9]Kumar S,Kesari KK,Behari J.The therapeutic effect of a pulsed electromagnetic field on the reproductive patterns of male Wistar rats exposed to a 2.45-GHz microwave field [J].Clinics,2011,66(7):1237-1245.
[10]Garrido C,Paul C,Seigneuric R,et al.The small heat shock proteins family:The long forgotten chaperones [J].Int J Biochem Cell Biol,2012,44(10):1588-1592.
[11]Helbig D,Simon JC,Paasch U.Photodynamic therapy and the role of heat shock protein 70 [J].Int J Hyperthermia,2011,27(8):802-810.
[12]Kumar S,Verma AK,Das M,et al.Molecular mechanisms of IgE mediated food allergy [J].Int Immunopharmacol,2012,13(4):432-439.
Inhibitory effect of microwave radiation on proliferation of human cervical carcinoma HeLa cells and its mechanism
ZHU Wen-he,ZHANG Wei,LI Yan,XU Jun-jie,JIANG Yan-xia,LUO Jun,LU Xiao-jing,LV Shi-jie
(Department of Biochemistry and Molecular Biology,Jilin Medical College,Jilin 132013,China)
ObjectiveTo investigate the inhibitory effect of microwave radiation on proliferation of human cervical carcinoma HeLa cells and to clarify the mechanism of inhibitory effect of microwave radiation on proliferation of HeLa cells.MethodsThe HeLa cells were radiated by different intensities (2.5,5.0,10.0,15.0and 20.0mW·cm-2)microwave for 20min,and control group (0mW·cm-2)was set up.The morphological changes of HeLa cells were observed by microscope;the proliferation capacity was measured by MTT assay;the MDA levels and SOD activities were detected;the expression levels of HSP70and NF-κB protein after radiated with microwave were detected by Western blotting method.ResultsIn different doses of microwave radiation groups,the number of HeLa cells was decreased significantly,the cells shrank and were abnormal in shape,the cell volume was reduced.After 2.5,5.0,10.0,15.0,and 20.0mW·cm-2radiation for 24h,the inhibitory rates of proliferation of HeLa cells were significantly higher than that in control group(P<0.05);the MDA levels were increased with the increasing of the radiation dose compared with control group,and the SOD activities were decreased compared with control group (P<0.05).The results of Western blotting showed that the expression of HSP70was increased and the expression of NF-κB was decreased significantly in different doses of radiation groups.ConclusionMicrowave radiation can inhibit the proliferation of HeLa cells,and the mechanism may be related to changing intracellular oxidation and antioxidant balance.
microwave radiation;human cervical carcinoma;superoxide dismutase;malondialdehyde
R737.33
A
1671-587Ⅹ(2012)06-1156-04
2012-06-13
吉林省科技厅科技发展计划项目资助课题 (20120941);吉林医药学院大学生科研基金资助课题 (吉医科字[2011]12号)
朱文赫 (1984-),男,黑龙江省哈尔滨市人,讲师,医学博士,主要从事生物技术制药的研究。
吕士杰 (Tel:0432-64560460,E-mail:lvshijie-qr@163.com)

