VEGF、COX-2在甲状腺癌中的表达及临床意义
张 帅 沈 梁 谷维立 梁柳森
甲状腺癌是常见的头颈部内分泌肿瘤,也是最常见的甲状腺恶性肿瘤[1,2]。由于全球范围的饮食中所含碘量的差异,不同类型的甲状腺癌也呈多样化地域分布[3]。甲状腺癌的不同组织病理分型其恶性程度有所区别,但是都具有较强的侵袭性和转移性[4,5]。近年来甲状腺癌发病率有明显上升,研究甲状腺癌转移对甲状腺癌的治疗和预后都具有重要的指导意义。国外的研究报道指出,在大多数恶性肿瘤中 VEGF(vascular epithelial growthfactor)、COX -2(cyclooxygenase)的异常表达与肿瘤的发生、浸润、转移等都密切相关[6~8]。本实验将甲状腺肿瘤患者手术切除的组织进行分析比较,采用免疫组化等方法挖掘他们之间的联系以及其与甲状腺癌发生规律和转移机制。
材料与方法
1.标本来源:收集2005年3月~2010年2月笔者医院病理科保存的甲状腺手术切除组织的石蜡标本并且有病人完整资料的样本71例,其中甲状腺癌71例,男性27例,女性44例,年龄27~69岁,平均年龄47.3±7.3岁,乳头状癌30例,滤泡癌16例,髓样癌14例,未分化癌11例。甲状腺良性肿瘤53例,男性17例,女性36例,年龄24~73岁,平均年龄45.6±6.8岁。另外取正常甲状腺组织9例作为对照组。所有病例均有完整的临床资料。
2.免疫组化染色:实验所用兔抗人VEGF、COX-2单克隆抗体,SP试剂盒及DAB显色试剂盒均购自北京中山金桥生物有限公司。将所有石蜡组织进行连续切片,厚度为5μm,每例切取4张。根据两种抗体的要求进行微波加热抗原修复,每张切片上滴加1滴3%过氧化氢溶液,室温下孵育10min,PBS冲洗3次,每次3min。除去 PBS,每张切片上加50μl一抗,将玻片放入湿盒内4℃过夜。转天用PBS洗去一抗,3×3min,滴加1滴HRP标记的两步法抗兔的检测试剂,再用DAB显色试剂盒进行显色,显微镜下观察控制染色时间。最后苏木素进行染核,乙醇梯度脱水,透明,中性树脂封片。每组取1张切片用兔血清代替一抗作为阴性对照。
3.染色结果判定:VEGF定位于细胞质,有棕黄色染色颗粒认为阳性细胞。COX-2定位于细胞质和细胞核膜,阳性细胞染色呈棕黄色。阴性细胞细胞核呈蓝色,而细胞质不着色。避开肿瘤坏死区域及边缘区域,随机取10个高倍视野,每个视野下计数100个肿瘤细胞,采用半定量对每张切片的阳性细胞率和阳性细胞着色强度进行分级,两项乘积则用来判断阳性强度。按阳性着色程度评分,0分为无着色;1分为浅黄色;2分为棕黄色;3分为棕褐色。按阳性细胞率,<5%记0分,5% ~25%记1分,26% ~50%记2分,51% ~75%记3分,>75%记4分。将上述两项的结果相乘,0分为阴性(-),1~2分为弱阳性(+),3~6分为中等阳性(++),>6分为强阳性(+++)。
4.统计学方法:应用SPSS 15.0软件进行分析,组间比较采用卡方检验及Fish确切概率法,相关分析采用Spearman等级相关分析,p<0.05为有统计学差异。
结 果
1.甲状腺癌、甲状腺良性肿瘤、正常甲状腺组织中VEGF、COX-2的表达情况:VEGF在正常甲状腺组织中几乎不表达,9例正常组织仅有1例染色为弱阳性,而在甲状腺癌肿的表达主要在细胞质,胞质呈棕黄色染色颗粒。在甲状腺癌和甲状腺良性肿瘤中的表达阳性率分别为 77.5%(55/71),15.1%(8/71),甲状腺癌组织中的VEGF表达明显高于甲状腺良性肿瘤与正常甲状腺组织,差异具有统计学意义(p<0.05)。COX-2在正常甲状腺组织中几乎不表达,主要表达于癌组织的细胞质和细胞核膜。9例正常组织中仅有1例表达阳性。在甲状腺癌和甲状腺良性肿瘤中的表达阳性率分别为64.8%(46/71),13.2%(7/71)。甲状腺癌组织中的COX-2表达明显高于甲状腺良性肿瘤与正常甲状腺组织,差异具有统计学意义(p<0.05)(表1)。
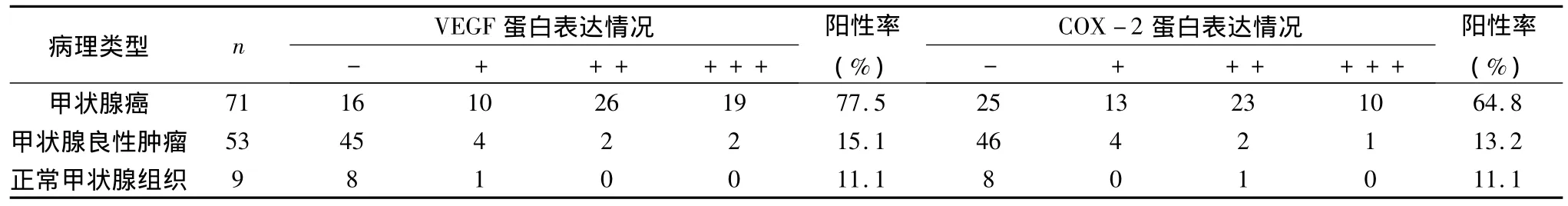
表1 甲状腺癌、甲状腺良性肿瘤、正常甲状腺组织中VEGF、COX-2的表达情况
2.VEGF蛋白表达与甲状腺癌的临床病理参数的关系:从表2可以看出,甲状腺癌患者性别、不同年龄段之间的VEGF表达差异无统计学意义(P>0.05),从肿瘤分期可以看出,Ⅰ、Ⅱ、Ⅲ、Ⅳ期肿瘤的COX-2表达阳性率分别为 57.9%、75%、92.3%、100%,4组相比具有统计学差异(p<0.05)。71例甲状腺癌中有31例伴有淋巴结转移,其VEGF阳性率为90.3%,显著高于没有淋巴结转移的甲状腺癌组织。两者差异具有统计学意义(p<0.05)。
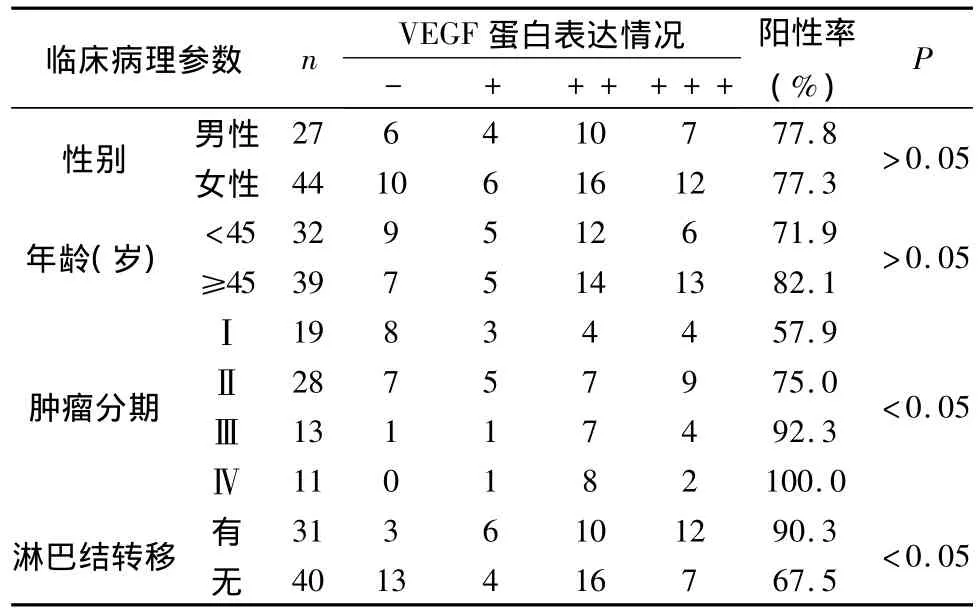
表2 VEGF蛋白表达与甲状腺癌的临床病理参数的关系
3.COX-2蛋白表达与甲状腺癌的临床病理参数的关系:从表3可以看出,甲状腺癌患者性别、不同年龄段之间的COX-2的表达差异无统计学意义(P>0.05),从肿瘤分期可以看出,Ⅰ、Ⅱ、Ⅲ、Ⅳ期肿瘤的COX-2表达阳性率分别为 52.6%、71.4%、61.5%、72.7%,4 组相比具有统计学差异(P <0.05)。71例甲状腺癌中有31例伴有淋巴结转移,其COX-2阳性率为96.9%,显著高于没有淋巴结转移的甲状腺癌组织。两者差异具有统计学意义(p<0.05)。
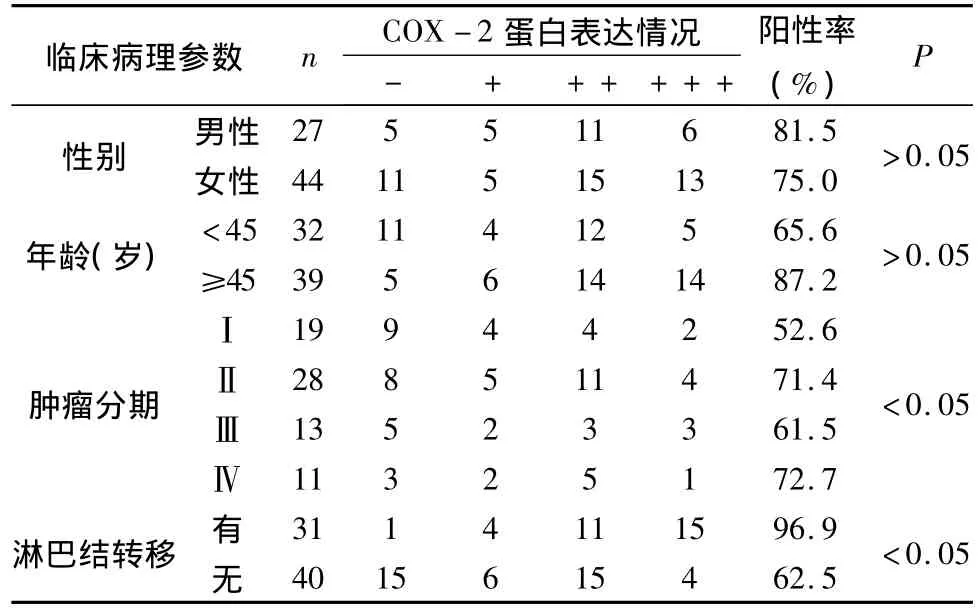
表3 COX-2蛋白表达与甲状腺癌的临床病理参数的关系
4.甲状腺癌不同病理类型VEGF与COX-2表达比较:从表4的数据可以看出VEGF蛋白的表达与甲状腺癌组织的病理分型有关,在乳头状癌、滤泡状癌、髓样癌、未分化癌中VEGF的表达阳性率分别为81.8%、68.8%、55.6%、92.3%。髓样癌的阳性率最低,4组比较,差异具有统计学意义(p<0.05)。COX-2蛋白的表达与甲状腺癌组织的病理分型有关,在乳头状癌、滤泡状癌、髓样癌、未分化癌中COX-2的表达阳性率分别为 81.8%、88.2%、77.7%、92.3%。4组比较,差异具有统计学意义(p<0.05)。
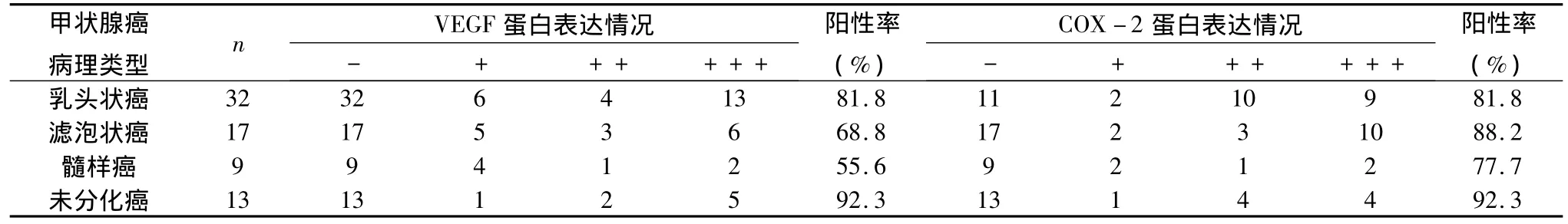
表4 甲状腺癌不同病理类型VEGF与COX-2表达比较
5.甲状腺癌中VEGF与COX-2表达相关性分析:应用Spearman等级相关分析表明71例甲状腺癌组织中VEGF和COX-2两者表达存在正相关,r=0.589,P <0.05(表 5)。

表5 甲状腺癌组织中VEGF与COX-2表达相关分析
讨 论
VEGF是一类亲肝素的蛋白多肽家族,是启动血管形成的一个高度特异的血管内皮细胞有丝分裂原,不仅对血管内皮细胞有强烈的促有丝分裂活性,还能给多种细胞的迁移提供一个纤维网络,能刺激血管内皮细胞的迁移[9]。近年来许多研究证实他是重要的血管生成刺激蛋白。VEGF可以促进血管内皮细胞的大量增殖,抑制内皮细胞凋亡,还能够增加内皮细胞的渗透性,这可以使血管周围形成纤维凝胶,诱导新生血管在甲状腺肿瘤周围形成,同时肿瘤细胞通过渗透性增大的内皮细胞能够通过血液途径转移到其他器官;VEGF血浆蛋白渗入血管外并沉积于血管周围,在其他促血管生成因子的共同刺激下形成新生血管[10]。VEGF的异常高表达与肿瘤的转移和侵袭有密切关系,是决定肿瘤生物学行为的一个重要因素。许多实验研究证实VEGF在卵巢癌、胃癌、乳腺癌、前列腺癌、结肠癌等恶性肿瘤中均有高表达,表达水平的高低也与预后和转移程度呈一定相关性。
李云龙等[11]的研究结果显示,VEGF在甲状腺乳头状癌有无淋巴结转移的两组中表达水平存在着统计学差异,有淋巴结转移的组VEGF表达水平明显增高,这也说明了VEGF在甲状腺乳头状癌的发生和发展中起重要作用。Tuttle等的研究也显示,血清VEGF水平可以作为一个分化型甲状腺癌的标志物,高水平的VEGF是疾病处于活跃期的标志,提示很可能具有高侵袭性和转移性。本研究结果显示,VEGF在乳头状癌、滤泡状癌、髓样癌、未分化癌中的阳性表达率分别为 81.8%、68.8%、55.6%、92.3%,与正常甲状腺组织相比,癌组织的VEGF阳性率明显高于正常组,且未分化癌的阳性率最高。这也说明VEGF在不同组织类型的甲状腺癌中所起的作用不同。71例甲状腺癌中有31例伴有淋巴结转移,其VEGF阳性率为90.3%,显著高于没有淋巴结转移的甲状腺癌组织。提示VEGF可以作为一个有效的治疗靶点,具有良好的应用前景。
人类COX-2是前列腺素合成的主要限速酶,它参与机体多个病理生理过程。脂多糖、癌基因、维甲酸、热休克蛋白等多种因素都可以诱导COX-2的合成。近年来,直肠癌、胃癌、乳腺癌中均发现有COX-2的高表达,揭示其可能与肿瘤的发生发展存在潜在联系。COX-2的过度表达可促进细胞增殖并且抑制细胞凋亡,使细胞增殖和凋亡之间的平衡失调,从而促进肿瘤走向恶性。Kinoshita等用COX-2 cDNA转染入人结肠癌细胞株,导致结肠癌细胞显著增殖。COX-2在多种恶性肿瘤中表达都增加,表明COX-2的高表达和恶性肿瘤的形成有关。Lim等发现96.0%的头颈部肿瘤中COX-2表达呈阳性,COX-2的阳性表达与肿瘤临床分期、组织分型和淋巴转移相关。COX-2的作用机制包括影响细胞生长增殖和分化,抑制细胞凋亡,促进肿瘤血管生成,增加肿瘤侵袭力,免疫抑制,加强致癌物的转变,促进癌基因及抑癌基因的活性改变来发挥作用[12]。
有研究显示,COX-2的可以上调MMPs的表达,降解细胞外基质,调节细胞黏附性,促使肿瘤的侵袭力增加。本研究结果显示COX-2在正常甲状腺组织中几乎不表达,甲状腺癌组织中的COX-2表达明显高于甲状腺良性肿瘤与正常甲状腺组织。COX-2蛋白在乳头状癌、滤泡状癌、髓样癌、未分化癌中表达阳性率分别为 81.8%、88.2%、77.7%、92.3%。具有淋巴转移的甲状腺癌的COX-2表达显著高于无淋巴转移的癌组织。
恶性肿瘤的发生发展受到多种基因,多种调控网络的调控[13]。本研究显示甲状腺癌中VEGF和COX-2 两者表达存在正相关,r=0.589,P <0.05。可能由于COX-2促使VEGF的表达升高,从而促进肿瘤新生血管的生长。两者呈正相关性也说明这两种蛋白在甲状腺癌的发展中起到了正协同作用,二者可能协同参与了甲状腺癌的发病进程,这将有助于加深对甲状腺癌的分子发生机制的认识。
1 Huang SM,Lee JC,Wu TJ,et al.Clinical relevance of vascular endothelial growth factor for thyroid neoplasms[J].World JSurg,2001,25(3):302-306
2 Tuttle RM,Fleisher M,Francis GL,et al.Serum vascular endothelial growth factor levels are elevated in metastatic differentiated thyroid cancer but not increased by short- term TSH stimulation[J].J Clin Endocrinol Metab,2002,87(4):1737 -1742
3 Poulaki V,Mitsiades CS,McMullan C,et al.Regulation of vascular endothelial growth factor expression by insulin-like growth factor I in thyroid carcinomas[J].JClin Endocrinol Metab,2003,88(11):5392-5398
4 Bass MB,Sherman SI,Schlumberger MJ,et al.Biomarkers as predictors of response to treatment with motesanib in patients with progressive advanced thyroid cancer[J].JClin Endocrinol Metab,2010,95(11):5018-5027
5 Gule MK,Chen Y,Sano D,et al.Targeted therapy of VEGFR2 and EGFR significantly inhibits growth of anaplastic thyroid cancer in an orthotopic murine model[J].Clin Cancer Res,2011,17(8):2281 -2291
6 Hsueh C,Lin JD,Wu IC,et al.Vascular endothelial growth factors and angiopoietins in presentations and prognosis of papillary thyroid carcinoma[J].J Surg Oncol,2011,103(5):395 - 399
7 Siironen P,Ristimaki A,Narko K,et al.VEGF-Cand COX-2 expression in papillary thyroid cancer[J].Endocr Relat Cancer,2006,13(2):465-473
8 Lee KJ,Jung YS,Kim WH,et al.Cyclooxygenase-2 expression in human thyroid disease[J].JEndocrinol Invest,2008,31(2):111 -118
9 Yates CM,Patel A,Oakley K,et al.Erythropoietin in thyroid cancer[J].J Endocrinol Invest,2006,29(4):320 - 329
10 Siironen P,Louhimo J,Nordling S,et al.Prognostic factors in papillary thyroid cancer:an evaluation of 601 consecutive patients[J].Tumour Biol,2005,26(2):57 -64
11 李云龙,周文学,高峰,等.p21-ras、p53和VEGF在甲状腺乳头状癌中的表达及意义[J].哈尔滨医科大学学报,2003,37(5):406-408
12 陈一峰,黄云鹏,苏密龙.甲状腺乳头状癌局部免疫状态的分析[J].医学研究杂志,2009,38(5):52 -54
13 崔海东,贾忠,蔡阳.甲状腺癌146例临床分析[J].医学研究杂志,2008,37(1):71-73

