海带多糖对肾上腺素代谢产物损伤血管内皮依赖性舒缩功能的影响
王界年,王圣泳,沈 斌,庞广保,韦伍英,黎木兰,封廖芸,黎 静
(广西医科大学1.2008级七年制临床医学专业学生、2.生理学教研室,广西南宁 530021)
肾上腺素(adrenalin,Adr)脱氨生成的H2O2、甲醛和甲胺等代谢产物被认为是一个引起心血管疾病的高危因子[1],是心脑血管疾病的重要诱因。因此,应激时交感神经活动增强,肾上腺髓质释放Adr增多,Adr代谢产物如H2O2、甲醛和甲胺等可以损伤血管内皮细胞(vascular endothelial cell,VEC)[2]。课题组前期研究发现,海带多糖对愤怒心理应激大鼠血管的内皮依赖性舒缩功能具有一定的调节作用[3]。本研究通过制作离体大鼠胸主动脉环,在体外分别采用H2O2、甲醛和甲胺孵育损伤血管内皮,观察海带多糖对这些血管环的内皮依赖性舒缩功能的影响,进一步探讨海带多糖对血管内皮细胞保护作用的机制。
1 材料与方法
1.1 动物与药品试剂 苯肾上腺素(phenylephrine,PE),去甲肾上腺素(norepinephrine,NE),上海禾丰制药有限公司;H2O2、甲醛(formaldehyde)、甲胺(methylamine,MA),Sigma 公司;乙酰胆碱(acetylcholine,ACh),上海三爱思试剂有限公司;海带多糖(laminar polysaccharide,LP),本实验室自行提取,其糖含量为71.0%,硫酸根含量为83.28 mg·g-1;SD大鼠♀♂各半(200~250 g,广西医科大学动物实验中心提供)。
1.2 大鼠胸主动脉环的制备及处理 大鼠颈椎脱臼处死,立刻取出胸主动脉,移至盛有冰冷Krebs-Henseleit(K-H)液的培养皿中,分离血管周围组织,剪成长度约3 mm的动脉环。用不锈钢丝小钩穿过动脉环,置于盛有K-H液的离体灌流装置中,一端与浴槽底部相连,另一端通过张力换能器与Powerlab生物信号采集系统相连,持续通入体积分数为95%O2和5%CO2的混合气体。各组血管环在浴槽中以0.5 g张力维持30 min,1.5 g张力维持90 min后,加 PE(10-6mol·L-1)刺激后,加入 ACh(10-6mol·L-1)检测血管环内皮的完整性。本研究中药物浓度均指浴槽内的药物终浓度。
1.3 实验分组
1.3.1 H2O2损伤实验 分为对照组(加入等量KH 液)、模型组(H2O2100 μmol·L-1)、海带多糖高剂量组(LP-H,H2O2100 μmol·L-1+LP 100 mg·L-1)和海带多糖低剂量组(LP-L,H2O2100 μmol·L-1+LP 10 mg·L-1)。
1.3.2 甲醛损伤实验 分为对照组(加入等量K-H液)、模型组(甲醛 1.5 μmol·L-1)、海带多糖高剂量组(LP-H,甲醛 1.5 μmol·L-1+LP 100 mg·L-1)和海带多糖低剂量组(LP-L,甲醛 1.5 μmol·L-1+LP 10 mg·L-1)。
1.3.3 甲胺损伤实验 分为对照组(加入等量K-H液)、模型组(甲胺 100 μmol·L-1)、海带多糖高剂量组(LP-H,甲胺 100 μmol·L-1+LP 100 mg·L-1)和海带多糖低剂量组(LP-L,甲胺 100 μmol·L-1+LP 10 mg·L-1)。
1.4 实验步骤 按照分组方法加药后孵育30 min,给予PE(10-6mol·L-1)刺激后加入累积浓度的ACh(10-8mol·L-1~10-4mol·L-1),每 3 min 加入一个浓度,记录血管环张力,分别计算血管的舒张百分比/%=(M-m)/(M-M0)×100%,M为PE刺激后血管环的最大收缩张力,m为某浓度ACh刺激血管环的最小舒张张力,M0为PE刺激前血管环的初始张力。换洗平衡后加入累积浓度的NE(10-9mol·L-1~10-5mol·L-1),每 3 min 加入一个浓度,记录血管环张力。分别计算血管环的收缩百分比/%=(N/n)×100%,其中N为某浓度NE刺激时的最大收缩张力,n为血管环加NE前的初始张力。
1.5 统计学处理 数据分析采用SPSS13.0软件分析系统,组间比较用单因素方差分析。
Tab 1Effect of ACh on aortic rings’endothelium dependent relaxation after H2O2is added(±s,n=6)

Tab 1Effect of ACh on aortic rings’endothelium dependent relaxation after H2O2is added(±s,n=6)
*P<0.05 vs normal group;#P<0.05 vs model group
Group Relaxation of different Ach concentration after H2O2is added/%10 -8mol·L-1 10 -7mol·L -1 10 -6mol·L -1 10 -5mol·L -1 10 -4mol·L -1 Control group 7.84 ±7.18 17.86 ±5.19 30.61 ±16.13 82.97 ±16.13 101.9 ±7.70 Model group 2.73 ±1.85 10.77 ±3.18 21.59 ±3.23 52.00 ±15.11* 73.87 ±10.60*LP-L 6.51 ±9.30 19.62 ±11.99 32.81 ±14.55 69.39 ±12.69 90.01 ±8.23#LP-H 7.94 ±8.39 20.52 ±13.92 32.73 ±16.85 78.58 ±17.00# 95.00 ±8.25#
2 结果
2.1 海带多糖对H2O2损伤血管内皮依赖性舒缩功能的影响 结果显示(Tab 1),从ACh浓度10-5mol·L-1开始,模型组的舒张反应与对照组比较明显降低(P<0.05),LP-H的舒张反应与模型组比较明显升高(P<0.05);当 ACh浓度为10-4mol·L-1时,LP-L的舒张反应明显高于模型组(P<0.05)。但各组血管环对NE引起的收缩反应差异无显著性(P>0.05)。
2.2 海带多糖对甲醛损伤血管内皮依赖性舒缩功能的影响 结果显示见Tab 2,在10-8~10-6mol·L-1浓度的ACh中,模型组的舒张反应明显高于对照组(P< 0.05);在 10-8~ 10-7mol·L-1浓度的ACh中,LP-H的舒张反应低于模型组(P<0.05)。从10-7mol·L-1浓度的 NE 开始(Tab 3),模型组的收缩反应高于对照组,而LP-L和LP-H的收缩反应低于模型组(P<0.05)。
2.3 海带多糖对甲胺损伤血管内皮依赖性舒缩功能的影响 结果表明(Tab 4),从10-5mol·L-1浓度的ACh开始,模型组的血管环舒张反应明显低于对照组(P<0.05),而LP-H的血管环舒张反应明显高于模型组(P<0.05)。从 10-7mol·L-1浓度的NE开始,模型组的收缩反应高于对照组,而LP-H的收缩反应低于模型组(P<0.05,见Tab 5)。
3 讨论
VEC可以产生和分泌多种生物活性物质调节血管的舒缩功能。当VEC损伤时,其释放的舒缩因子失衡,如释放的血管收缩因子增多而释放的舒张因子减少,从而引起血管舒缩功能失调[4]。此外,一些化学物质可以通过作用于VEC来调节血管的舒缩功能。例如,ACh可通过作用于 VEC,刺激VEC释放舒血管物质NO,使血管舒张;NE也可以通过调节VEC释放各种因子,调节血管的舒张[5]。
Tab 2 Effect of ACh on aortic rings’endothelium dependent relaxation after formaldehyde is added(±s,n=6)
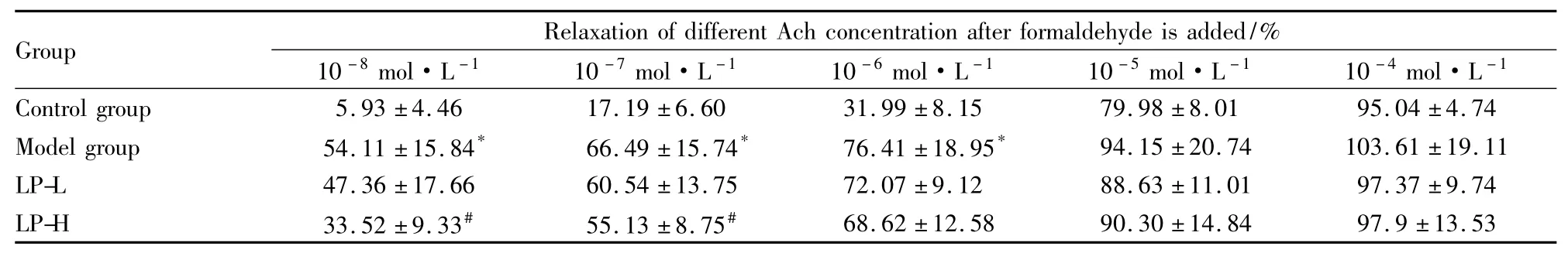
Tab 2 Effect of ACh on aortic rings’endothelium dependent relaxation after formaldehyde is added(±s,n=6)
*P<0.05 vs normal group;#P<0.05 vs model group
Group Relaxation of different Ach concentration after formaldehyde is added/%10 -8mol·L-1 10 -7mol·L -1 10 -6mol·L -1 10 -5mol·L -1 10 -4mol·L -1 Control group 5.93 ±4.46 17.19 ±6.60 31.99 ±8.15 79.98 ±8.01 95.04 ±4.74 Model group 54.11 ±15.84* 66.49 ±15.74* 76.41 ±18.95* 94.15 ±20.74 103.61 ±19.11 LP-L 47.36 ±17.66 60.54 ±13.75 72.07 ±9.12 88.63 ±11.01 97.37 ±9.74 LP-H 33.52 ±9.33# 55.13 ±8.75#68.62 ±12.58 90.30 ±14.84 97.9 ±13.53
Tab 3Effect of NE on aortic rings’endothelium dependent contraction after formaldehyde is added(±s,n=6)

Tab 3Effect of NE on aortic rings’endothelium dependent contraction after formaldehyde is added(±s,n=6)
*P<0.05 vs normal group;#P<0.05 vs model group
Group Contraction of different NE concentration after formaldehyde is added/%10 -9mol·L-1 10 -8mol·L -1 10 -7mol·L -1 10 -6mol·L -1 10 -5mol·L -1 Control group 103.91 ±2.22 125.58 ±6.91 156.85 ±11.02 173.01 ±15.41 178.47 ±14.41 Model group 102.80 ±2.86 138.75 ±20.02 188.83 ±15.48* 202.21 ±15.78* 209.20 ±16.89*LP-L 104.77 ±2.22 127.29 ±16.46 172.21 ±8.43# 188.03 ±8.67# 192.97 ±11.78#LP-H 102.58 ±2.88 125.13 ±10.39 159.66 ±13.60# 178.01 ±13.06# 184.19 ±11.03#
Tab 4Effect of ACh on aortic rings'endothelium dependent relaxation after methylamine is added(±s,n=6)

Tab 4Effect of ACh on aortic rings'endothelium dependent relaxation after methylamine is added(±s,n=6)
*P<0.05 vs normal group;#P<0.05 vs model group
Group Relaxation of different ACh concentration after methylamine is added/%10 -8mol·L-1 10 -7mol·L -1 10 -6mol·L -1 10 -5mol·L -1 10 -4mol·L -1 Control group 10.13 ±7.15 28.63 ±7.13 48.64 ±13.83 79.73 ±9.16 94.43 ±11.18 Model group 7.32 ±6.34 13.98 ±10.08 29.09 ±15.20 55.92 ±8.51* 74.92 ±6.05*LP-L 5.15 ±5.57 13.16 ±6.42 24.71 ±15.02 56.65 ±12.26 85.94 ±8.43 LP-H 10.76 ±6.21 27.97 ±9.49 38.54 ±8.82 75.76 ±8.84# 95.25 ±8.42#
Tab 5Effect of NE on aortic rings’endothelium dependent contraction after methylamine is added(±s,n=6)

Tab 5Effect of NE on aortic rings’endothelium dependent contraction after methylamine is added(±s,n=6)
*P<0.05 vs normal group;#P<0.05 vs model group
Group Contraction of different NE concentration after methylamine is added/%10 -9mol·L-1 10 -8mol·L -1 10 -7mol·L -1 10 -6mol·L -1 10 -5mol·L -1 Control group 111.22 ±18.14 107.82 ±9.87 142.18 ±19.11 163.08 ±14.49 171.64 ±11.92 Model group 105.38 ±4.97 127.53 ±21.29 172.29 ±10.18* 193.71 ±10.76* 200.92 ±11.73*LP-L 11.021 ±8.61 126.80 ±8.62 168.69 ±11.24 189.02 ±5.07 195.76 ±3.01 LP-H 104.96 ±3.58 112.05 ±3.18 153.26 ±4.54# 164.44 ±4.59# 171.67 ±3.45#
H2O2是一种氧化活性强的过氧化物,在一定条件下可分解为一些氧化活性更强的氧自由基。这些氧自由基可以使VEC膜系统发生脂质过氧化,破坏细胞的膜性系统结构,造成VEC功能障碍,分泌释放的血管舒缩因子失调,影响血管的舒缩平衡。本研究发现,H2O2孵育后模型组的舒张反应明显降低,其原因可能是由于H2O2及其分解产物损伤VEC,引起VEC功能受损,从而使其合成分泌的舒血管因子减少,导致血管舒张减弱。实验还发现,海带多糖干预后血管环的内皮依赖性舒张反应增高,提示海带多糖对H2O2体外损伤VEC具有一定的保护功能。
甲醛是弱氧化剂,其作为一种自由基,进入细胞后使VEC发生脂质过氧化的同时还抑制内皮型一氧化氮合酶(eNOS)活性表达及NO的生理活性,并诱导表达诱导型一氧化氮合酶(iNOS),从而产生过量的病理性NO,加重脂质过氧化程度,进一步导致VEC损伤[6]。本研究发现,甲醛孵育后血管环的收缩反应增强,同时低浓度的ACh使血管环的舒张效应增高,这可能与甲醛诱导产生过量的病理性NO有关。而海带多糖孵育后血管环的内皮依赖性舒张反应和收缩反应均下降,提示海带多糖可部分拮抗甲醛的损伤作用,保护VEC。
甲胺本身对VEC无直接毒性作用[7],但甲胺可通过细胞膜进入VEC和血管平滑肌细胞,在氨基脲敏感胺氧化酶催化作用下生成甲醛、H2O2和氨[6]等毒性物质,从而损伤VEC,影响血管的内皮依赖性舒张和收缩功能。本研究发现,甲胺孵育后血管环的舒张效应明显降低,收缩效应增高,而海带多糖干预后,血管环的内皮依赖性舒缩功能均得到了改善,说明海带多糖对甲胺诱导的血管内皮依赖性舒缩反应具有一定的保护作用。
综上所述,海带多糖对肾上腺素代谢产物H2O2、甲醛和甲胺所致的血管内皮依赖性舒缩功能的损伤具有一定的保护作用,其原因可能与海带多糖的抗氧化作用有关[8],其拮抗了这些代谢产物对VEC的氧化损伤,从而调节血管内皮依赖性舒缩平衡。
[1]Yu D H,Lai C T,Zuo D M.Formation of formaldehyde from adrenalinein vivo;a potential risk factor for stress-related angiopathy[J].Neurochem Res,1997,22(5):615-20.
[2]Harris K F,Matthews K A.Interactions between autonomic nervous system activity and endothelial function:A model for the development of cardiovascular disease[J].Am Psychosom Soc,2004,66(2):153-64.
[3]黎 静,谢 露,杨晓梅,等.海带多糖对愤怒心理应激大鼠血管舒缩功能影响的实验研究[J].中国药理学通报,2011,27(5):638-41.
[3]Li J,Xie L,Yang X M,et al.Effect of laminaria polysaccharide on vascular relaxation and contraction of rats induced by psychological stress of anger[J].Chin Pharmacol Bull,2011,27(5):638-41.
[4]李 磊,戴 敏.动脉粥样硬化血管内皮分泌失调与平滑肌细胞增殖[J].中国药理学通报,2010,26(2):155-8.
[4]Li L,Dai M.The cause of atherosclerosis:secretory dysfunction in vascular endothelial cells and proliferation of smooth muscle cells[J].Chin Pharmacol Bull,2010,26(2):155-8.
[5]Izumi K,Akata T,Takahashi S.The action of sevoflurane on vascular smooth muscle of isolated mesenteric resistance arteries(Part 1):role of endothelium[J].Anesthesiology,2000,92(5):1426-40.
[6]尹蔚兰,让蔚清.甲醛诱导人脐静脉内皮细胞的损伤作用及机制[D].中国优秀硕士学位论文全文数据库,2005.
[6]Yi W L,Rang W Q.Injuring effect of formaldehyde on human umbilical vein endothelial cells and its machanism[D].China Master’s Theses Full-text Database,2005.
[7]Yu P H,Zuo D M.Oxidative deamination of methylamine by semicarbazide-sensitive amine oxidase leads to cytotoxic damage in endothelial cells[J].Diabetes,1993,42(4):594-603.
[8]梁桂宁,谢 露,胡世凤,等.海带多糖对应激小鼠肾组织抗氧化能力的影响[J].现代医药卫生,2006,22(18):2783-4.
[8]Liang G N,Xie L,Hu S F,et al.Effect of laminaria polysaccharide on the stress mice kidney tissues anti-oxidant ability[J].Mod Med Health,2006,22(18):2783-4.

