毕赤酵母表面展示磷脂酶D高密度发酵优化
刘逸寒,薄嘉鑫,乔婧,张超,王建玲,路福平
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
毕赤酵母表面展示磷脂酶D高密度发酵优化
刘逸寒,薄嘉鑫,乔婧,张超,王建玲,路福平*
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
利用基因工程手段构建获得的一株细胞表面展示表达磷脂酶D的毕赤酵母工程菌株GS115/pKFS-pld,通过摇瓶单因素筛选进行发酵条件优化,确定了最佳发酵条件为:诱导产酶阶段28℃,初始pH6.5,甲醇浓度1.5%,装液量为30 mL/250 mL,250 r/min摇床培养144 h。在此优化条件下菌体量为19.6 g/L,酶活达17.8×10-7kat/g,分别是是优化前的1.38及1.44倍。同时进行了5 L规模发酵罐分批补料培养,结果表明15 mL/(L·h)速率流加甘油补料培养基6 h后,采用溶氧恒定流加法流加甲醇,诱导132 h后,菌体量及PLD活力分别达到67.4 g/L及27.3×10-7kat/g,是摇瓶发酵水平的3.44倍及1.53倍。
毕赤酵母表面展示;磷脂酶D;磷脂酰丝氨酸;发酵优化;酶活力
磷脂酰丝氨酸(Phosphatidylserine,PS)是细胞膜磷脂成分之一,自从1942年被发现以来,便以其重要的生理功能吸引着科研工作者广泛的关注。作为大脑中主要的酸性磷脂,PS可以提高脑细胞活力,改善记忆力,对预防和改善老年痴呆症具有非常显著的效果,另外对于提高大脑认知力、消除大脑疲劳、缓解精神压力和抑郁、平衡情绪也有一定疗效,近年来更是被誉为“脑专一性营养物质”[1-3],由于其独特的生理保健功能,作为一种功能性因子在食品领域拥有广阔地应用前景。
磷脂酶 D(EC3.1.4.4,phospholipase D,PLD),属于催化磷酸二脂酯键水解和碱基交换反应的一类酶的总称,分布在从细菌到高等动植物的众多生物类群中。PLD具有的转酯活性[4-5]可在高浓度丝氨酸存在条件下催化卵磷脂(PC)生成PS,目前已成为研究的热点[6]。但PLD催化反应是在两相系统中进行的,对于游离酶来讲,有机溶剂常常降低其在非水相催化中的活力,且酶的分离、再生以及循环使用均有一定的困难。酵母细胞表面展示技术可将外源蛋白基因与特定的载体基因融合后导入酵母细胞,利用酵母细胞内蛋白转运到膜表面的机制使靶蛋白固定化表达在酵母细胞表面,从而实现酶的固定化[7-8],因此利用酵母细胞表面展示PLD可有效克服上述缺点。
本试验对应用微生物与酶工程研究室前期构建获得的细胞表面展示表达PLD的重组毕赤酵母工程菌株GS115/pKFS-pld的摇瓶发酵工艺及5 L规模发酵罐发酵工艺进行研究,旨在提高PLD表达量及工程菌株生长量,为酶法转化生产PS提供基础,进一步促进PS在我国食品领域中的应用。
1 材料与方法
1.1 材料
1.1.1 菌种
细胞表面展示表达PLD的毕赤酵母工程菌株Pichia pastoris GS115/pKFS-pld,由应用微生物与酶工程研究室构建并保藏。
1.1.2 试剂
胆碱氧化酶、过氧化物酶:购自Sigma公司;磷脂酰胆碱,苯酚,4-氨基安替比林,氯仿等试剂均为国产分析纯。
1.1.3 培养基
YPD,BMGY,BMMY,BSM,补料生长培养基,甲醇诱导培养基等参考Invitrogen公司毕赤酵母表达手册。
1.2 方法
1.2.1 菌种YPD平板活化
从-70℃保存的甘油冻存管中挑取一环菌液,在YPD平板上划线后,30℃培养48 h,至单菌落出现。
1.2.2 摇瓶发酵培养
1.2.2.1 YPD种子液培养
从活化平板上挑取1环单菌落接种到50 mL YPD液体培养基中,30℃,250 r/min,培养20 h至OD600=2。
1.2.2.2 BMGY培养基富集培养
以5%接种量接种于50 mL/250 mL BMGY培养基中,30℃,220 r/min培养24 h。
1.2.2.3 BMMY培养基诱导培养
于4℃,8000 r/min离心菌体富集培养液,无菌水洗涤菌体,转接入50 mL/250 mL的BMMY培养基中,于30℃,pH 6.0,220 r/min振荡诱导培养144 h,期间每24小时加入终浓度为0.5%的甲醇。
1.2.3 5 L罐发酵培养
1.2.3.1 甘油分批培养阶段
YPD培养种子液,以5%接种量接种于装有2.5 L BSM培养基的5 L发酵罐中分批培养,28%氨水调节维持pH在最优值,30℃,通气量2.0 vvm,调节转速控制溶氧不低于30%。
1.2.3.2 甘油补料分批培养阶段
当甘油耗尽后,溶氧(DO)陡然上升,此时流加不同浓度的甘油补料生长培养基4 h~6 h。
1.2.3.3 甲醇诱导阶段
停止甘油流加后菌体饥饿生长30 min~60 min后耗尽残余甘油,采用两种不同的甲醇诱导培养基流加方式进行诱导表达培养采用。
1)溶氧恒定流加法:转速600 r/min恒定,使用恒定溶氧法,通过调节甲醇流加速度使溶氧不低于30%,诱导培养直至诱导结束。
2)甲醇恒速流加法:转速恒定600 r/min,甲醇诱导阶段开始2 h~4 h内,3 mL/(L·h)流速流加甲醇诱导培养基,2 h~4 h后,采用5.6 mL/(L·h)恒定速率流加甲醇诱导培养基直至诱导结束。
1.2.4 菌体量及酶活的测定
1.2.4.1 菌体量的测定
取发酵液离心收集菌体,PBS缓冲液洗涤菌体,真空冷冻干燥至恒重,计算单位发酵液中细胞干重(DCW)。
1.2.4.2 PLD活力的测定
酶活单位定义为:以磷脂酰胆碱为底物,在pH 6.0,37℃条件下,每秒产生1 mol胆碱所需的酶量定义为一个酶活力单位。测定方法采用胆碱显色法[9]。
2 结果与分析
2.1 毕赤酵母工程菌株摇瓶水平发酵条件优化
2.1.1 BMMY培养基甲醇添加量对菌体生长及产酶的影响
在BMMY培养基中,甲醇主要作为碳源和诱导外源蛋白表达的诱导剂。甲醇添加量对菌体生长及产酶的影响见图1。

图1 BMMY培养基中甲醇含量对GS115/pKFS-pld产酶的影响Fig.1 Effect of methanol content on the enzyme production of GS115/pKFS-pld in BMMY medium
甲醇浓度为1.5%时,PLD活力最高达到12.4×10-7kat/g,菌体量到达13.6 g/L。
2.1.2 初始pH对菌体生长及产酶的影响
毕赤酵母生长的pH范围较宽,然而表达不同的外源蛋白对最适pH的要求有差别。pH对菌体生长及产酶的影响见图2。

图2 BMMY培养基中pH对GS115/pKFS-pld产酶的影响Fig.2 Effect of pH on the enzyme production of GS115/pKFS-pld in BMMY medium
当pH为6.5,对PLD在细胞表面的展示表达最为有利,PLD活力达到13.4×10-7kat/g,菌体量到达14.8g/L。
2.1.3 诱导温度对菌体生长及产酶的影响
诱导温度对菌体生长及产酶的影响见图3。当温度为28℃时,PLD活力达到最高,为14.7×10-7kat/g。
2.1.4 装液量对菌体生长及产酶的影响
装液量对菌体生长及产酶的影响见图4。装液量为30mL时对菌体生长最为有利,菌体量达到18.6 g/L,此时PLD活力达到最高,为17.1×10-7kat/g。
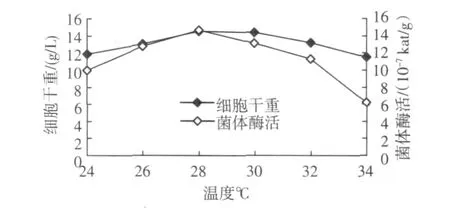
图3 温度对GS115/pKFS-pld产酶的影响Fig.3 Effect of temperature on the enzyme production of GS115/pKFS-pld

图4 装液量对GS115/pKFS-pld产酶的影响Fig.4 Effect of liquid volume on the enzyme production of GS115/pKFS-pld
2.1.5 转速对菌体生长及产酶的影响
转速对菌体生长及产酶的影响见图5。

图5 转速对GS115/pKFS-pld产酶的影响Fig.5 Effect of shaking speed on the enzyme production of GS115/pKFS-pld
当转速为250 r/min时,菌体量达到19.8 g/L,此时PLD活力达到最高,为17.8×10-7kat/g。
2.2 5 L规模发酵罐高密度发酵毕赤酵母工程菌株
2.2.1 甘油流加速度对菌体生长的影响
菌体生长24 h后以不同速度流加对菌体生长的影响见图6。选择15 mL/(L·h)的甘油流加速率。
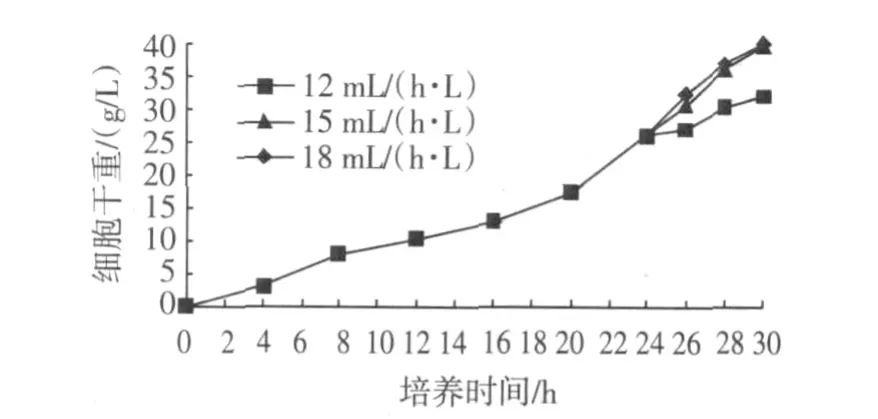
图6 不同甘油补料流速对GS115/pKFS-pld生长的影响Fig.6 Effect of glycerol feeding rates on the growth of GS115/pKFS-pld
2.2.2 甲醇流加模式对菌体生长及诱导产酶的影响
甲醇流加模式对菌体生长及产酶的影响见图7。
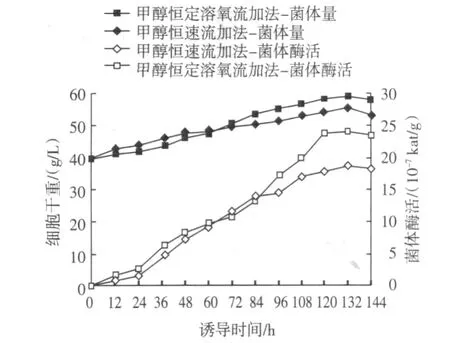
图7 不同甲醇流加模式对GS115/pKFS-pld生长和产酶的影响Fig.7 Effect of methanol feeding method on the growth and enzyme production of GS115/pKFS-pld
根据DO值调节甲醇流加速率的甲醇恒速流加法效果较好,诱导132 h后,PLD活力达到24.0×10-7kat/g,此时菌体量为59.1 g/L。DO水平表明培养过程中菌体的代谢水平,DO的变化能反应出碳源浓度的高低,这与Jimenes研究较为一致[10],依据溶氧来缓慢调节甲醇的流速,既可以满足目的蛋白表达的需要又不至于对细胞产生毒害作用,从而使酶的表达量达到较高水平。
2.2.3 5 L规模发酵罐上的发酵
以摇瓶优化结果作为参考,选取初始pH 6.5,发酵温度28℃,进行5 L规模发酵罐试验,15 mL/(L·h)速率流加甘油补料培养基6 h后,采用溶氧恒定流加法流加甲醇,结果见图8所示。
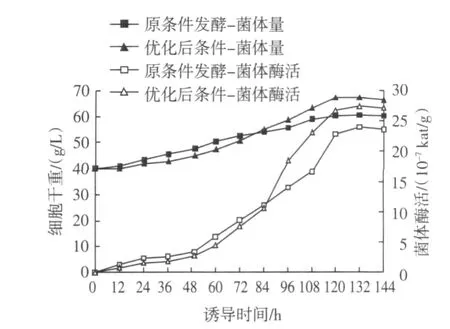
图8 5 L罐下优化前后GS115/pKFS-pld生长和产酶曲线Fig.8 The curves of growth and enzyme production of GS115/pKFS-pld before and after optimization in 5L fermentor
诱导132 h后,菌体量及PLD活力分别达到最高为67.4 g/L及27.3×10-7kat/g,与未优化条件相比(初始pH 6.0,发酵温度30℃),菌体量提高了12.9%,PLD活力提高了14.6%。
3 结论
研究细胞表面展示PLD毕赤酵母基因工程菌株最优发酵条件的目的是在菌体大量积累的情况下同时实现外源基因在酵母细胞表面的高效展示表达。通过对工程菌株发酵条件的优化,确定摇瓶培养产酶的最佳培养条件:诱导产酶阶段28℃,初始pH 6.5,甲醇浓度1.5%,装液量为30 mL/250 mL,250 r/min摇床培养144 h。在此优化条件下菌体量19.6 g/L,酶活可达17.8×10-7kat/g,分别是是优化前的1.38及1.44倍。在摇瓶条件优化的基础上,进行5 L规模发酵罐分批补料培养条件的优化,在15 mL/(L·h)速率流加甘油补料培养基6 h后,采用溶氧恒定流加法流加甲醇,诱导132 h时,菌体量及PLD活力分别达到最高为67.4 g/L及27.3×10-7kat/g,是摇瓶发酵水平的3.44倍及1.53倍。
[1]Amaducci L.Use of phosphatidylserine in Alzheimer’s disease[J].Annals of the New York Academy of Sciences,1991,640:245-249
[2]Blokland A,Honig W,Browns F.Cognition enhancing properties of subchronic phosphatidylserine treatment in middle-aged rats:comparison of bovine cortex PS with egg PS and soybean PS[J].Nutrition,1999,15(10):778-783.
[3]Brambilla F,Maggioni M.Blood levels of cytokines in elderly patients with major depressive disorder[J].Acta Polytechnica Scandinavica 1998,97(4):309-313
[4]Paola D’Arrigo,Stefano S.Using phospholipases for phospholipid modification[J].Trends in Biotechnology,1997,15(3):90-96
[5]Jae KS,Jeong JH,Joon SR.Phospholipases:Occurrence and production in microorganisms,assay for high-throughput screening,and gene discovery from natural and man-made diversity[J].Journal of the American Oil Chemists Society,2005,82(10):691-705
[6]陈石良,许正宏,孙微,等.磷脂酶D的研究进展[J].工业微生物,1999,29(4):47-50
[7]Van der Vaart J M,Biesebeke R,Chapman J W,et al.Comparison of cell wall proteins of Saccharomyces cerevisiae as anchors for cell surface expression of heterologous proteins[J].Applied and environment microbiology,1997,63:615-620
[8]Tanino T,Fukda H,Kondo A.Construction of a Pichia pastoris cellsurface display system using Flo1p anchor system[J].Biotechnology progress,2006,22:989-993
[9]Uhm T-B,Li Tao,Bao Jie,et al.Analysis of phospholipase D gene from Streptoverticillium reticulum and the effect of biochemical properties of substrates on phospholipase D activity[J].Enzyme and microbial technology,2005(37):641-647
[10]Jimenez Rodriguez E,Sánchez K,Roca H,et al.Different methanol feeding strategies to recombinant Pichia pastoris cultures producing high level of dextranase[J].Biotechnology techniques,1997,11(7):461-466
High Density Fermentation Optimization of Phospholipase D Displayed on Pichia pastoris Cell Surface
LIU Yi-han,BO Jia-xin,QIAO Jing,ZHANG Chao,WANG Jian-ling,LU Fu-ping*
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education;National Engineering Laboratory for Industrial Enzymes;Tianjin Key Laboratory of Industrial Microbiology;The College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
TheBMGY/BMMY medium and fermentation conditions of phospholipase D(PLD)displaying engineered strain Pichia pastoris GS115/pKFS-pld were optimized in single factor shake flask levels.The results indicated that the optimum fermentation conditions of GS115/pKFS-pld were the combination of the induced temperature 28℃,induced initial pH 6.5,methanol 1.5%(v/v),medium volume 30 mL/250 mL,and shaking at 250 r/min.Under these conditions,the PLD activity and DCW of GS115/pKFS-pld were significantly higher to 17.8×10-7kat/g and 19.6 g/L,which was increased by 38%and 44%,respectively,compared to the original conditions.Meanwhile,the optimization of culture conditions on GS115/pKFS-pld was scale-up in the 5 L fermentor.The biomass was rapidly enriched effectively when the glycerol fed-batch phase flow rate was setted at 15 mL/(L·h)and the flow time of glycerol was extended to 6 h,which could effectively increase the latter induced expression of PLD.By the methanol fed-batch stage using DO-stat method,the PLD activity and DCW of GS115/pKFS-pld reached 27.3×10-7kat/g and 67.4 g/L,which was 1.53 and 3.44 times of that the results in the shake,respectively.
Pichia pastoris surface display technology;phospholipase D;Phosphatidy lserine;fermentation conditions optimization;enzyme activity
*通信作者:路福平,男,教授,研究方向:应用微生物与酶工程。
“十二五”农村领域国家科技计划(2011AA100905-4);国家自然科学基金(31101219)
刘逸寒(1982—),男(汉),讲师,博士,研究方向:应用微生物与酶工程。
2011-12-10

