食管癌中MT-3基因mRNA的表达与含量差异性分析
李勇强,王智
(西安医学院第二附属医院,陕西 西安 710038)
近年来,虽然肿瘤治疗已经取得较大进展,但食管癌的预后仍然很差,5年生存率仅10%~20%。当前食管癌发病机制并未完全了解,初步研究表明食管癌的发生是多种癌基因的激活与抑癌基因的失活长期协同作用的结果[1]。金属硫蛋白(metallothionein,MT)是广泛存在于人和哺乳动物体内的一类低分子量、富含半胱氨酸的小分子金属结合蛋白,合成于肝脏,具有参与贮存、运输和代谢微量金属元素、重金属解毒、抗辐射和清除自由基、抗衰老等多种重要生物学功能[2,3]。MT-3基因的异常表达与恶性肿瘤的发生和其恶性程度关系密切[4,5]。本文为此探讨了食管癌中MT-3基因mRNA的表达与含量差异性,现报告如下。
1 资料与方法
1.1 一般资料
采用1∶1病例对照研究方法,研究对象选自2005年8月-2011年7月间我院食管癌手术就诊者30例,其中男20例,女10例,年龄27~89岁,平均54.2岁,均为食管中段癌。国际TNM分期:ⅡA期18例,ⅡB期2例,Ⅲ期6例,Ⅳ期4例。组织学分级:高分化癌20例,中分化癌2例,低分化癌8例,组织类型均为鳞癌。同时取肿瘤中心及距肿瘤边缘至少5cm的食管切缘组织,用液氮罐转入-70℃冰箱冻存。
1.2 组织RNA的提取
匀浆处理:组织取50~100mg组织加入1mL TRIzol,用匀浆仪进行匀浆处理。将匀浆样品在冰温放置5min,按照1∶0.2的比例加入氯仿,涡旋振荡15s,室温放置3min。4℃12 000r/min离心15min。把水相转移到新管中,用异丙醇沉淀水相中的RNA。加入25~200μl无RNase的水溶解RNA。
1.3 MT-3cDNA的PCR扩增
选择MT-3的mRNA第84至300位长度为217bp的片段为扩增区域,NCBI库中基因编码为:NM005954,GI:5174761。 正向引物:5'-GACCTGCCCCTGCCCTTCTGGTGG-3',反 向 引物:5'-GCTCCACACGGAGGGGTGCCTTCT-3'。反应体系:94℃5min,94℃45s,68℃45s,72℃30 s,共35个循环,72℃10min。
1.4 凝胶图像分析
用荧光化学发光凝胶成像系统分析MT-3基因电泳结果。测定扩增产物量,PCR产物量以积分光密度(IOD)表示。IOD为电泳条带平均光密度与电泳条带面积的乘积。以与GAPDH条带的IOD比值表示该组织中各MT-3基因mRNA的表达。
1.5 统计学方法
实验数据采用SPSS 18.0软件进行处理,表达情况对比采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MT-3在食管癌组织及切缘正常组织表达量统计学分析,即MT-3在食管癌组织中的表达量高于切缘正常组织(P<0.01),见表1。
表1 MT-3在食管癌组织及切缘正常组织表达量对比(±s)

表1 MT-3在食管癌组织及切缘正常组织表达量对比(±s)
组别 样本数(n)MT-3食管癌组织30 1.152±0.252切缘正常组织 30 0.893±0.189 t 4.285 P 0.000
2.2 经过统计分析,食管癌组织中MT-3的表达量与病理分期统计学分析差异有统计学意义(P<0.01),分期越低其表达量越高。食管癌组织中MT-3的表达量与分化程度统计学分析差异有统计学意义(P<0.01),分化程度越好其表达量越高,见表2。
3 讨论
食管癌是我国最常见的恶性肿瘤之一,其发生和发展与一些癌基因及其产物的表达密切相关。研究发现,食管鳞状细胞癌的肿瘤相关成纤维细胞能够分泌WNT2促进肿瘤细胞生长,这种效应是通过激活 WNT2/beta-catenin通路发挥作用的。除环境因素以外,遗传因素在食管癌的发生中也起到重要作用。研究团队发现在食管鳞状细胞癌患者中多数出现抑癌基因RBMS3的表达下调,深入研究发现,该基因可以下调c-Myc,进而影响Rb的磷酸化而发挥抑癌功能,该基因在患者肿瘤组织中的表达情况与患者的预后显著相关[6]。
表2 MT-3在不同类型食管癌组织的表达量对比(±s)
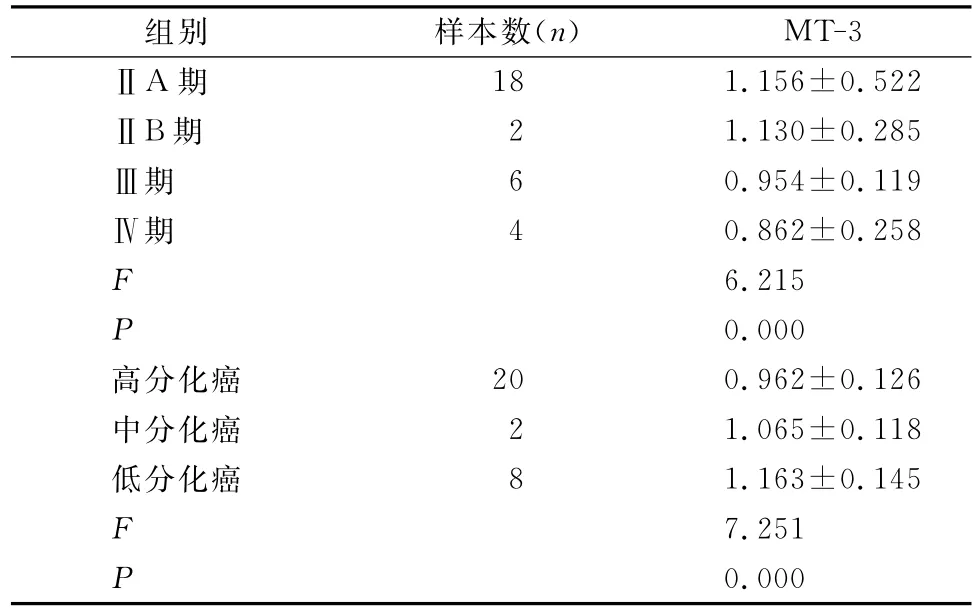
表2 MT-3在不同类型食管癌组织的表达量对比(±s)
组别 样本数(n)MT-3ⅡA期18 1.156±0.522ⅡB期 2 1.130±0.285Ⅲ期 6 0.954±0.119Ⅳ期 4 0.862±0.258 F 6.215 P 0.000高分化癌 20 0.962±0.126中分化癌 2 1.065±0.118低分化癌 8 1.163±0.145 F 7.251 P 0.000
MT-3最初发现它特异分布于中枢神经系统,是神经系统中第一个被鉴定出具有神经元生长抑制功能的蛋白[6]。近年来,MT-3的表达特点与多种肿瘤发生发展的关系逐渐引起了人们的关注。
金属硫蛋白MT的重要生理功能表现在它是一种目前为人们所知的最有效的自由基清除剂,可起到抑制癌症发生、防治肾病、消除炎症和治疗胃溃疡等作用。不同发育阶段有不同的表达模式,不受金属离子等因素的诱导[7]。这些表达特征与MT-3基因的结构密切相关[8]。
近年来越来越多的资料显示MT-3与肿瘤的关系密切,它参与了某些肿瘤的发生、发展,并且与肿瘤的分化程度有关,还与肿瘤细胞耐药性有关,影响肿瘤的治疗和预后。在除脑组织外的其他组织中MT-3首先在人类肾小管组织中发现有中到强度的表达,之后又发现在某些正常的前列腺上皮细胞中也有轻到中度的表达,在乳腺癌、膀胱癌、前列腺癌、胃癌和食管癌等中都有不同程度的表达。但MT-3在不同组织中表达所发挥致癌和抑癌作用并不相同[9],有研究在2002年发现在前列腺癌细胞株中,存在MT-3过度表达的细胞生长受到明显抑制[10]。
食管癌患者中MT存在多个基因位点的多态性,这可能影响到MT的解毒修复功能,与食管癌的易感性相关。有研究等分析了我国北方食管癌高发区70个食管癌组织标本的MT的遗传多态性,发现7例和8个密码子发生突变,其中6个产生氨基酸替换。这种替换可能改变酶的构象并削弱其活性,但在正常组织中并未发现[11]。本文结果显示,MT-3在食管癌组织中的表达量高于正常组织。同时不同病理分期与分化程度的食管癌组织中MT-3的表达量存在差异,分期越低,分化程度越好,其表达量越高。
总之,食管癌中MT-3基因mRNA的表达与正常组织表达存在差异,同时其表达受到病理分化程度与分期的影响。
[1]杨玲,李连弟,陈育德,等.中国2000年及2005年恶性肿瘤发病死亡的估计与预测[J].中国卫生统计,2005,22(4):218-231.
[2]齐健,朱尤庆.MGMT基因的多态性与肿瘤的关联[J].医学新知杂志,2003,13(4):234-263.
[3]韩艳波.冯向先,李佩珍,等.CYP1AL、GSTMI基因多态性与食管癌遗传易感性[J].中国公共卫生,2005,21(1):3-6.
[4]赵志华,李道明,张云汉,等.食管鳞癌中PTEN蛋白的表达及意义[J].河南肿瘤学杂志,2005,18(2):91-93.
[5]吴名耀,吴贤英,李乔山,等.Egr-1和PTEN蛋白的表达在食管上皮增生和癌变过程中的意义[J].癌变·畸变·突变,2006,18(4):320-322.
[6]李琴颖,王沁,严祥.食管癌中抑癌基因PTEN表达及其对血管新生的影响[J].临床内科杂志,2004,21(4):243-245.
[7]Smith E,Drew PA,Tian ZQ,et al.Metallothionien 3 expression is frequently down regulated in oesophageal squamous cell carcinoma by DNA methylation[J].Molecular Cancer,2005,4(5):42.
[8]Kagi JH,Schaffer A.Biochemistry of metallothionein[J].Biochemistry,1988,27(23):8509-8515.
[9]Miles AT,Hawksworth GM,Beattie JH,et al.Induction,regulation,degradation,and biological significance of mammalian metallothioneins[J].Cfit Rev Biochem Mol Biol,2000,35:35-70.
[10]Jayasurya A,Bay BH,Yap WM,et al.Proliferative potential in nasopharyngeal carcinoma:correlations with metallothionein expression and tissue zinc levels [J].Carcinogenesis,2000,21(10):1809-1812.
[11]Fang MZ,Jin Z,Wang Y,et al.Promoter hypermethylation and inactivation of methylguanine-DNA methyltransferase in esophageal squamous cell carcinomas and its reactivation in cell lines[J].Int J Oncol,2005,26(3):615-622.

