再生障碍性贫血患儿的环孢素群体药动学研究
张雯雯,张 华,薛 领,杜 娆,王 诚,缪丽燕*
(1.苏州大学附属第一医院药学部,苏州215006;2.苏州大学附属儿童医院药剂科,苏州215003)
[本文编辑]兰 芬
再生障碍性贫血(简称再障)是一种骨髓造血功能衰竭和外周血全血细胞减少性疾病。免疫抑制治疗是治疗再障的主要手段,临床上常用环孢素(cyclosporine,CsA)和雄性激素联合治疗,重症再障一般选择CsA联合抗淋巴细胞/抗胸腺细胞球蛋白治疗。CsA是一种钙调磷酸酶类免疫抑制剂,治疗窗窄,毒副作用大,其药动学存在较大的个体差异。目前,临床上主要通过监测CsA的血药浓度进行剂量调整,以确保用药安全和有效。影响CsA药动学的因素主要包括病人的人口学特征、病理生理状态、移植后时间、合并用药情况和遗传因素等。群体药动学能定量考察以上协变量对CsA在病人体内药动学过程的影响。目前,关于CsA的群体药动学研究主要集中在实体器官移植成年病人群体,国内外对于儿童病人的群体药动学研究较少[1,2],尤其是CsA在再障患儿的群体药动学研究尚未见报道。影响患儿药动学的因素与成人相比可能存在差异,因此有必要依据再障的疾病特征对患儿进行群体药动学研究。本研究收集再障患儿的CsA血药浓度监测数据,建立该群体的药动学模型,以期为再障患儿个体化使用CsA提供参考。
1 材料和方法
1.1 病例资料 收集94例再障患儿常规监测的194个CsA血药浓度。患儿入组标准为:年龄0~16岁,患有再障,入院后初次使用CsA。查阅患儿的病史,收集以下信息:(1)给药信息:CsA的给药剂量、给药途径、给药时间和采血时间;(2)人口学特征:包括年龄、性别和体重;(3)血常规指标:红细胞计数、血红蛋白浓度和红细胞比积;(4)生化指标:总胆红素、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总蛋白质、肌酐、尿素和尿酸等;(5)合并用药情况:是否合用激素类药物、抗真菌药等。
1.2 血样采集和浓度测定 根据临床需要,患儿初次口服CsA 给药剂量为5~8mg·kg-1·d-1,q12h,前3个月维持血药浓度100~300ng/ml,3个月之后维持血药浓度100~200ng/ml。患儿在住院期间开始服用CsA后,每隔7~21d或更长时间,于早晨服药前采外周静脉血测定CsA浓度(c0)。采用荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)在TDx仪器(美国Abbott公司)上测定CsA的全血浓度。
1.3 基因型检测 收集94例患儿的外周血样本,使用DNA提取试剂盒(美国Promega公司)提取DNA,保存于-80℃冰箱中备用。使用限制性内切酶片段长度多态性(RFLP)方法测定CYP3A5 A6986G 和 CYP3A4G82266A 基因型[3,4]。
1.4 群体药动学模型的建立 使用NONMEM软件(7.2.0版,双精度)对数据进行分析,采用一级条件估计及交互作用(first order conditional estimation with interaction,FOCE-Ⅰ )算 法,调 用ADVAN2TRANS2子程序估算CsA的群体药动学参数。
1.4.1 基础药动学模型 对94例患儿的血药浓度数据分别用单室模型和双室模型进行评价,结果发现双室模型的拟合度与单室模型相比并无明显优势,最终选择一级吸收、一级消除的单室模型为基础药动学模型。
1.4.2 统计学模型 将个体间变异模型和个体内变异模型分别用加法模型、指数模型、比例模型及其组合模型拟合比较,选择目标函数值(OFV)最小、个体变异小、估算参数合理的模型为最终统计学模型。本研究中个体间变异选择指数模型θi=θ×exp(ηi)表示,式中θi为第i个受试者的药动学参数(CL、V、Ka);θ为群体典型值;ηi为个体间变异,服从均值为0,方差为ω2的正态分布。个体内变异选择比例模型和加法模型的混合模型cij=cpredij×(1+εij1)+εij2表示,式中cij为血药浓度检测值,cpredij为模型预测值,εij1和εij2是残余误差,服从均值为0,方差分别为σ12和σ22的正态分布。
1.4.3 固定效应模型 将所选取的协变量分别以加法模型、乘幂模型或指数模型逐一引入到基础药动学模型中。引入协变量的模型与基础药动学模型的目标函数值差值(△OFV)服从F分布,近似服从χ2分布。初步筛选过程中定显著性水平α=0.05,自由度df=1。若△OFV>3.84则有显著性差异,保留此协变量,初步筛选出对CsA药动学参数有影响的协变量。然后通过有序递加法将初步筛选出的协变量按照△OFV从大到小的顺序依次加入到基础药动学模型中,定显著性水平为α=0.01,自由度df=1。若△OFV>6.64,则引入该协变量,建立全量回归模型。最后通过向后剔除法逐一剔除全量回归模型中的协变量。若△OFV>10.83(P<0.001),则保留该协变量,否则将其剔除,得到最终模型。
1.5 模型验证 采用自举法(Bootstrap)对模型进行内部验证,以评价最终模型的稳定性和准确度。本研究利用Wings for NONMEM程序,重复采样1 000次,计算自举1 000次的群体药动学参数的中位数及2.5%和97.5%百分位数,验证最终模型的稳定性。
2 结 果
2.1 基本资料 收集94例患儿的基本资料:年龄(7±3)岁,男性49例,女性45例,体重(27.3±12.6)kg,红细胞(2.5±0.5)1012/L,血红蛋白(79±16)g/L,红细胞比积(0.23±0.05)%,总胆红素(10.3±5.8)μmol/L,AST(25.9±22.6)U/L,ALT(29.2 ± 57.2)U/L,肌 酐(34.0 ±12.4)μmol/L,尿酸(209.4±74.7)μmol/L,尿素(5.98 ± 2.17)mmol/L,总蛋白质(65.6±6.9)g/L。CYP3A4*1/*1基因型有52例(55%),CYP3A4*1/*18B基因型有40例(43%),CYP3A4*18B/*18B基因型有2例(2%),CYP*1/*1基因型有6例(6%),CYP*1/*3基因型有31例(33%),CYP*3/*3基因型有57例(61%),符 合 Hardy-Weinberg平 衡。CYP3A5*3 和CYP3A4*18B等位基因发生突变的频率分别为0.77和0.23。
2.2 最终群体药动学模型 由于采样时间集中于给药前,为谷浓度点,无吸收相数据,故根据文献报道固定Ka值为0.83/h[1]。本研究经过筛选协变量,发现除年龄以外的其他协变量对药动学参数无影响,确定最终群体药动学模型为:CL=29.5×(AGE/7)0.339×exp(ηCL)。式中 AGE为年龄,ηCL是均数为0、方差为ω2的个体间变异。最终模型中,年龄是影响表观清除率(CL/F)的主要协变量,生化指标、血常规指标、合并用药和代谢酶基因多态性等其他因素对CsA药动学参数的影响无统计学意义。最终模型与基础模型相比,OFV下降了20.7,表观清除率的个体间变异由31.9%下降到27.8%,表观分布容积的个体间变异为0.14%,个体内变异为36.4%和70ng/ml。基础模型和最终模型的群体药动学参数以及自举法验证结果见表1。
2.3 模型的评价和验证 CsA浓度检测值与模型群体预测值、模型个体预测值的散点图见图1。从图1可见,预测值与检测值均较均匀地分散在对角线两侧。加权残差(WRES)位于-2.06~4.41范围内,加权残差与最终模型群体预测值、个体预测值散点图见图2。由表1可见,最终模型参数与1 000次自举法所得参数中位数比较无明显差异,最终模型参数值在自举法结果的2.5%和97.5%百分位数间,证明确立的最终模型较稳定。
3 讨 论
3.1 CsA的群体药动学参数 本研究回顾性收集了再障患儿常规CsA血药浓度监测数据和相关资料,运用NONMEM软件进行统计分析,建立该类病人的群体药动学模型。最终模型所估算的群体表观清除率(CL/F)和表观分布容积(V/F)分别为29.5L/h和419L。表观清除率估计值与成人实体器官移植病人的检测值相近,而表观分布容积的估计值则大于成人实体器官移植病人的检测值[5,6]。可能由于再障病人较肾移植病人的红细胞数偏低,而CsA在血液中与红细胞广泛结合,红细胞数低导致游离CsA浓度高,分布容积大[7]。另一原因可能是儿童的脂蛋白水平比成年人更低,则血浆蛋白结合率低,从而导致游离CsA浓度升高,分布容积增大[7]。本研究根据最终模型药动学参数得到CsA半衰期(t1/2)为9.8h,与 CsA 在儿童体内的t1/2为7~19h相一致。
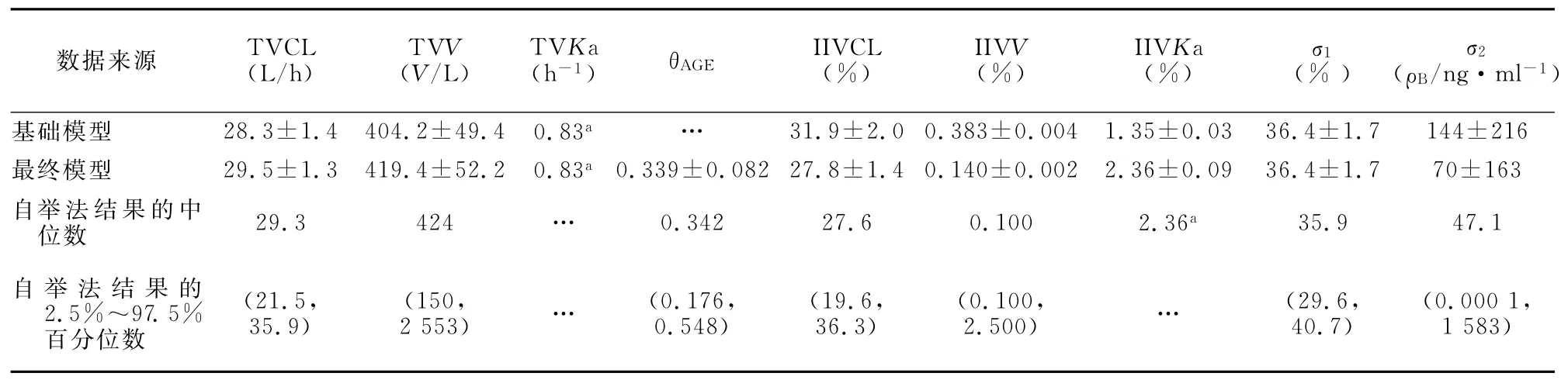
表1 环孢素群体药动学参数估计及自举法验证结果Table 1 Estimates and bootstrap validation results of population pharmacokinetic parameters of cyclosporine(n=94)
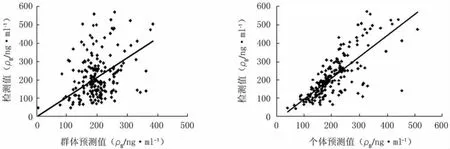
图1 最终模型环孢素血药浓度检测值与群体预测值、个体预测值的散点图Figure 1 Scatter plots of tested concentrations versus population predicted concentrations and individual predicted concentrations of cyclosporine in the final model
3.2 年龄对CsA清除率的影响 最终模型显示,随着年龄的增长,再障患儿CsA的表观清除率增加,提示临床儿童使用CsA需考虑年龄因素的影响,分析原因可能是儿童生长发育过程中机体功能的改变导致表观清除率呈现年龄依赖性。在本研究初步筛选中,体重对表观清除率有显著影响,但是在逐步筛选过程中被剔除,可能由于年龄和体重存在共线性(r2=0.702 1)。
3.3 基因多态性对CsA清除率的影响 肝药酶CYP3A5和CYP3A4基因多态性对CsA的体内代谢无影响,可能是由于儿童生长发育过程中酶活性的差异是影响药物体内代谢更主要的因素。CsA主要是由CYP3A代谢,CYP3A主要包括CYP3A4和CYP3A5。CYP3A5*3突变导致CYP3A5不表达,可能会导致CsA的代谢差异。中国人群中CYP3A4*18B突变可能与酶活性水平升高有关[4]。在本研究中,代谢酶基因多态性对CsA的药动学参数没有影响,此结果与Fanta等[2]和Turolo等[8]对肾移植儿童的研究结果一致。对成人实体器官和干细胞移植病人的研究报道有相似或者相反的结论[9,10]。儿童生长发育过程中代谢酶活性的差异可能导致代谢酶基因多态性对CsA药动学参数无影 响。Stevens 等[11]研究发现,儿童出生后CYP3A4蛋白水平逐渐增加,并且5~15岁儿童的CYP3A4蛋白表达水平低于成人;CYP3A5mRNA水平与年龄无相关性。Fakhoury等[12]研究发现,1岁儿童CYP3A4、CYP3A5mRNA水平最高,从1~17岁随着年龄增长而降低。由此也可推断,生长发育过程中CYP3A酶表达和功能的变化可能也是CsA表观清除率发生年龄依赖性变化的一个重要原因。总之,代谢酶多态性对患儿CsA浓度的影响报道较少,尚需要进一步研究确证。
由于回顾性研究的采样时间点有局限,所以数据稀疏,本研究对CsA在再障患儿中的群体药动学只做了初步分析,有待大样本数据的确证。本研究发现,年龄是影响再障患儿体内CsA代谢差异的一个主要因素,CsA表观清除率随着年龄的增长而增大。本研究结果可为再障患儿个体化使用CsA提供临床依据。
[1]Willemze A J,Cremers S C,Schoemaker R C,etal.Ciclosporin kinetics in children after stem cell transplantation[J].Br J Clin Pharmacol,2008,66(4):539-545.
[2]Fanta S,Jönsson S,Karlsson M O,etal.Long-term changes in cyclosporine pharmacokinetics after renal transplantation in children:evidence for saturable presystemic metabolism and effect of NR1Ⅰ2polymorphism[J].J Clin pharmacol,2010,50(5):581-597.
[3]Miao LiYan,Huang ChenRong,Hou JianQuan,etal.Association study of ABCB1and CYP3A5gene polymorphisms with sirolimus trough concentration and dose requirements in Chinese renal transplant recipients[J].Biopharm Drug Dispos,2008,29(1):1-5.
[4]Hu Y F,Tu J H,Tan Z R,etal.Association of CYP3A4*18Bpolymorphisms with the pharmacokinetics of cyclosporine in healthy subjects[J].Xenobiotica,2007,37(3):315-327.
[5]Wu KeHua,Cui YiMin,Guo JinFeng,etal.Population pharmacokinetics of cyclosporine in clinical renal transplant patients[J].Drug Metab Dispos,2005,33(9):1268-1275.
[6]Rosenbaum S E,Baheti G,Trull A K,etal.Population pharmacokinetics of cyclosporine in cardiopulmonary transplant recipients[J].Ther Drug Monit,2005,27(2):116-122.
[7]Cooney G F,Habucky K,Hoppu K.Cyclosporin pharmacokinetics in paediatric transplant recipients[J].Clin Pharmacokinet,1997,32(6):481-495.
[8]Turolo S,Tirelli A S,Ferraresso M,etal.Frequencies and roles of CYP3A5,CYP3A4and ABCB1single nucleotide polymorphisms in Italian teenagers after kidney transplantation[J].Pharmacol Rep,2010,62(6):1159-1169.
[9]Hesselink D A,vanGelder T,vanSchaik R H,etal.Population pharmacokinetics of cyclosporine in kidney and heart transplant recipients and the influence of ethnicity and genetic polymorphisms in the MDR-1,CYP3A4,and CYP3A5genes[J].Clin Pharmacol Ther,2004,76(6):545-556.
[10]Qiu Feng,He XiaoJing,Sun YaXin,etal.Influence of ABCB1,CYP3A4*18Band CYP3A5*3polymorphisms on cyclosporine A pharmacokinetics in bone marrow transplant recipients[J].Pharmacol Rep,2011,63(3):815-825.
[11]Stevens J C,Hines R N,Gu C,etal.Developmental expression of the major human hepatic CYP3Aenzymes[J].J Pharmacol Exp Ther,2003,307(2):573-582.
[12]Fakhoury M,Litalien C,Medard Y,etal.Localization and mRNA expression of CYP3Aand P-glycoprotein in human duodenum as a function of age[J].Drug Metab Dispos,2005,33(11):1603-1607.

