家蚕脂肪体细胞核蛋白的提取
山西 朱虹
细胞核蛋白是指在细胞质内合成,然后运输到核内起作用的一类蛋白质。核蛋白的研究在动、植物病害的防治及临床医学上有十分重要意义。在核蛋白提取的过程中,为了防止蛋白质降解和损耗,提取的步骤越少越好。我们使用各种不同的方法来摸索细胞核抽提实验的最佳方法和条件。最后我们根据2004年清华大学出版社出版,由刘进元翻译的《转录因子实用技术》一书,优化HeLa细胞核提取物的制备的方法,制备家蚕细胞核提取物。由于家蚕在5龄3天时期体内蛋白量表达最高,所以我们选择这个时期的家蚕幼虫作为材料提取细胞核蛋白。
一、家蚕脂肪体细胞核蛋白抽提方法的建立
1.实验材料
家蚕基因库5龄3天大造蚕品种雄性脂肪体。
2.所用试剂
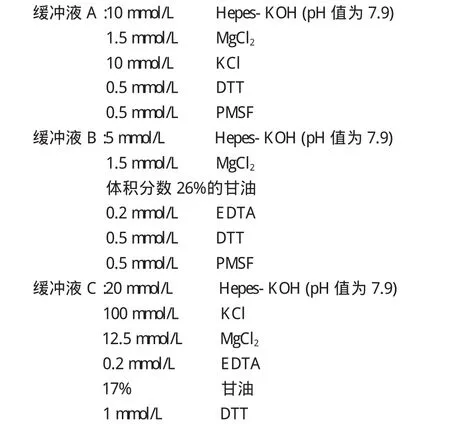
3.所用仪器
(1)20mLDounce带较松研钵的玻璃匀浆器
(2)截留分子质量为12000~14000Da的透析袋
(3)透析夹
4.实验方法
(1)取家蚕5龄3天脂肪体,加入5倍体积的缓冲液A,用匀浆器匀浆30-40下,5000 rpm离心10min。
(2)冰育10min,5000 rpm离心10min。
(3)弃去上清,用3倍体积的缓冲液A重悬浮,用匀浆器匀浆20下左右。5000 rpm离心10min以沉降细胞核。
(4)取出上清(细胞质蛋白),重悬沉降细胞核于1mL缓冲液C中,测量总体积,加NaCl至终浓度300mmol/L,采用上下颠倒方式充分混合。
(5)冰浴30min,在4℃下以15000 rpm离心20min。
(6)用500mL缓冲液C透析,第一次透析过夜,第二次透析4 h。冷冻干燥后稀释,把溶液分装,取一管用Bradford方法测定蛋白浓度,其他于-80℃储存备用。
二、家蚕脂肪体细胞核蛋白的检测
(一)Brad ford方法测定蛋白浓度
1.所用试剂:
试剂A:考马斯亮蓝G-250原液(称取100mg考马斯亮蓝G-250溶于50mL 95%的乙醇,加入100mL 85%(W/V)磷酸。
试剂B:0.01%考马斯亮蓝G-250测定工作液(将考马斯亮蓝G-250原液与双蒸水按15:85比例混匀,过滤,4℃,棕色瓶保存)
0.1 N盐酸和双蒸水(新鲜制备)
蛋白标准液:5mg/mL卵清蛋白溶液(将5mg卵清蛋白标准品溶于1 mL待测样品的溶剂体系,室温稳定2 h或者2-4℃过夜,12000g离心10 min后小量分装,-20℃保存6-8月,-80℃保存1年)
稀释液:待测样品的溶剂,小量分装,-20℃保存。
2.标准曲线的测定
(1)准备:将蛋白标准液,稀释液取出溶解;考马斯亮蓝G-250测定工作液取出恢复室温;根据测定用量新鲜准备0.1N盐酸和双蒸水。
(2)将9支干燥洁净的试管编号,按表1加入试剂,摇匀,室温放置半分钟后各管加入3.5mL考马斯亮蓝G-250测定工作液,摇匀,室温放置5 min后,以0号试管为空白调零测定其余各管595 nm处相对吸光度。
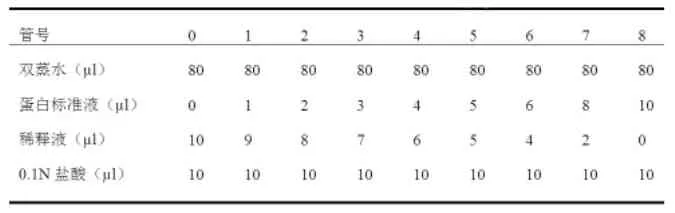
表1 标准曲线测定体系Table1 standard curve testing system
3.样品的测定
(1)在一干燥洁净试管内,先加入80μl双蒸水,再加入用稀释液调整蛋白浓度到测范围的样品10μl,加入0.1N盐酸10μl混匀半分钟后,加入3.5mL考马斯亮蓝G-250测定工作液,摇匀,室温放置5min后测定其在595 nm处相对吸光度。
(2)同(1)操作,测定两个平行样,取其平均值。
(二)SDS-PAGE电泳检测
1.待测蛋白质样品的制备
(1)向蛋白样品中加入适量的PBS,涡旋振荡重悬样品,加入1/2体积的3×上样缓冲液,混匀。
(2)100℃加热煮沸15min
(3)12000 rpm室温离心5min,取上清液进行电泳,剩余样品-20℃保存。
2.电泳槽准备
取洁净的玻璃板和凹形橡胶框等,按说明书装好电泳槽,长玻璃板下端与橡胶框底之间有一缝隙,用融化的1%的琼脂糖 (配制在电极缓冲液中)封底,待琼脂糖完全凝固后,准备灌胶。
3.垂直平板电泳胶的制备
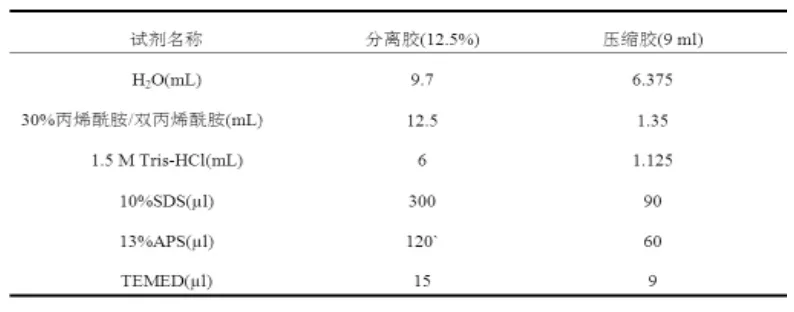
表2 SDS-PAGE凝胶组分Table2 Componentsof SDS-PAGE gel
按表2配制分离胶与压缩胶,先灌入2/3的分离胶,然后立即用水饱和的异丁醇或异戊醇封胶,封胶后保持不动。待胶凝后将封胶液倒掉,并用ddH2O冲洗干净,然后加少量0.1%的SDS,目的是通过降低张力清除残留水滴。片刻后倒掉SDS,将玻璃板倒立放置片刻。
灌好浓缩胶后1h拔除梳子,拨出梳子后用ddH2O冲洗胶孔两遍以去除残胶,随后用0.1%的SDS封胶。若上样孔有变形,可用适当粗细的针头拨正;30min后即可上样,长时间有利于胶结构的形成,因为肉眼观的胶凝时其内部分子的排列尚未完成。
4.电泳
(1)用垂直电泳槽进行电泳,上样前将胶板下的气泡赶走。
(2)用微量进样器每孔加入处理好的蛋白样品10μl,所有蛋白样品调至等浓度后上样。
(3)上槽加入200 mL 1×loading buffer,下槽加入 200 mL 0.5×loading buffer。以初始电流15mA的电流强度进行稳流电泳,当溴酚蓝带泳动至压缩胶与分离胶的界线处时,将电流升为25mA。
(4)在溴酚蓝带泳动至距胶下缘1.5 cm时结束电泳,取下凝胶进行AgNO3染色。整个电泳时间约4~5 h。
5.银染
(1)电泳后凝胶在固定液中固定1 h以上(一般过夜),不可摇动。
(2)用清洗液浸泡3次,5min~20min~5min
(3)在定影液中反应2min后,用dd H2O洗涤3次,每次5min。
(4)在染色液中反应30min,用dd H2O洗涤2次,每次20 s。
(5)在显影液中浸泡数分钟,直到显现蛋白条带。
(6)加入终止液,使反应停止。
(7)用dd H2O洗涤,凝胶在10%醋酸中保存。
(三)EMSA实验检测核蛋白活性
1.材料准备:
(1)核蛋白的准备:按标准方法提取家蚕雄性脂肪体核蛋白,并进行过夜透析,冷冻干燥,使浓度达到1μg/μl以上。
(2)探针的准备:由上海生工合成25 nt的polyURNA序列,进行5’末端标记,标记后进行纯化,并测定标记效率。
EMSA探针序列:5’UUAAUAAUAUAAGUG3’
2.EMSA结合反应:
(1)设置EMSA结合反应(如表3所示)
(2)按照反应体系加入各种试剂,在加入标记好的探针前先混匀,室温(20-25℃)放置10min,消除可能发生的探针和蛋白的非特异性结合,或者让冷探针优先反应。然后加入标记好的探针,混匀,室温(20-25℃)放置20min。
(3)电泳分析:先用200V预电泳1 h,再用200V电泳约3 h。

表3 EMSA反应体系Table3 Reaction system of EMSA
三、实验结果与分析
用大造5龄3天的脂肪体提取的细胞核蛋白抽提物经过透析、冷冻干燥后,用下列三种方法检测。首先用Bradford方法测定蛋白浓度测定,若达到1μg/μl以上再用SDS-PAGE电泳检测其纯度,提取过程中得到的细胞质蛋白做对照,得到比较纯的细胞核蛋白。最后使用EMSA方法检测其活性,得到体外剪接可用的细胞核蛋白。
(一)Brad ford方法测定蛋白浓度
按照Bradford方法测定细胞核蛋白浓度。一般情况下,最后一步加入3.5mL考马斯亮蓝G-250测定工作液时,蓝色变化越明显,浓度越高。每次测定三个值,取其均值。当浓度达到1μg/μl以上,再用SDS-PAGE电泳检测提取的纯度。
(二)SDS-PAGE电泳检测
按照细胞核蛋白提取的方法与步骤提取的蛋白,用实验方法步骤(4)中得到的细胞质蛋白作为对照,进行SDS-PAGE电泳。检测细胞核蛋白的纯度,检测结果显示如图1 A。
由图可知,提取的核蛋白纯度比较高,没有太多细胞质蛋白的混杂。
(三)EMSA检测核蛋白活性
提取的细胞核蛋白用SDS-PAGE电泳检测蛋白纯度后,进一步采用EMSA方法检测其活性,如图1B所示。

图1 A:细胞核蛋白SDS-PAGE电泳图 1,2:细胞核蛋白3:细胞质蛋白B:EMSA电泳图1:只加探针,无核抽提物 2:加标记探针和未标记探针,有核抽提物3:只加探针探针,有核抽提物Fig1 A:SDS-PAGE electropherogram of cellnucleoprotein 1,2.:cellnucleoprotein 3.:cytoplasm albumenB:EMSA electropherogram 1:added only probes,nonuclear extract 2:added labeled and non-labeled probe,with nuclearextract 3:added labeled probe,with nuclear extract
(四)细胞核蛋白抽提条件的优化
在细胞核抽提实验中,我们改进了刘进元翻译的《转录因子实用技术》中HeLa细胞核提取物的制备的方法。将前面几步中的离心速度由500 g提高到5000 rpm。
在第一次使用匀浆器时,将重悬于缓冲液中的沉淀由匀浆10个冲程提高到40个冲程,而第二次匀浆时则由10个冲程提到到20个冲程左右。这样可以充分的将细胞核裂解。匀浆的冲程次数不是绝对的,要根据自己的力度大小决定,需要在实验中慢慢摸索。
(五)细胞核蛋白提取中的关键因素
细胞核抽提物如果处理和储存得当,好的剪接提取物可保存多年。为保持最佳的活性,提取后的细胞核蛋白要分装。在提取制备后一管剪接提取物只能经历两个冻-融周期。否则会影响其剪接活性。为了从组织中制备未降解的核蛋白,起始材料最好采用新鲜的。并且整个抽提实验操作在4℃房间进行,以防止蛋白降解。在细胞核抽提实验中使用的多种化学药品是有害的,应该采用防护措施如戴上手套,穿工作服。PMSF,丙烯酰胺和甲叉双丙烯酰胺等上有毒,干燥,呈气雾状的粉末,在称重时要注意防护。短半衰期的PMSF有剧毒,在水溶液里易于处理。故在处理容器或洗涤之前,那些接触过PMSF或者丙烯酰胺的容器可用水彻底清晰。
四、结论
以家蚕脂肪体为材料提取核抽提物,SDS-PAGE电泳及迁移率变动实验表明所抽提的核提取物质量较好,可用于后续的实验。制备的细胞核提取物可用于体外剪接,及迁移率变动分析中。
[1]Ohbayashi F,SuzukiMG,Shimada T.sex determination in Bombyxmori.currentscience.2002,8,83(4):466~470.
[2]Zeltlln S,Etstrauads A.in vitro spilicing products of the Rabbit β-Globin pre-mRNA.Cell,1984,31:589.
[3]郑晓飞.RNA实验技术手册.第一版.北京:科学出版社,2004,258~259.
[4]刘进元.转录因子实用技术.清华大学出版社.2004.

