凤眼莲总黄酮微波提取工艺的研究
户 勋,余 萍,张 慾
(1.福建农林大学植物保护学院,福建福州350002;2.福建师范大学化学与材料学院,福建福州350007;3.福建农林大学计算机与信息学院,福建福州350002)
凤眼莲(Eichhornia crassipes)属雨久花科,凤眼莲属,多年生宿根浮水草本植物(Kathiresan,2000)。因其在根与叶之间有一个个像葫芦状的大气泡又称水葫芦,又名布袋莲、水浮莲、水荷花、假水仙,为漂浮生恶性杂草(Holms et al,1977)。水葫芦原产于南美,19世纪期间引入东南亚,1901年作为花卉引入中国(刁正俗,1990)。20世纪30年代,水葫芦作为畜禽饲料由台湾引入中国大陆,并作为观赏和净化水质的植物在中国南方各省推广种植,后逃逸为野生(丁建清,1995),并已扩散到温带地区,成为我国淡水水体中主要的外来入侵物种之一。凤眼莲主要在中国南方分布,由于北方河流有冻结期,凤眼莲无法在自然状态下生存。但近年来,随着全球变暖和它的自然选择进化,其危害区有向北拓展的趋势。
天然黄酮类化合物是植物体中多酚类的内信号分子及中间体或代谢物。由于黄酮类化合物广泛分布于植物中,其生理活性多种多样,引起了国内外广泛注意,研究进展很快。目前从天然产物中分离到并确定的黄酮数目达8000多种。大量研究证明:黄酮类化合物具有抗自由基、抗氧化、抗癌、抗菌、抗病毒、抗炎症、抗过敏、抗糖尿病并发症等多种生理活性及药理作用,且无毒无害,对人类的肿瘤、衰老、心血管病等疾病的治疗和预防有重要的意义。此外,还可用作食品、化妆品的天然添加剂、如甜味剂、抗氧化剂、食用色素等。因此,成为近几年研究、开发、利用的热点,其在医药、食品领域具有广阔的应用前景(屠鹏飞等,1996;陈维杻,1998;丁利君等,2002)。
黄酮类化合物的提取通常采用水提取和极性溶剂提取两种方法(Hu and Skibsted,2002)。极性溶剂易渗入至原料的内部,提取效果要好于水提取法。极性溶剂中,乙醇的食用安全性高,价格较低,可回收再利用。本文选定乙醇作为凤眼莲总黄酮的提取溶剂(李彩侠等,2006),采用微波法(王娟等,2002;范志刚等,2000)从凤眼莲干粉中提取总黄酮。因目前天然产物总黄酮的提取对热水浸提法和超声波法报道较多,而微波法方面的资料极少。因此本研究决定在微波法的基础上进行正交试验,进一步探讨微波法提取总黄酮的最佳提取条件。
1 材料与方法
1.1 试验材料
凤眼莲(Eichhornia crassipes)取自福建农林大学池塘。
1.2 试验方法
1.2.1 原料预处理 将凤眼莲整株去根、去腐败和枯黄部分后洗净晒干,用剪刀绞成小段后置于烘箱烘干,然后粉碎,再置于烘箱烘干,保存于干燥器中备用。
1.2.2 微波法提取凤眼莲总黄酮的工艺流程

1.2.3 微波法提取凤眼莲总黄酮的单因素试验 准确称取若干凤眼莲干粉于微波炉用碗(带盖)中,加入乙醇溶液,微波处理,抽滤定容,作为待测液。此项试验分别以不同的乙醇浓度、微波时间、料液比、微波火力为单因素进行。
1.2.4 凤眼莲待测液中总黄酮含量的测定
(1)分析方法与原理
采用NaNO2-Al(NO3)3-NaOH显色法测定总黄酮的含量。黄酮类化合物中含有碱性氧原子,一般又多带酚性羟基,能与金属盐类试剂如铝盐、铅盐、镁盐和铁盐等形成颜色较深的络合物,在一定波长下有最大吸收峰,在此波长下可以进行比色分析。加入的NaNO2起还原剂作用,防止黄酮类化合物受氧化而损失。
(2)芦丁标准溶液最大波长的选择
分别准确称取经105℃干燥至恒重的芦丁10 mg、15 mg、20 mg,用30%的乙醇溶解完全并定容于100 mL容量瓶中,摇匀得浓度分别为0.1 mg/mL、0.15 mg/mL、0.2 mg/mL标准溶液,备用。分别取上述芦丁标准溶液各5 mL于50 mL容量瓶中,用30%乙醇补充至20 mL,加入 NaNO2(1:20)溶液 1.5 mL,摇匀,放置5 min 后加入 Al(NO3)3(1:10)溶液1.5 mL,摇匀,放置6 min后再加入10 mL 1 mol/L NaOH溶液,摇匀,用30%乙醇定容至刻度,10 min后于紫外分光光度计450-700 nm波长范围内进行扫描,以空白试剂为参比,确定最大吸收波长λmax。
(3)乙醇提取液最大吸收波长的选择
取制备好的乙醇提取液和芦丁标准品溶液(0.1 mg/mL)各5mL分别置于2个50 mL容量瓶中,各加入30%乙醇溶液补充至20 mL,加入NaNO2(1:20)溶液1.5 mL,摇匀,放置5 min后加入Al(NO3)3(1:10)溶液1.5 mL,摇匀,放置6 min后再加入10 mL 1 mol/L NaOH溶液,摇匀,用30%乙醇定容至刻度,10 min后于波长510 nm处比色测定,参比为空白试剂。在450 nm-700 nm之间扫描其吸光度值,检测吸光度峰值出现情况。
(4)芦丁标准工作曲线的绘制
准确称经105℃干燥至恒重的芦丁5.0 mg,用30%的乙醇溶解完全并定容于50 mL容量瓶中,摇匀得浓度为0.1 mg/mL标准溶液,分别精取该芦丁标准溶液0 mL、2 mL、4 mL、6 mL、8 mL、10 mL、12 mL放入7只50 mL容量瓶中,各加入30%乙醇溶液补充至20 mL,加入NaNO2(1:20)溶液 1.5 mL,摇匀,放置5 min 后加入 Al(NO3)3(1:10)溶液 1.5 mL,摇匀,放置6 min后再加入10 mL 1 mol/L NaOH溶液,摇匀,用30%乙醇定容至刻度,10 min后于波长510 nm处比色测定,参比为空白试剂。以芦丁标准溶液的质量浓度C与吸光度A绘制标准曲线,或采用二元线性回归法求回归方程。
(5)待测液中总黄酮含量的测定
准确吸取5 mL凤眼莲总黄酮待测液置于50 mL容量瓶中,按上述方法测定其吸光度,由(4)得到的标准曲线线性回归方程计算出总黄酮的质量浓度C,再换算成凤眼莲干粉的总黄酮提取率e。

式中A为待测液定容量(mL),B为吸取测定量(mL),C为线性计算出的浓度,D为测定时定容量(mL),E为称量凤眼莲干粉量(g)。
1.2.5 微波法正交试验 取1 g凤眼莲干粉,在微波法的单因素基础上,进行进一步的正交试验,以提取液中总黄酮的含量高低为考察指标,确定凤眼莲干粉中总黄酮提取的最佳条件。
2 结果与分析
2.1 芦丁标准溶液最大波长
浓度为 0.1 mg/mL、0.15 mg/mL、0.2 mg/mL 的芦丁标准溶液经 NaNO2-Al(NO3)3-NaOH显色法后的紫外吸收光谱见图1。
从吸收光谱图1中可以看出,芦丁标准溶液在波长510 nm处具有最大吸光度,且吸收范围较宽,与文献报道一致,所以选择吸收波长510 nm作为定量测定波长。

图1 不同浓度溶液的吸收光谱Figure 1 The absorption spectrum of different concentration rutin
2.2 乙醇提取液最大吸收波长
芦丁标准品溶液制成显色检测液,检测波长的扫描从波长700 nm开始,在510 nm处出现峰值,如图2所示。乙醇提取液制成显色检测液,检测波长的扫描从700 nm开始,在510 nm处出现峰值,如图2所示。
结果表明芦丁标准品溶液和乙醇提取液制成显色检测液后最大吸收波长一致,均为510 nm,故确定510 nm为总黄酮显色检测液的测定波长。

图2 芦丁标准品与乙醇提取液显色检测液在可见光波长为450-700 nm之间扫描结果Figure 2 Results of scanning solution of sophorin standard preparation and sample at wavelength of 450-700 nm
2.3 芦丁标准工作曲线
以芦丁标准溶液的浓度C与吸光度A作图,如图3所示。用最小二乘法进行线性回归得芦丁浓度C(mg/mL)与吸光度A的标准曲线回归方程式:A=0.00128+10.75625C,相关系数R=0.99968。表明本方法线性关系良好,可作为凤眼莲总黄酮含量的测定方法。
2.4 微波法单因素试验并测定总黄酮含量
2.4.1 乙醇浓度对总黄酮提取的影响 分别准确称取1.0 g凤眼莲干粉,加入体积浓度为30%、40%、50%、60%、70%、80%、95%的乙醇溶液40 mL,在中低火档微波提取3 min。探讨乙醇浓度对总黄酮提取的影响,结果如图4所示。
总黄酮提取量在乙醇浓度为40%前上升较快,而后趋于平缓,并且当乙醇浓度过高时,提取量下降明显。这可能是因为乙醇浓度过高,在微波条件下易挥发失去,导致总黄酮溶出降低。40%与70%两处总黄酮提取量都比较高,基于节约溶剂和环保,本试验选择40%的乙醇溶液。
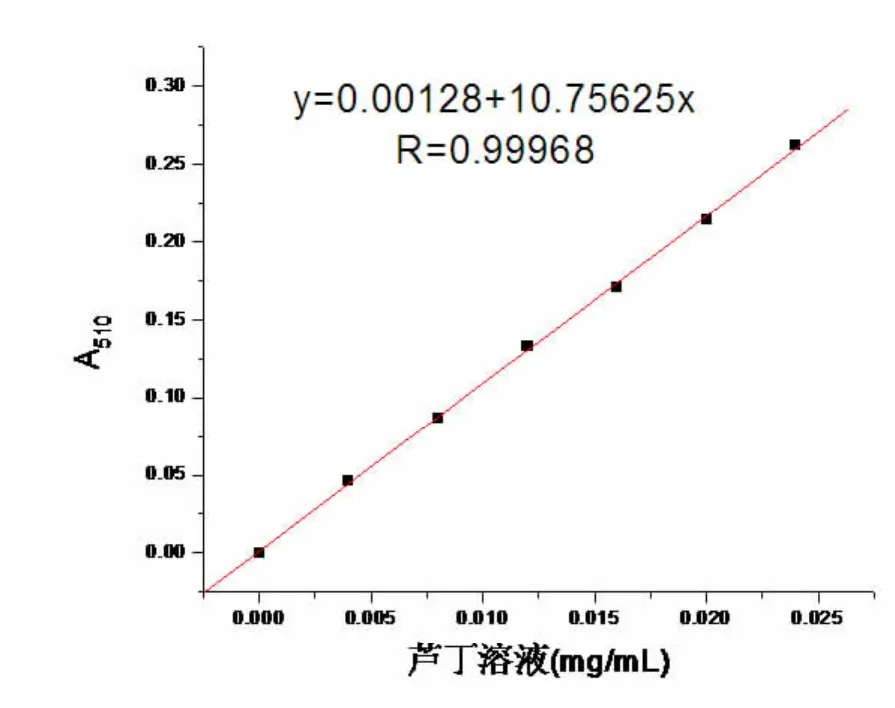
图3 芦丁标准工作曲线图Figure 3 The standard curve of rutin

图4 乙醇浓度对总黄酮提取的影响Figure 4 The influence of different density on extraction
2.4.2 微波时间对总黄酮提取的影响分别准确称取1.0 g凤眼莲干粉,加入体积浓度为40%的乙醇溶液40 mL,在中低火档微波提取 1 min、2 min、3 min、4 min、5 min、6 min、7 min。探讨微波时间对总黄酮提取的影响,结果如图5所示。
总黄酮的提取量总体上随着时间的延长而升高,在4 min时提取量最大,时间再延长呈下降趋势。这可能是由于微波时间太长引起温度升高造成乙醇挥发,以及微波对总黄酮结构破坏造成损失导致的,故以4 min为适宜微波时间。
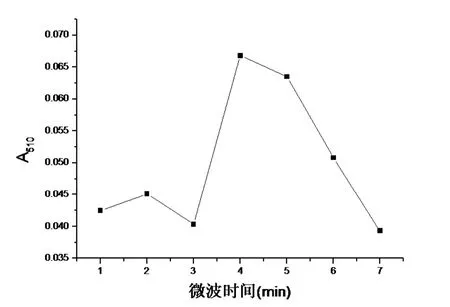
图5 微波时间对总黄酮提取的影响Figure 5 The influence of microwave time on extraction
2.4.3 料液比对总黄酮提取的影响 分别准确称取1.0 g凤眼莲干粉,加入体积浓度为40%的乙醇溶液 20 mL、30 mL、40 mL、50 mL、60 mL、70 mL、80 mL、90 mL、100 mL,在中低火档微波提取4 min。探讨料液比对总黄酮提取的影响,结果如图6所示。随着乙醇溶液体积的增大,总黄酮的提取量呈明显的上升趋势,一直到1:80后才出现平缓的走向,基于节约溶剂和回收,本试验选择了1:80为适宜的料液比。
2.4.4 微波火力对总黄酮提取的影响 分别准确称取1.0 g凤眼莲干粉,加入体积浓度为40%的乙醇溶液40 mL,在低火、中低火、中火、中高火、高火档微波提取4 min。探讨微波火力对总黄酮提取的影响,结果如图7所示。
可以看出,火力越高越不适宜总黄酮的提取,可能是由于温度过高导致溶剂损失严重反而不利于总黄酮溶出等原因引起的,故选择中低火较为适宜。
单因素试验结果表明各单因素最适宜条件如下:微波时间4 min、乙醇浓度40%、料液比1:80、微波火力 M.Low。
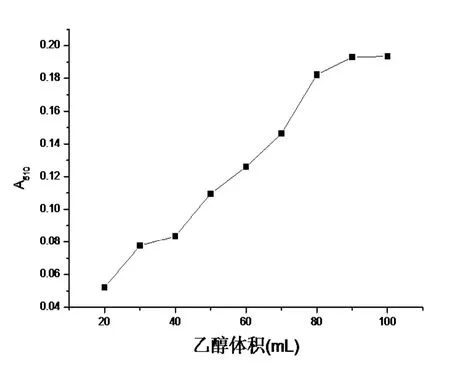
图6 料液比对总黄酮提取的影响Figure 6 The influence of solid and solution ratio on extraction

图7 微波火力对总黄酮提取的影响Figure 7 The influence of microwave firepower on extraction
2.5 微波法正交试验
2.5.1 正交试验 综合微波法单因素试验的最适宜条件,选用L9(34)表进行正交试验,以提取液中总黄酮的含量高低为考察指标,确定凤眼莲干粉中总黄酮提取的最佳条件。因素与水平设计见表1。正交试验结果见表2。

表1 L9(34)正交试验因素与水平Table 1 Factors and levels of the orthogonal experiment

表2 正交试验结果Table 2 The results of orthogonal experiment
由表2可直接看出,其中以试验号3所得的粗提液中总黄酮的含量最高,100 mL的粗提液中含总黄酮9.75 mg,即A1B3C3D3为较好的工艺。从极差R值的大小可以看出粗提液中总黄酮含量影响的大小顺序依次为B-乙醇浓度(%)、C-料液比、D-微波火力、A-微波时间(min)。因此从计算结果可以得出,A1B3C2D2为最佳条件。
由于正交表中所有的列都被因素占据,没有空白列,从而无法得到误差的估计,对于这种情况应取各列偏差平方和最小的近似当作误差的估计(上海市科学技术交流站,1975)。因素A的极差较小,所以将此列作为方差分析的误差列,对正交后的结果进行方差分析(中国科学院数学研究所统计组,1977),详见方差分析表3。
方差分析结果表明,在所设的不同水平的乙醇浓度下,其提取效果有非常显著的差异,料液比的影响达到显著水平。但A1B3C2D2不包括在正交试验设计表内,因此通过验证试验证明该条件下所得的总黄酮含量是否比试验号3更高。

表3 方差分析Table 3 Variance analysis
2.5.2 乙醇浓度对总黄酮提取的影响 在A1B3C2D2工艺下验证试验,结果见表4。

表4 验证试验Table 4 The result of verifiability test
在A1B3C2D2工艺下,100 mL的粗提液中总黄酮平均含量为9.76 mg,比试验号3提高了0.103%,进一步确定了凤眼莲总黄酮提取的最佳条件是A1B3C2D2,即微波时间2 min,乙醇浓度50%,料液比1:80,微波火力M.Low。
3 讨论
本文中微波法提取时间比文献热水浸提法、超声波法明显缩短(余芳丽等,2008),原因可能是微波火力比超声波猛烈,很快就能提取出大量总黄酮,比较节省时间。目前天然产物总黄酮的提取对热水浸提法和超声波法报道较多,微波法提取时间短,对器皿的要求也不高,具有较高的研究价值。对微波法的正交试验探讨,得出最佳条件是A1B3C2D2与单因素试验最佳条件很接近,只是在微波时间上略有不同。
1.确定了以芦丁标准品为对照品的可见分光光度计法测定总黄酮含量,其检测波长为510 nm;回归方程为:A=0.00128+10.75625C,相关系数 R=0.99968。
2.通过对影响总黄酮的因素进行微波正交试验和影响因素分析,结果表明乙醇提取凤眼莲中总黄酮的微波法最佳工艺条件为:微波时间2 min,乙醇浓度50%,料液比1:80,微波火力M.Low。
陈维杻.1998.超临界流体萃取的原理和应用.北京:化学工业出版社.
刁正俗.1990.中国水生杂草.重庆:重庆出版社.
丁建清.1995.生物防治:杂草综合治理的重要内容.杂草学报,9(1):60-64.
丁利君,吴振辉,蔡创海,黄晓珊.2002.菊花中黄酮类物质提取方法的研究.食品工业科技,23(2):25-29.
范志刚,麦军利,杨莉斌,匡丽萍.2000.微波技术对雪莲中黄酮浸出量影响的研究.中国民族医药杂志,6(1):43-44.
户勋.2008.凤眼莲总黄酮的提取分离及部分生物活性研究.福建福州:福建师范大学.
李彩侠,张赟彬,吴亚卿.2006.荷叶中黄酮类化合物的提取工艺研究.上海理工大学学报,28(1):5-8.
上海市科学技术交流站.1975.正交试验设计法.上海:上海人民出版社.
屠鹏飞,胡迎庆,刘江云.1996.越桔属植物的化学成分与开发价值.中草药,27(9):565-568.
王娟,沈平孃,沈永嘉.2002.葛根中有效成分的微波辅助萃取研究.中国医药工业杂志,33(8):382-384.
余芳丽,余萍,户勋,方一泓.2008.凤眼莲总黄酮最佳提取条件的探讨.生物技术,18(2):51-54.
中国科学院数学研究所统计组.1977.方差分析.北京:科学出版社.
Holms LG,Plucknett DL,Pancho JV,Herbiger JP.1977.The world's worst weeds:distribution and biology.18th edn.Honolulu:Hawaii University Press.
Hu M and Skibsted LH.2002.Antioxidative capacity of rhizome extract and rhizome knot extract of edible lotus(Nelumbo nuficera).Food Chemistry,76(3):327-333.
Kathiresan RM.2000.Allelopathic potential of native plants against water hyacinth.Crop Protection,19:705-708.

