氟离子掺杂和吸附对二氧化钛光催化活性的影响
高岳君 许宜铭
(浙江大学化学系,杭州310027)
氟离子掺杂和吸附对二氧化钛光催化活性的影响
高岳君 许宜铭*
(浙江大学化学系,杭州310027)
已有文献报道,在二氧化钛的体相和表面分别掺杂和吸附氟离子,都能加快水中有机化合物的光催化降解.前者归结于表面形成的三价钛离子促进光生载流子分离,后者归结于双电层中的氟离子促进羟基自由基脱附.但是,有关它们之间的活性差异未见有文献报道.本文采用水热法,以钛酸丁酯和氟化铵为原料,合成出具有不同氟离子掺杂量的光催化剂.通过苯酚降解反应,研究氟化钠和硝酸银外部加入对这些催化剂光催化性能的影响.结果表明:无论是处于二氧化钛的体相,还是处于二氧化钛的双电层外层和内层,这些氟离子都能促进苯酚的光催化降解.但是,它们的相对活性依次降低.此外,在催化剂的水悬浮液中,同时加入硝酸银和氟化钠,能进一步加快苯酚的光催化降解,且该反应的速率远远大于单独加入氟化钠或硝酸银时的速率总和.这说明将导带电子的还原过程和价带空穴的氧化过程耦合起来,是提高二氧化钛光催化量子效率的有效途径.
光催化;二氧化钛;氟离子;掺杂;吸附
1 引言
许多研究结果表明,以TiO2为代表的半导体光催化技术有望被用于降解和消除环境的有机污染物.1-4这是因为半导体光催化体系在光激发下能够产生导带电子、价带空穴、超氧自由基(O2-•)、羟基自由基(·OH)等多种活性物种,进而引发各种有机化合物降解,且该过程能在常温常压下发生.遗憾的是,半导体的光生载流子寿命较短,极易复合,从而导致有机物的降解效率普遍较低.例如,目前最好的环境光催化剂当数德国Degussa公司生产的P25 TiO2.但是,它对光催化降解水中苯酚的量子效率只有0.14(激发波长为365 nm).5
为了提高有机物的光催化降解效率,人们开展了大量的研究工作.例如,2000年Minero等6,7发现,在TiO2的酸性水悬浮液中加入NaF(记为F/TiO2),能够显著加快苯酚在水中的光催化降解.他们认为,这是因为氟离子取代了TiO2表面羟基,从而迫使光生空穴氧化溶剂水分子产生了比表面束缚态·OH的化学活泼性更高的游离态·OH.随后,这一现象得到了许多研究工作者的证实.8-16通过对不同TiO2催化剂的研究,我们发现,该过程不一定需要氟离子表面吸附.17为此,我们提出了氟离子能够促进表面·OH脱附的双电子层机理,较为圆满地解释了文献中所有的相关现象.另一方面,Yu等18,192002年发现,在TiO2晶格中掺杂氟离子(记为F-TiO2),也能提高气相丙酮光催化分解效率.他们提出,氟离子掺杂产生了Ti3+表面态,20该表面态能够捕获光生电子,从而抑制光生载流子的复合,提高光催化体系的量子效率.在F/TiO2和F-TiO2体系中,氟离子都非常稳定,难以被光生空穴等活性物种氧化.
综观光催化的研究历史,我们认为,以上的氟离子效应值得深入研究.虽然人们对TiO2进行了各式各样的体相掺杂和表面修饰,3但是它们对TiO2光催化活性的影响都低于氟离子.根据Yu等18的报道,在F/TiO2催化剂表面,实际上也存在一定量的吸附态氟离子.也就是说,关于F/TiO2光催化活性高于TiO2的现象还需要进一步加以澄清.为此,本文比较了F/TiO2和F-TiO2之间的相对光催化活性,这方面的研究尚未见文献报道.
2 实验部分
2.1 试剂与仪器
钛酸正丁酯、氟化铵、硝酸银等均为分析纯,2, 5-二甲基吡咯啉-1-氮氧化物(DMPO)购于美国的Sigma公司.所有实验用水均为去离子水.采用Yu等18报道的方法,合成具有不同氟离子含量的F-TiO2催化剂.室温下,将17.0 mL钛酸正丁酯与5.0 mL乙醇混合.在磁力搅拌下,加入NH4F固体,使F与Ti的原子比(x)为0、0.1、0.3、0.5、1.0、3.0,所得固体被记为xF-TiO2.然后,加入100 mL水和少量浓硝酸,调节pH值等于1.0,80°C搅拌8 h.旋转蒸发除去溶剂后,水洗涤至中性,95°C干燥过夜,再在450°C下煅烧12 h.
用日本Rigaku公司D/max-rA型X射线粉末衍射仪分析固体物相组成.根据最强的衍射峰和Scherrer公式,计算出相应晶体的平均粒径.用美国Micromeritics公司ASAP2020型吸附仪,以N2为吸附剂,测定固体的比表面积和总孔体积.这些固体物理参数列于表1.用美国Perkin Elmer公司PHI-5000C型光电子能谱仪,测定元素的结合能,并以C 1s结合能284.8 eV校正能谱尺寸.用瑞士Bruker公司A300型电子顺磁共振仪,以DMPO为捕获剂,测定光催化体系产生的·OH.
2.2 光催化实验和分析
在自制的80 mL普通玻璃反应器中,加入50 mg催化剂和50 mL 0.40 mol·L-1苯酚水溶液,并在暗箱中搅拌1 h,使之达到吸附平衡.用主发射波长等于365 nm的高压汞灯(300 W,上海亚明)从外部照射反应器.在光照过程中,反应器接循环冷却水,磁力搅拌,悬浮液暴露于空气之中.每隔一定时间,取出2.5 mL悬浮液,经滤膜(0.45 μm)过滤.用美国Agilent公司P680高效液相色谱仪,分析滤液中的有机物浓度.色谱柱为美国Apollo公司C18反向柱,淋洗液为体积比等于6:4的甲醇-水混合液,流速为1 mL·min-1.用美国Agilent公司的8453型UV-Vis分光光度计,测定溶液的吸收光谱.采用二甲氨基亚苄基若丹宁显色法,21测定银离子浓度,检测波长等于467 nm.采用美国Dionex公司的ISC90型离子色谱仪,测定溶液中的氟离子浓度.

表1 氟掺杂二氧化钛的物理参数Table 1 Physical parameters of fluorine-doped titanium dioxide
3 结果与讨论
3.1 催化剂表征
根据表1所列数据,空白样品(0F-TiO2)同时显示锐钛矿、金红石和板钛矿三个晶相,其中锐钛矿占83%.当样品含有氟离子时,板钛矿消失,而金红石和锐钛矿的比例分别下降和上升.当F/Ti原子比等于和大于0.3时,样品仅出现锐钛矿相.与此同时,随着F/Ti原子比的增大,样品的比表面积逐渐减小.这些变化趋势与Yu等18报道的基本一致.在合成过程中,钛酸丁酯水解较快,氟离子有可能吸附在其微粒表面,从而抑制了板钛矿和金红石相的生长.此外,混合物的pH值也随NH4F加入量的增大而上升.这将进一步加快钛酸丁酯水解,从而影响晶体生长.
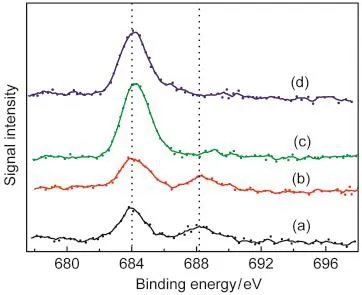
图1 氟掺杂二氧化钛样品的XPS谱图Fig.1 XPS spectra of F-doped TiO2samples (a)0.1F-TiO2,(b)0.3F-TiO2,(c)0.5F-TiO2,(d)1.0F-TiO2
为了解氟离子在样品中的存在状态,我们测定了固体样品的F 1s的光电子能谱(XPS),结果列于图1.对于氟离子含量较低的样品,分别在684.1和 688.2 eV处出现了两个XPS吸收峰.前者归属于吸附于TiO2表面的氟离子,12,14,18而后者则被认为是处于TiO2晶格上的氟离子.18,19,22-24当F/Ti原子比大于0.3时,样品仅在684.1 eV处出现一个XPS吸收峰.由此可见,只有当NH4F用量较少时,氟离子才能进入TiO2晶格,生成TiO2-xFx固溶体.18,20当NH4F用量较大时,氟离子基本上吸附于固体表面,且其表面浓度几乎与NH4F用量成正比.在相关文献中,18-20这种现象未见报道.
3.2 氟掺杂TiO2的光催化活性
图2是苯酚在水溶液中光催化降解的实验结果.随着光照的进行,苯酚的浓度逐渐下降.该浓度与时间的变化关系符合一级动力学速率方程,由此得到相应的表观速率常数(kobs).由于苯酚不发生直接光解,它在催化剂上的吸附也非常微弱,因此,我们依据kobs数值评判了不同催化剂的相对光催化活性.结果表明,随着固体F/Ti原子比的增大,催化剂的光催化活性出现了先增大后下降的趋势.其中, 0.1F-TiO2的光催化活性最高.当F/Ti原子比大于0.3时,F-TiO2的光催化活性反而低于未掺杂的TiO2.这一变化趋势与Yu等18在气相光催化降解丙酮过程中观察到的基本一致.但是,本文观察到的最佳F/Ti原子比只有Yu等18报道的10%.这可能是由于采用了不同的光催化剂评价方法所致,或是由于具体的催化剂制备条件不同所致.本文也采用了4-氯苯酚和2,4,6-三氯苯酚作为底物分子,所得到的催化剂相对光催化活性基本上与图2相似.
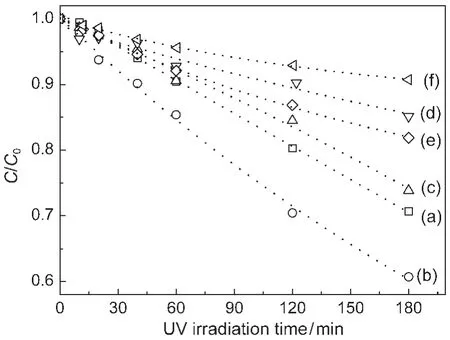
图2 氟掺杂二氧化钛样品光催化降解苯酚Fig.2 Photocatalytic degradation of phenol over F-doped TiO2samples(a)TiO2,(b)0.1F-TiO2,(c)0.3F-TiO2,(d)0.5F-TiO2, (e)1.0F-TiO2,(f)3.0F-TiO2
有趣的是,不同催化剂的相对光催化活性与它们的晶格氟浓度存在一定的相关性.随着F/Ti原子比的增大,晶格氟的XPS信号强度逐渐减弱(图1).当F/Ti原子比大于0.3时,晶格氟的XPS信号几乎不出现.也就是说,处于TiO2晶格上的氟离子可能对光催化反应具有促进作用.由于这些催化剂具有不同的比表面积,我们又将kobs除以SBET.但是,所得到的单位比表面的反应速率随F/Ti原子比的变化趋势与图2基本一致.因此,可以认为,TiO2骨架上的氟离子对光催化反应确实具有正效应,18催化剂的比表面不是主要的影响因素.
Yu18和Czoska20等认为,F-TiO2的光催化活性高于TiO2是由于在其表面形成了Ti3+的缘故.该表面态的能级低于TiO2的导带,从而能捕获导带电子,提高光生载流子的分离效率.如果该机理成立,则价带空穴氧化表面羟基或水的速率也会相应增大.为此,我们采用DMPO-EPR捕获技术,比较了0F-TiO2和0.1F-TiO2光催化产生·OH的相对活性.如图3所示,在紫外光作用下,这两个光催化体系都出现了DMPO-OH加合物的特征四重峰.25但是,0.1F-TiO2产生的自由基峰强度要高于0F-TiO2.并且,光照时间越长(0-500 s),该差别就越明显.这或许表明,氟离子掺杂TiO2确实也加快了空穴氧化反应,从而加快了羟基自由基的产生和目标有机污染物的降解.
3.3 外部加入NaF对光催化的影响
许多研究结果表明,在TiO2的酸性水悬浮液中加入NaF,能够显著加快光催化产生·OH和降解有机物.6-16为此,我们考察了NaF后,F-TiO2光催化过程的影响.图4为加入NaF后光催化降解苯酚的结果.由图4可见,在它的水悬浮液中加入NaF,也能加快苯酚的降解.这说明氟离子掺杂确实加快了光催化产生·OH(图3).但是,这种因外加氟离子引起的活性增强幅度与催化剂原来的活性几乎成正比.这是因为苯酚的降解是半导体光催化引起的,外部NaF只是起到了促进表面羟基自由基脱附的作用.因此,苯酚降解的快慢应该首先取决于催化剂本身的光催化活性.

图3 紫外光光照产生DMPO-OH的ESR谱图Fig.3 ESR spectra of DMPO-OH under UV light
由于外加NaF能提高F-TiO2的光催化活性,我们需要测定F-TiO2在水中的溶解度.离子色谱分析表明,在0.1F-TiO2和0.3F-TiO2的水悬浮液中(1.0 g· L-1),溶解出的氟离子浓度分别只有11.0和6.4 µmol·L-1.对比实验表明,在这两个催化剂的水悬浮液中加入10µmol·L-1NaF,并没有对苯酚的光催化降解速率产生明显的影响.因此,我们认为, 0.1F-TiO2的光催化活性高于0F-TiO2,并不是由于催化剂溶解氟离子造成的.
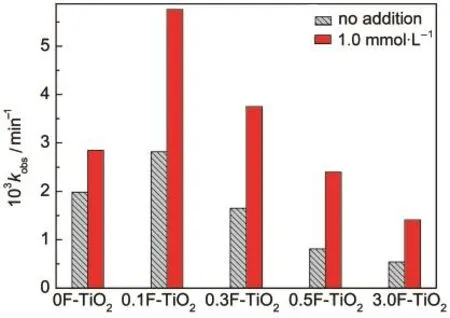
图4 加入NaF对光催化降解苯酚的影响Fig.4 Effect of NaF on the photocatalytic photodegradation of phenol
以上结果表明,无论是在溶液中还是在TiO2的晶格和表面,三种氟离子都能加快光催化反应.现在的问题是,它们中哪一种氟离子产生的正效应较大?首先,根据图1和图4,我们可以判断,处于TiO2晶格上的氟离子产生的正效应要高于在催化剂表面吸附的氟离子.第二,在本文的所有实验中,催化剂浓度均为1.0 g·L-1.对于0.1F-TiO2来说,这相当于氟离子最大浓度等于1.2 mmol·L-1.根据XPS分析,晶格氟在该样品中的含量大约等于氟离子总量的45%.但是,在光催化降解苯酚的过程中,它的活性几乎等于0F-TiO2和1.0 mmol·L-1NaF混合体系的活性(图4).也就是说,浓度最多等于0.5 mmol·L-1的晶格氟离子对光催化的影响相当于浓度等于1.0 mmol·L-1的外加NaF.离子色谱分析表明,氟掺杂几乎不影响TiO2对水中氟离子的吸附.例如,在1.82 mmol·L-1NaF的水溶液中,催化剂 0F-TiO2、0.1F-TiO2和0.3F-TiO2对氟离子的吸附量分别等于0.116、0.123和0.116 mmol·g-1.因此,我们认为,处于TiO2晶格上的氟离子对光催化的影响要大于溶液中的氟离子.第三,在本文实验条件下(pH~5.5),氟离子在F-TiO2上的吸附非常微弱.但是,外加1.0 mmol·L-1NaF确使F-TiO2的光催化活性增加了一倍以上(图4).Minero等6,7认为,NaF的正效应是由于氟离子取代TiO2表面羟基造成的.但是,我们的前期研究表明,这不一定需要氟离子吸附在TiO2表面.相比之下,处于表面双电层内的氟离子要比吸附在表面Ti(IV)上的氟离子产生的正效应更大.这是因为前者比前者更易与表面羟基自由基形成氢键,从而更能促进表面·OH脱附和加快有机物降解.因此,根据氟离子效应的双电层机理,17我们认为氟离子对TiO2光催化产生正效应的相对大小为:晶格氟离子>双电层外层氟离子>表面吸附态氟离子.我们的近期工作表明,26将少量难溶于水的CaF2或氟磷酸钙与TiO2混合,也能加快苯酚和氯苯酚的光催化降解.但是,有机物降解速率的提升幅度并不大(约40%),这或许也是由于F-与Ca2+成键后不易与表面·OH形成氢键的缘故.
3.4 外部加入AgNO3对光催化的影响
以上的光催化反应都是在空气饱和的悬浮液中进行.如果催化剂对水中溶解氧的吸附存在差异,这将会影响对不同催化剂之间相对光催化活性的正确评价.27有文献报道,11,28,29氟离子体相掺杂和表面吸附可能会降低TiO2的平带电位,从而影响催化剂的表面电荷转移.为此,我们改用银离子作为氧化剂.这是因为银离子在催化剂表面的吸附量容易被测定,这将使我们能够在相同的表面电子捕获剂浓度下,比较不同催化剂之间的相对光催化活性.与此同时,银离子比氧气具有更正的单电子氧化还原电位,因此它加快TiO2价带电子的还原过程,从而减少因平带电位变化带来的可能影响.
与在空气中进行的反应相比(图5(a)),在高纯N2保护下,加入AgNO3能显著加快苯酚的降解(图5 (b)).与此同时,Ag+被还原,生成了灰色的银颗粒,导致苯酚降解速率逐渐下降.因此,图5(b)所列的苯酚降解速率常数来源于反应初期苯酚浓度随时间的变化.如图5(a)和5(b)所示,采用不同的氧化剂并没有改变催化剂之间的相对光催化活性.对照实验表明,Ag+本身不能氧化苯酚;在0F-TiO2和0.1F-TiO2催化剂表面,Ag+的吸附量也几乎相同.也就是说,处于TiO2晶格上的氟离子确实能够提高催化剂的光催化活性.

图5 加入AgNO3和NaF对光催化降解苯酚的影响Fig.5 Effect ofAgNO3and NaF on the photocatalytic degradation of phenolc(AgNO3)=1.0 mmol·L-1;c(NaF)=1.0 mmol·L-1
从反应机理来说,银离子和氟离子分别加快了导带电子还原和价带空穴氧化过程.如果将两者结合起来,可能会进一步加快体系中有机物降解.如图5(c)所示,在NaF和AgNO3共同存在下,苯酚降解速率确实远大于单独使用NaF(图4(b))和AgNO3(图5(b))时的苯酚降解速率之和,并且不同催化剂表现出的相对活性也与在氧气中得到的相对活性几乎相同.这不仅证实了以上结论的可靠性,而且它也清楚地表明,如果将导带电子还原和价带空穴氧化二个过程耦合起来,将能大幅度提高半导体光催化的效率.
4 结论
对比较氟离子体相掺杂和表面吸附对TiO2光催化降解有机物的影响.相比之下,体相掺杂的氟离子对TiO2光催化过程的促进作用要大于表面吸附的氟离子,而处于催化剂表面双电层外层的氟离子又大于表面吸附的氟离子,后者正好与我们过去的假设一致.17此外,本文的研究还表明,如果在催化剂表面增加O2浓度,并通过氟离子掺杂或氟离子外部加入,将能发掘出TiO2原有的光催化活性,显著提高光催化体系的量子效率.
(1) Xu,Y.M.Prog.Chem.2009,21(2-3),524.[许宜铭.化学进展,2009,21(2-3),524.]
(2) Thompson,T.L.;Yates,J.T.Chem.Rev.2006,106,4428.
(3) Carp,O.;Huisman,C.L.;Reller,A.Prog.Solid State Chem. 2004,3,33.
(4)Hoffmann,M.R.;Martin,S.T.;Choi,W.;Bahnemann,D.W. Chem.Rev.1995,95,69.
(5) Emeline,A.V.;Zhang,X.;Jin,M.;Murakami,T.;Fujishima,A. J.Phys.Chem.B 2006,110,7409.
(6) Minero,C.;Mariella,G.;Maurino,V.;Pelizzetti,E.Langmuir 2000,16,2632.
(7) Minero,C.;Mariella,G.;Maurino,V.;Vione,D.;Pelizzetti,E. Langmuir 2000,16,8964.
(8) Mrowetz,M.;Selli,E.Phys.Chem.Chem.Phys.2005,7,1100.
(9) Mrowetz,M.;Selli,E.New J.Chem.2006,30,108.
(10) Park,H.;Choi,W.J.Phys.Chem.B 2004,108,4086.
(11) Lee,J.;Choi,W.;Yoon,J.Environ.Sci.Technol.2005,39,6800.
(12) Park,H.;Choi,W.Catal.Today 2005,101,291.
(13) Kim,H.;Choi,W.Appl.Catal.B 2006,69,127.
(14) Janczyk,A.;Krakowska,E.;Stochel,G.;Macyk,W.J.Am. Chem.Soc.2006,128,15574.
(15) Jiang,J.J.;Long,M.C.;Wu,D.Y.;Cai,W.M.Acta Phys.-Chim.Sin.2011,27(5),1149.[蒋晶晶,龙明策,吴德勇,蔡伟民.物理化学学报,2011,27(5),1149.]
(16) Lv,K.L.;Xu,Y.M.J.Phys.Chem.B 2006,110,6204.
(17)Xu,Y.M.;Lv,K.L.;Xiong,Z.G.;Leng,W.H.;Du,W.P.;Liu, D.;Xue,X.J.J.Phys.Chem.C 2007,111,19024.
(18)Yu,J.M.;Yu,J.G.;Ho,W.K.;Jiang,Z.T.;Zhang,L.Z.Chem. Mater.2002,14,3808.
(19) Ho,W.K.;Yu,J.C.;Lee,S.C.Chem.Commun.2006,1115.
(20) Czoska,A.M.;Livraghi,S.;Chiesa,M.;Giamello,E.;Agnoli, S.;Granozzi,G.;Finazzi,E.;Valentin,C.D.;Pacchioni,G. J.Phys.Chem.C 2008,112,8951.
(21) Cave,G.C.;Hume,D.N.Anal.Chem.1952,24,1503.
(22) Li,D.;Haneda,H.;Labhsetwar,N.K.;Hishita,S.;Ohashi,N. Chem.Phys.Lett.2005,401,579.
(23) Li,D.;Haneda,H.;Hishita,S.;Ohashi,N.;Labhsetwar,N.K. J.Fluorine Chem.2005,126,69.
(24) Lv,K.L.;Xiang,Q.J.;Yu,J.G.Appl.Catal.B 2011,104,275.
(25) Grela,M.A.;Coronel,M.E.J.;Colussi,A.J.J.Phys.Chem. 1996,100,16940.
(26) Cong,S.;Xu,Y.M.J.Hazard.Mater.2011,192,485.
(27) Sun,Q.;Xu,Y.M.J.Phys.Chem.C 2010,114,18911.
(28) Wang,C.M.;Mallouk,T.E.J.Phys.Chem.1990,94,4276.
(29) Cheng,X.F.;Leng,W.H.;Liu,D.P.;Xu,Y.M.;Zhang,J.Q.; Cao,C.N.J.Phys.Chem.C 2008,112,8725.
September 25,2011;Revised:January 4,2012;Published on Web:January 16,2012.
Effect of Fluoride Doping and Adsorption on the Photocatalytic Activity of TiO2
GAO Yue-Jun XU Yi-Ming*
(Department of Chemistry,Zhejiang University,Hangzhou 310027,P.R.China)
It has been reported that bulk doping or surface modification of TiO2with fluoride ions can enhance its photocatalytic activity for degradation of organic compounds in water.The effect of the former is ascribed to enhanced separation of photogenerated charge carriers through the surface-formed Ti3+species,whereas that of the latter is ascribed to enhanced desorption of hydroxyl radicals through the interfacial fluoride ions.However,the difference in activity between two modified catalysts has not been investigated.In this work,different fluoride-doped samples were hydrothermally prepared from butyl titanate and NH4F.Their photocatalytic activities after addition of NaF or AgNO3to the aqueous suspension were evaluated using phenol degradation as a model reaction.All the fluoride ions in the oxide lattices and in the outer and inner Helmholtz double layers of TiO2were positive to phenol degradation,but the magnitude of their influences followed a decreasing order.Moreover,phenol degradation in the presence of both NaF and AgNO3was much faster than the sum of their individual rates.These results indicate that combination of conduction band electron reduction and valence band hole oxidation is an effective way to improve the quantum yield of TiO2photocatalysis.
Photocatalysis;Titanium dioxide;Fluorine ion;Doping;Adsorption
10.3866/PKU.WHXB201201161
O643
∗Corresponding author.Email:xuym@css.zju.edu.cn;Tel:+86-571-87952410.
The project was supported by the National Natural Science Foundation of China(20873124)and National Key Basic Research Program of China
(973)(2011CB936003).
国家自然科学基金(20873124)和国家基础研究发展计划(973)(2011CB936003)资助项目

