基于电化学噪声研究缓蚀剂对AA6063铝合金点蚀的影响
阮红梅 董泽华,* 石 维 陈东初
(1华中科技大学化学与化工学院,武汉430074;2佛山科学技术学院化学与化工系,广东佛山528000)
基于电化学噪声研究缓蚀剂对AA6063铝合金点蚀的影响
阮红梅1董泽华1,*石 维1陈东初2
(1华中科技大学化学与化工学院,武汉430074;2佛山科学技术学院化学与化工系,广东佛山528000)
采用电化学噪声(ECN)、电化学阻抗谱(EIS)和极化曲线研究了AA6063铝合金在3%(w)NaCl溶液中的亚稳态点蚀萌发和稳态点蚀生长特征,着重探讨了CeCl3、Na2CrO4、8-羟基喹啉(8-HQ)等三种不同类型缓蚀剂对亚稳态和稳态点蚀的抑制机理.结果表明:当铝合金表面阴极相(Al-Si-Fe)周边的Al基体发生局部溶解后,会导致邻近区域pH值升高(>8.4),引起Ce(OH)3在蚀点中心区的阴极相表面优先沉积,从而抑制局部腐蚀的阴极去极化过程.随着缓蚀剂浓度的提高,亚稳态噪声峰的平均积分电量(q)随之递减,但噪声峰的平均寿命几乎没有变化,表明Ce3+并不能直接加速亚稳态蚀点的修复,但可降低蚀点内金属Al的溶解速率.CrO42-不但可加速蚀点修复,还可降低亚稳态蚀点的形核速率.8-HQ主要与Al3+、Mg2+等形成不溶性螯合物并沉积在铝合金表面,提高了铝基体的全面抗腐蚀能力,但并不能显著提高其耐点蚀能力.
铝合金;电化学噪声;点蚀;缓蚀剂;形核速率
1 引言
当前废旧铝合金型材的循环利用率已达到80%,而欧美先进国家的铝合金再利用率已超过95%.回收铝合金广泛用于制造建筑铝门窗、幕墙框架.为了保证门窗幕墙的抗风压性能、装配性能、耐蚀性能,对铝合金型材综合性能的要求远远高于工业型材标准.但是由于废旧铝合金型材再加工熔炼过程中不可避免地会引入一些杂质,如Fe、Cu等,当Fe含量超过规定值后,不但影响铝型材的机械性能,也会增加其局部腐蚀倾向.铝合金表面转换膜涂层是提高建筑铝型材耐蚀性能的重要方法,当前广泛采用铬酸盐转换膜工艺,但由于铬盐的环境毒性,因此迫切需要开发环境友好的缓蚀剂替代工艺.目前评价缓蚀剂的方法很多,如失重法、极化曲线、电化学阻抗谱(EIS)、电化学噪声(ECN)等.极化曲线可直接获得腐蚀电流密度及Tafel斜率,在腐蚀机理和缓蚀剂研究方面得到了广泛应用.EIS施加的扰动信号小,对电极过程影响小,有利于深入探讨缓蚀剂在金属界面的吸脱附过程.但这些传统电化学方法需要对研究电极施加扰动信号,这可能会改变金属腐蚀过程,而且这些方法大多基于平均电位与电流测量技术,理论上只适用于全面腐蚀行为研究,很难用于局部腐蚀机理研究.电化学噪声技术在测量过程中无需对被测电极施加扰动,无需预先建立被测体系的电极过程模型,因此ECN广泛用于研究金属的局部腐蚀行为,评估材料耐蚀性以及缓蚀剂、表面涂镀层的防护性能.Na和Pyun1通过随机统计分析和短时噪声理论,发现三种铝合金发生点蚀的几率大小依次为AA2024-T4、AA7475-T761、AA7075-T651,其中T4、T761和T651表示自然时效、过时效和近峰值时效等三种热处理工艺.Cai等2采用小波技术研究了纯铝在3%NaCl溶液中的点蚀行为,指出能量分布图(EDP)可以作为电化学噪声信号的“指纹”,从而识别点蚀的不同阶段.Aballe等3采用ECN研究Ce3+对AA5083铝合金的缓蚀效果,发现EDP可获取点蚀萌发的细节信息.Speckert和Burstein4认为只有含Fe元素的铝合金才会发生阳极/阴极组合电流噪声峰,并指出组合噪声瞬态峰中阴极峰是由点蚀坑内金属间化合物表面的H+还原产生.
开发环保高效的铝合金缓蚀剂及转换膜工艺,是未来发展趋势.本文采用ECN、EIS、极化曲线等电化学方法,研究了回炼AA6063铝合金在3% NaCl溶液中的局部腐蚀行为,借助扫描电子显微镜(SEM)探讨了三种不同类型缓蚀剂对铝合金表面亚稳态和稳态点蚀生长的抑制行为,并根据电化学噪声瞬态峰的特征信号以及噪声峰统计量,讨论了不同类型的缓蚀剂对铝合金点蚀的萌发、生长和再钝化的影响机理.
2 实验部分
2.1 实验材料
工作电极材质为广东铝业有限公司提供的AA6063铝合金,其成份(w)为:Si 0.38%,Mg 1.13%, Fe 0.67%,Mn 0.04%,余量为Al,切割成Ф 8 mm×8 mm的圆柱体,再用聚四氟乙烯(PTFE)镶嵌后以环氧树脂封装,固化后作为工作电极,其工作面积为0.5 cm2.电化学测试的工作电极依次用800#、1000#、1200#氧化铝耐水砂纸逐级打磨,再接着用W20(02)-W10(04)金相砂纸逐级打磨至表面光亮,用无水乙醇和蒸馏水清洗后在金属与PTFE之间涂封一圈宽1 mm的清漆层,以防止可能的缝隙腐蚀.电极经冷风吹干后置于干燥器中待用.
所有药品均为分析纯试剂,CeCl3·7H2O(99%), 8-羟基喹啉(8-HQ,99.5%),铬酸钠(99%),NaCl (99.5%),乙醇(99.7%),腐蚀介质为采用去离子水配制3%(w)NaCl水溶液,缓蚀剂预先配制成5%(w) CeCl3、1 mol·L-1Na2CrO4、2 g 8-HQ+50 mL乙醇母液待用.
2.2 电化学测试
ECN测量采用两支同材质AA6063铝合金工作电极(WE1,WE2)以及一个参比电极(饱和甘汞电极(SCE))构成,两工作电极面面相对且工作面相距5 cm.为防止Cl-污染,SCE通过双液接盐桥与被测溶液相接.为避免电磁噪声干扰,电解池置于法拉第屏蔽箱中,并通过恒温水浴维持30°C.噪声测量采用CST500电化学噪声测试仪(武汉科思特),该仪器内置高阻电压跟随器、零阻电流计(ZRA)和四阶Butterworth低通滤波器,截止频率(fc)为20 Hz,以防止工频干扰造成的伪噪声污染测试信号.电位与电流信号采用双路同步24 bit A/D进行模数转换,采样频率为3-10 Hz,连续采集.EIS测量采用CS350电化学工作站(武汉科思特),选用SCE作为参比电极,Pt片作为辅助电极,正弦波振幅10 mV,于开路电位(OCP)下进行,对数扫频范围为100 kHz-10 mHz.为确保实验数据的重现性,每组实验均进行3次.极化曲线测量采用上述相同的三电极体系,极化范围为OCP-0.3 V至OCP+0.6 V,扫描速率为0.5 mV·s-1,扫描停止电流设为0.1 mA.
2.3 腐蚀形貌分析
将打磨并清洗好的铝合金电极浸泡在不同浓度的缓蚀剂溶液.7天后取出电极,去离子水超声清洗后,置于真空干燥箱中干燥1 h,最后采用荷兰FEI公司Sirion 200扫描电镜进行形貌分析和X射线能谱分析(EDX).
2.4 ECN数据处理
由于两个铝合金电极(WE1,WE2)的表面状态不可能完全一致,原始噪声信号中可能会耦合一个直流分量,降低电化学噪声信号的分辨率,为此,我们根据文献5采用小波变换构建一个高通滤波器(fc> 0.01 Hz),以消除电位与电流信号中的直流分量,最后根据消除直流漂移后的电位与电流噪声来计算噪声电阻(Rn).单个亚稳态蚀点积分电量的定义表达式为:

其中:Qpit为积分电量,I(t)为噪声电流,Ib为基线电流,tn与tʹn分别代表第n个亚稳态噪声峰的起始和终止时刻.
通过Matlab软件滤除电流噪声信号中的直流漂移成分,使电流噪声信号基线平直化,然后对噪声信号中电流幅值超过5 nA的有效电流峰数量进行统计,并将单位时间内的有效电流峰数量与时间的比值定义为亚稳态蚀点形核速率,记为λ.
3 结果与讨论
3.1 缓蚀剂对铝合金全面腐蚀的影响
3.1.1 CeCl3对AA6063铝合金全面腐蚀的抑制行为
图1显示了铝合金在含不同浓度CeCl3溶液中的EIS及极化曲线.采用单容抗弧等效电路(图1(a)中的插图)进行阻抗谱拟合,其中Rs为溶液电阻, CPEdl为常相位角元件,代表双电层电容,Rct为电荷传递电阻.拟合曲线如图1(a)中实线,而实测值则以离散点表示.
图1(a)显示,铝合金在3%NaCl溶液中的Nyquist图的高频段为一容抗弧,低频端则呈现轻微的感抗弧特征,感抗弧可能是由Cl-在铝合金表面的吸脱附引起的.向NaCl溶液中加入100 mg·L-1CeCl3后,容抗弧直径迅速增加,且低频段的感抗弧消失.这是因为Al-Fe-Si阴极相表面溶解氧还原产生的OH-与Ce3+反应形成Ce(OH)3,并沉积在阴极相上,抑制了铝合金表面的阴极去极化,使电荷传递电阻增大.6随着Ce3+离子浓度增至500 mg·L-1,EIS在低频段的容抗弧增到最大,之后随着Ce3+离子浓度的进一步提高,半圆环直径反而逐步减少,这可能是因为CeCl3浓度的提高,一方面增加了Cl-离子含量,另一方面由于Ce3+水解降低了溶液pH值,这反而不利于Ce3+的碱性沉积.7Yu等8,9通过对Ce(III/ IV)-H2O2/O2体系的电位-pH图的研究,发现Ce3+只有在pH>8.4时才会以Ce(OH)3的形式发生沉积.因此浓度过高或过低均不利于Ce3+在铝合金表面形成良好保护膜,Ce3+浓度在500 mg·L-1时表现出最佳缓蚀效果.
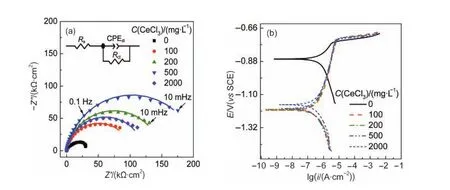
图1 AA6063铝合金在含不同浓度Ce3+的3%(w)NaCl溶液中的EIS(a)以及极化曲线(b)Fig.1 EIS(a)and polarization curves(b)forAA6063 aluminum alloy in 3%(w)NaCl solution in the presence of Ce3+with different concentrationsThe illustration in Fig.1(a)is equivalent circuit model for fitting of the EIS in this article.Rs:the solution resistance, CPEdl:the constant phase element representing the double-layer capacitance,Rct:the charge-transfer resistance
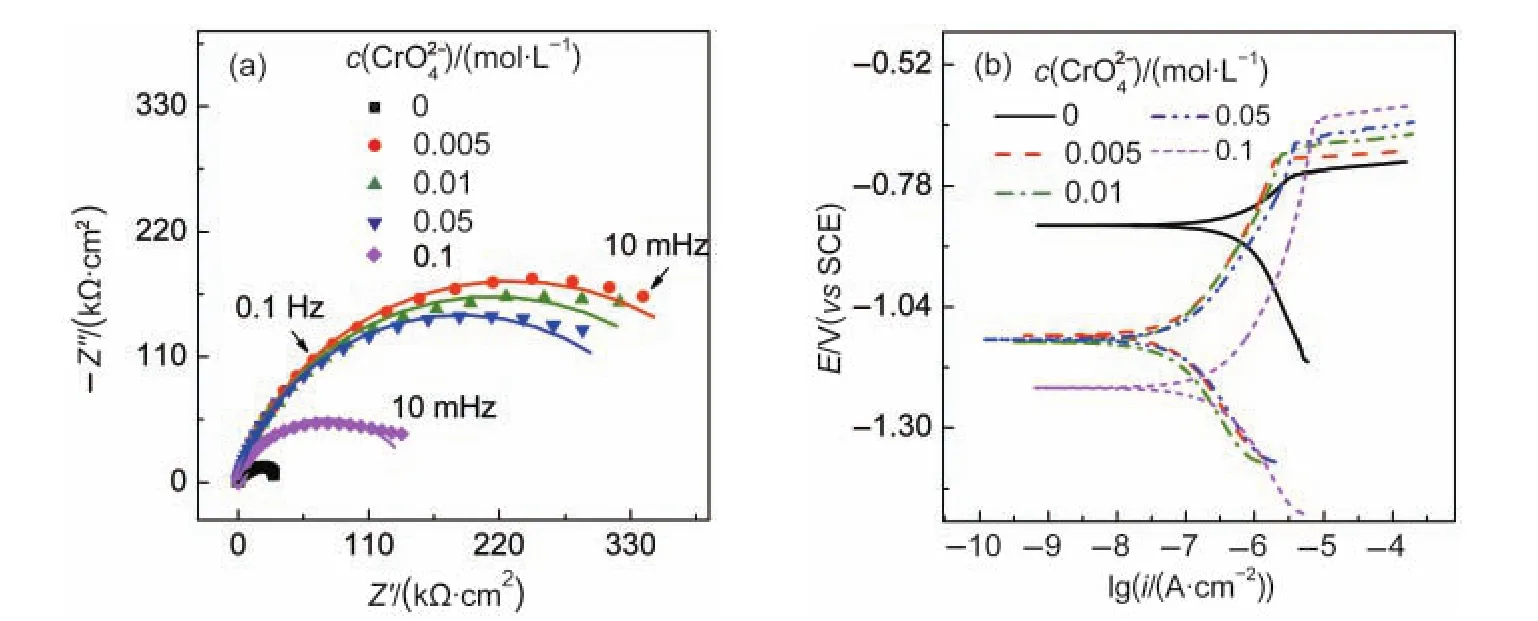
图2 AA6063铝合金在含不同浓度?的3%NaCl溶液中的EIS(a)和极化曲线(b)Fig.2 EIS(a)and polarization curves(b)forAA6063 aluminum alloy in 3%NaCl solution in the presence of with different concentrations
图1(b)还显示,加入CeCl3后铝合金的OCP负移约350 mV,且腐蚀电流密度大幅下降,表明Ce3+主要以抑制腐蚀的阴极过程来减缓腐蚀.铝合金表面的Ce盐转化膜为多层结构,其表层由结晶态的Ce2O3和无定形、非化学计量nCe(OH)3·mCe(OH)4组成.由于Ce2O3以及Ce(OH)x覆盖了大部分阴极区,增大了阴极极化阻力,因而Ce3+属于阴极型缓蚀剂.10
3.1.2 铬酸盐及8-HQ对AA6063铝合金全面腐蚀的抑制行为
为比较不同缓蚀剂对铝合金腐蚀的影响机制,测量了铝合金在含不同浓度铬酸盐的3%NaCl溶液中的EIS和极化曲线,如图2所示.采用图1(a)中的等效电路进行阻抗谱拟合,拟合曲线如图2(a)中实线所示,而实测值则以离散点表示.
图2(a)显示,加入0.005 mol·L-1铬酸钠时,阻抗谱中的Rct从不含时的34.7 kΩ·cm2迅速提高到423.1 kΩ·cm2,缓蚀效率达到91.8%.之后随着浓度的提高,缓蚀效果不仅没有提高,反而有所下降,如浓度为0.1 mol·L-1时,容抗弧急剧减小,这可能是因为随着浓度的提高,导致本体溶液pH值逐渐升高,对于两性金属铝,pH过大可能引发碱腐蚀.图2(b)显示,随着浓度的提高,点蚀电位(Epit)略有提高,且OCP逐渐负移,钝化区间明显增大,这说明能较好提高铝合金的耐点蚀性,但在0.1 mol·L-1的存在下,极化曲线反而有所右移,表明高浓度的可加速铝合金的全面腐蚀.

图3 AA6063铝合金在含不同浓度8-HQ的3%NaCl溶液中的EIS(a)和极化曲线(b)Fig.3 EIS(a)and polarization curves(b)forAA6063 aluminum alloy in 3%NaCl solution in the presence of 8-HQ with different concentrations
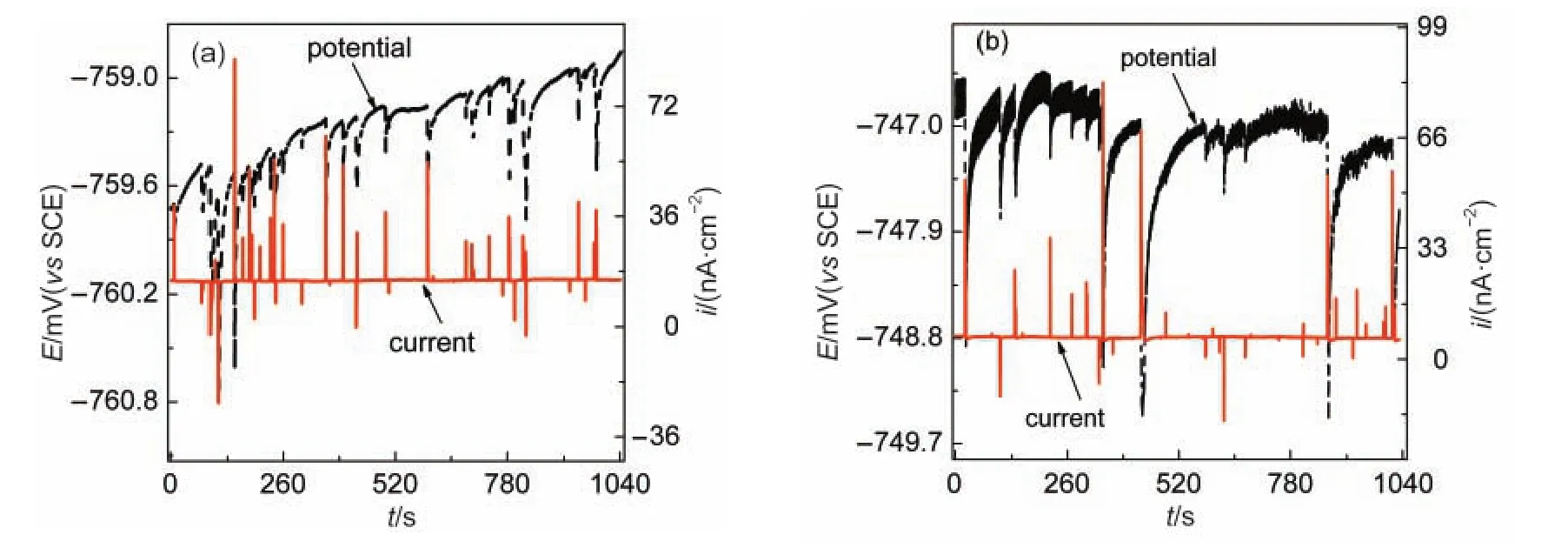
图4 AA6063铝合金在3%NaCl溶液中(a)19 h和(b)53 h后的电化学噪声Fig.4 Electrochemical noise ofAA6063 aluminum alloy in 3%NaCl solution after(a)19 h and(b)53 h
图3显示了铝合金在含8-HQ的3%NaCl溶液中的EIS及极化曲线.与铝合金在含Ce3+或-的NaCl溶液中表现出极值浓度的特征不一样,随着8-HQ浓度的增加,阻抗谱半圆弧单调递增,缓蚀效果提高.从图3(b)来看,点蚀电位Epit几乎不变,但开路电位显著负移,钝化区间增大.随着Al-Fe-Si金属间化合物的Al选择性溶解,8-HQ会与溶出的Al3+等形成不溶性螯合物,并沉积在阴极相表面,抑制腐蚀的阴极过程,13,14因而开路电位不断负移.
3.2 缓蚀剂对亚稳态蚀点形核过程的影响
3.2.1 CeCl3对亚稳态蚀点形核过程的影响
铝合金在3%NaCl溶液中的ECN曲线如图4所示.图4(a)显示,在浸泡初期,ECN中出现密集的噪声峰,表明Al基体出现了强烈的亚稳态蚀点形核和再钝化过程.电流噪声峰的快速上升归因于蚀点内铝基体的快速溶解过程,而电流峰的下降则是由于Cl-向蚀孔内的迁移速率达到极限后,不能满足蚀点生长的(孔内Al3+浓度增加速率)要求,导致孔内膜修复速率大于溶解速率,使电流噪声峰出现下降.当亚稳态蚀点消亡后,电流峰完全消失.而电位噪声波动则源于蚀孔溶解的阳极电流对钝化膜的充放电所致.15浸泡53 h后,噪声峰密度显著减少,这可能是铝合金钝化膜受到Cl-的长期侵蚀后,电极表面的阴极相活性点(亚稳态蚀点引发源)逐步溶出剥离所致.同时,钝化膜的减薄会导致单个亚稳态蚀点的寿命增加(噪声峰变宽变高),更大的蚀点生长电流对其周边区域具有阴极保护作用,这也在一定程度上抑制了亚稳态蚀点形核.2同时随着浸泡时间的延长电流峰幅值明显增加,即亚稳态蚀点的尺寸也在逐步增加.
当铝合金在3%NaCl溶液中浸泡53 h后,向溶液中加入500 mg·L-1的CeCl3,同时监测其ECN.图5显示了加入CeCl3后11和36 h的ECN.对比图4(b)与图5(a),可见加入Ce3+后,电位噪声波动趋于强烈,电位噪声幅值从~1 mV增至20 mV.与此同时,亚稳态蚀点的形核速率也急速下降(图5(a)),但亚稳态蚀孔的寿命却有所增加,表明Ce3+的存在反而抑制了蚀点的修复速率,加入Ce3+36 h后,亚稳态蚀点形核速率进一步降低,而电位噪声峰宽度则从先前的~80 s增至400 s,根据我们提出的亚稳态点蚀充放电模型,16电位峰宽度增加表明铝合金钝化膜电阻增加,即由于Ce3+沉积在铝合金基体表面,增强了铝合金的整体耐蚀能力.加入Ce3+后60 h,ECN曲线中的噪声峰完全消失,电流曲线上只有一些幅值极低的背景噪声(热噪声或散粒噪声).17由于Ce3+对阴极过程的有效抑制,与铝合金均匀腐蚀速率相关的基线电流也从60 nA级降至1 nA级.
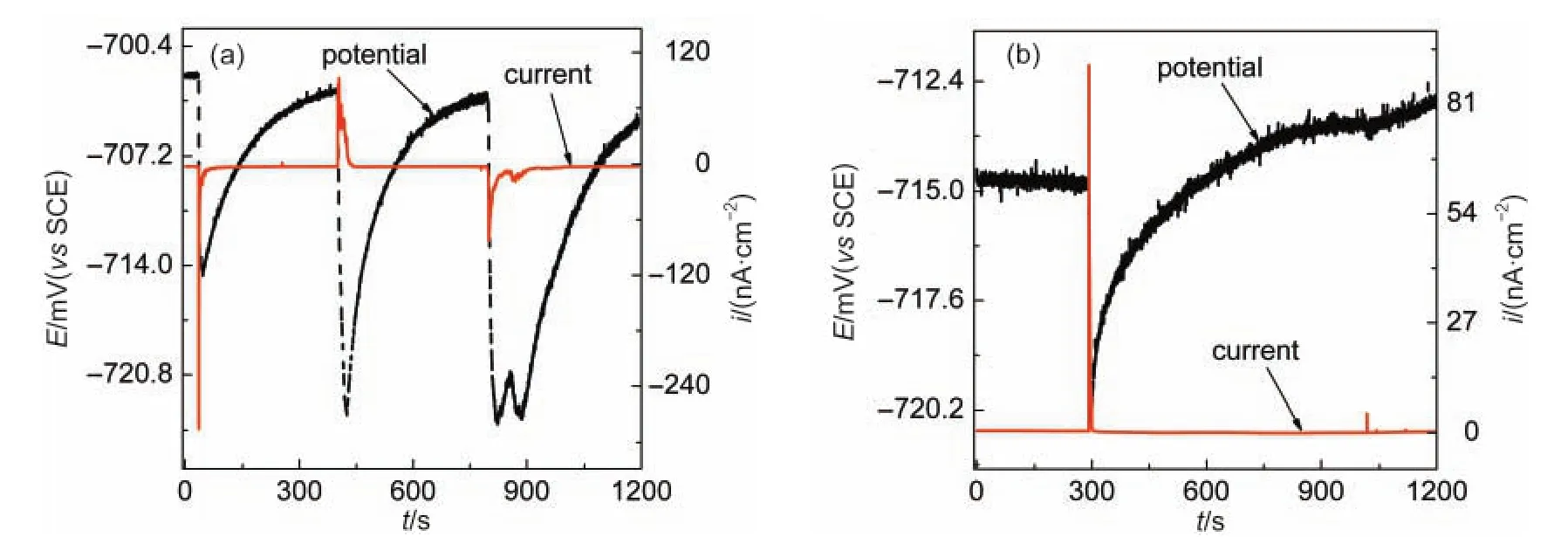
图5 AA6063铝合金在3%NaCl+500 mg·L-1CeCl3溶液中(a)11 h和(b)36 h后的电化学噪声Fig.5 Electrochemical noise ofAA6063 aluminum alloy in 3%NaCl solution in the presence of 500 mg·L-1 CeCl3after(a)11 h and(b)36 h

图6 不同条件处理的AA6063铝合金的扫描电镜(SEM)图Fig.6 Scanning electron microscopy(SEM)images ofAA6063 aluminum alloy treated at different conditions(a)polishing,(b)immersing in 3%NaCl solution for 7 days,(c)immersing in 3%NaCl solution in the presence of 1000 mg·L-1CeCl3for 7 days
许多研究者18-21对铝合金的局部腐蚀机理进行了细致研究,认为腐蚀可分为两个步骤:第一步,金属间化合物中Mg、Al等活性元素溶解,留下“蜂窝状纯阴极相(Fe-Si相)”;第二步,“纯阴极相”促进其周边发生腐蚀溶解.正是由于金属间化合物这种“自催化效应”促进了亚稳态蚀点的生长,如图6(b)中蚀坑所示.图6(c)中显示了铝合金在含1000 mg· L-1CeCl3盐溶液中浸泡7天后的形貌,图中白色颗粒为优先沉积在金属间化合物表面的CeO2,后者隔离了阴极相对铝基体的腐蚀促进作用.22
为进一步研究CeCl3对铝合金点蚀的抑制过程,将在3%NaCl中已浸泡7天的样片取出,再浸入含1000 mg·L-1CeCl3的3%NaCl溶液中7天.并对两种条件下阴极相表面、蚀坑壁、Al基体等三个不同位置的化学成分进行分析,如图7所示.我们发现阴极相表面主要含Si、Fe、Mg,而在含Ce3+溶液中浸泡后,阴极相表面的Ce含量高达32.64%,而蚀坑壁的为2.35%,基体表面的Ce含量更低(1.40%),可见Ce离子主要优先沉积在阴极相上,而不是沉积到蚀孔内.随着腐蚀的进行,Ce3+在O2和OH-的共同作用下,在阴极相表面发生沉积,形成多层结构的Ce盐转化膜(其表层由结晶态的Ce2O3和无定形、非化学计量nCe(OH)3·mCe(OH)4组成).10由于Ce2O3以及Ce(OH)x覆盖了大部分阴极区,增大了阴极极化阻力,从而抑制阴极相诱导的亚稳态点蚀产生.这与Rosero-Navarro等22研究结果一致.
3.2.2 噪声峰特征分析

图7 AA6063铝合金表面蚀点的SEM形貌图及蚀孔内外不同区域的X射线能谱(EDX)图Fig.7 SEM images of pits on theAA6063 aluminum alloy and energy dispersive analysis of X-ray(EDX)of different sites around the pits(a)SEM image of theAA6063 after immersion for 7 days in 3%NaCl solution:(1)cathode phase,(2)the wall of corrosion pit,(3)aluminum alloy substrate;(b)continuous immersion in 3%NaCl solution in presence of 1000 mg·L-1CeCl3for 7 days:(4)cathode phase,(5)the wall of corrosion pit,(6)aluminum alloy substrate;(c)the result of EDX corresponding to the regions in Figs.7(a)and 7(b)
根据形核速率计算方法,图8(a)显示了铝合金电极浸入3%NaCl溶液初期,亚稳态蚀点的形核速率(λ)约为0.0262 s-1,在随后的53 h内λ缓慢下降至0.0101 s-1,表明亚稳态蚀点形核在后期受到明显抑制.在亚稳态点蚀初始阶段,合金表面的各种夹杂物或第二相组织浓度较高,在Cl-的攻击下,导致铝合金表面的蚀点形核速率维持在一个高位值.根据MacDonald等23,24提出的点缺陷模型,蚀点形核反映了Cl-对钝化膜破坏作用的累积结果.由于Cl-的吸附,在钝化膜/溶液界面出现阳离子空位,一旦累积的空位浓度超过临界值,钝化膜破裂,导致点蚀形核.后期随着铝合金表面活性点(如Al-Fe-Si第二相和其它夹杂物)逐步耗尽,形核速率又开始下降.随着基体钝化膜的逐步溶解,新鲜暴露的夹杂物可能又成为亚稳态蚀点的诱发源,维持蚀点的持续形核.此外,金属间化合物中剩余的Fe-Si相也可能是维持点蚀形核的重要因素.
当向NaCl溶液中加入CeCl3后,形核速率开始下降,并最终趋近于0 s-1(图8(a)),这是因为Ce3+与铝合金表面的Al-Fe-Si阴极相周边的OH-反应,所形成的难溶性Ce盐膜覆盖在阴极相表面,阻碍了阴极相对基体溶解的促进和对亚稳态蚀点的诱导作用,因而减缓了铝合金腐蚀并导致蚀点形核速率下降,直至点蚀完全抑制.
噪声电阻Rn是噪声电位与噪声电流的根方差之比,然而,噪声电位由于受参比电极的影响,会出现低频或直流漂移(DC trend).25由于这种低频漂移来自外部环境干扰,一般认为与基体腐蚀关系不大,计算Rn时必须予以消除.为此我们将原始ECN信号通过小波高通滤波,25滤除直流成分后再进行分析,得到Rn
-t曲线(图8(b)).图中显示,在53 h内Rn由30.4 kΩ·cm2增至124.4 kΩ·cm2,加入Ce3+1 h后,Rn快速增至初值的3倍,22 h后增高到原来的15倍,90 h后增高到原来的80倍.考虑到Rn与极化电阻的正相关性,Rn的升高表明铝合金腐蚀受到了抑制,即Ce3+对铝合金点蚀具有较好的阻滞能力.

图9 AA6063铝合金在3%NaCl溶液中加入500 mg·L-1CeCl3前后电流噪声峰的(a)平均峰高及(b)平均积分电量的统计分析Fig.9 Statistical analyses of average amplitude(a)and integral electrical charge(b)of current transients for AA6063 aluminum alloy immersed in 3%NaCl solution before and after the addition of 500 mg·L-1CeCl3
图9显示了铝合金电流噪声峰的平均峰高和平均积分电量的统计分析结果.图9(a)中,在加入CeCl3之前,电流噪声平均峰高随时间逐步上升,加入CeCl3后,平均峰高短时间内上升至最大值后,逐步下降直至趋于0.图9(b)显示,在3%NaCl溶液中,噪声电流的平均积分电量由10.23 nC·cm-2缓慢升至23.56 nC·cm-2,而加入CeCl350 h后则快速降至0 nC·cm-2.电流噪声的平均峰高和平均积分电量能够反映亚稳态蚀点的长大趋势,它们的值越大,表明亚稳态蚀点更有机会生长成一个稳态蚀点,而CeCl3缓蚀剂的加入,可减缓亚稳态蚀点的生长速率,因而抑制了亚稳态蚀点的长大几率,表现为平均积分电量的下降,如图9(b)所示.
Ce3+能抑制铝合金亚稳态蚀点的生长过程,即改变电流噪声峰的形状.图10显示AA6063铝合金的典型电流噪声均表现为快速线性上升而后按指数缓慢衰减的趋势,且峰高随Ce3+浓度的增加而快速下降.电流噪声峰一般与亚稳态蚀点的诱发、生长和消亡过程(即钝化膜的破裂与修复)有关.26在亚稳态蚀点萌生阶段,由于局部钝化膜被Cl-侵蚀溶解是一个快过程,且溶解电流随侵蚀面积增加而增加,因而蚀点溶解电流上升较快.然而,受Cl-浓差扩散控制,一旦Cl-供应速率(往蚀点内的迁移速率)达不到Al3+的水解速率,蚀点的钝化进程将取代溶解进程而成为控制因素,促使钝化膜修复,蚀点溶解电流下降.但这种修复过程也受到O2和OH-扩散的影响,因而也是一个相对较慢的过程,所以噪声电流只能缓慢下降.

图10 AA6063铝合金在含不同浓度Ce3+的3%NaCl溶液中的电流噪声峰对比Fig.10 Comparison of current transients ofAA6063 aluminum alloy in 3%NaCl in the presence of Ce3+with different concentrations
图10还显示,电流噪声峰幅值随Ce3+浓度增加而快速降低,这可能与Ce3+沉积层阻碍了Cl-向蚀孔内的扩散有关.不过,从电流衰减趋势来看,噪声峰寿命(电流噪声峰持续时间)并没有随Ce3+浓度增加而下降,表明Ce3+并不能加速蚀点的修复过程,但能抑制蚀点生长而使噪声电流峰值下降.可以预见,相对于亚稳态峰的平均峰高和平均寿命等指标,平均积分电量更能反应铝合金的点蚀倾向.
3.2.3 Ce3+同步沉积对蚀点生长的影响
前面研究了Ce3+对已形成蚀点的修复过程,但工程上一般会预沉积(预膜)一层Ce转换膜,为此,我们测量了AA6063铝合金在预先加入Ce3+离子的NaCl溶液中的ECN,以考察同步沉积与后沉积Ce盐对亚稳态形核与长大的影响.图11(a)为铝合金电极在含100 mg·L-1CeCl3的3%NaCl溶液中浸泡初期的噪声曲线,图中仅有一个微弱的电流噪声峰(峰高<6 nA),表明同步沉积的Ce盐沉积膜对亚稳态蚀点的阻滞能力远强于后沉积膜(图5).不过, Yasakau等20也指出低浓度的Ce盐膜存在少量微孔,因而难以完全抑制蚀点形核.随着浸泡时间的延长,Cl-逐渐侵蚀了本不致密的Ce盐膜,导致电极表面形成了更多的亚稳态蚀点,并伴随着强烈的电流与电位噪声瞬态峰(如图11(b)所示).如将NaCl中的Ce3+浓度增至500 mg·L-1,实验发现30天内没有观测到电化学噪声峰,表明电极表面没有出现亚稳态蚀点形核,同时,电流噪声基线维持在1 nA以下,表明同步加入的高浓度Ce3+可在铝合金表面形成致密的沉积膜,并可完全抑制Cl-对基体的侵蚀.

图11 AA6063铝合金在3%NaCl+100 mg·L-1CeCl3溶液中浸泡(a)4 h和(b)123 h后的电化学噪声Fig.11 Electrochemical noise ofAA6063 aluminum alloy in 3%NaCl solution in the presence of 100 mg·L-1 CeCl3after(a)4 h and(b)123 h
值得注意的是,图11(b)中的电流噪声峰还出现了“反冲”现象,即电流噪声曲线上出现一个反向电流峰.Aballe等3认为这是由于发生点蚀的铝合金电极(WE1)后期出现了阴极电流,Speckert和Burstein4也观察到类似的电流反冲现象,并认为是由蚀孔内H+的演变产生的.图12给出了一个电流峰反冲的解释模型,其中阴极相周边的亚稳态蚀点溶解产生的电子,一部分通过零阻电流计(ZRA)流向对电极WE2,并对WE2的双电层电容进行充电,形成可检测的电流噪声;另一部分电子则直接在蚀点周边的基体表面与溶解氧反应生成OH-,导致WE1附近的溶液碱化和Ce3+离子沉积.Ce(OH)3的沉积造成WE1电位略微正移,这样就促使WE2双电层电容所储存的电子反向流至WE1,形成放电电流,并在电流噪声曲线上形成一个小的反电流峰.
3.2.4 Na2CrO4及8-HQ对亚稳态点蚀形核过程的影响
铬酸盐是缓蚀效果优良的铝合金缓蚀剂之一,11,27为比较铬酸盐与Ce3+对蚀点修复行为的差异,我们将铝合金电极在3%NaCl溶液中浸泡53 h后,向溶液中加入100 mg·L-1铬酸钠,同时监测其ECN,如图13所示.发现电化学噪声峰在1 h后就完全消失,只剩下极微弱的背景噪声,如图13(b)所示.而相同条件下,Ce3+并不能有效抑制噪声峰的产生(如图11(b)所示),表明CrO42-对蚀点形核的抑制和修复能力远强于Ce3+.
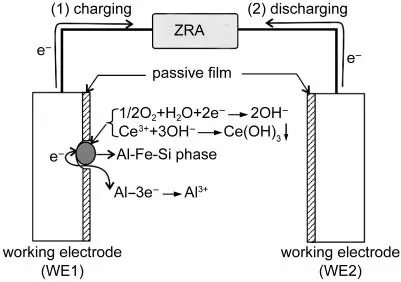
图12 AA6063铝合金表面亚稳态蚀点修复导致的反向电流噪声峰模型Fig.12 Schematic model of the reverse current noise peak caused by the rehabilitation of metastable pits ofAA6063 aluminum alloyZRA:zero resistance ammeter

图13 AA6063铝合金在3%NaCl溶液中(a)53 h及(b)加入100 mg·L-1Na2CrO41 h后的电化学噪声Fig.13 Electrochemical noise ofAA6063Aluminum alloy in 3%NaCl solution(a)after 53 h and(b)after the addition of 100 mg·L-1Na2CrO4for 1 h
铝合金在CrO42-溶液中,一方面强氧化性的Cr(VI)还原产生的Cr2O3沉积物可堵塞钝化膜中的缺陷,加速亚稳态点蚀的修复;另一方面,铝基体金属间化合物中Al、Mg等元素选择性溶解的同时, Cr(VI)还可在阴极相表面还原成Cr(OH)3,并沉积在阴极相表面,阻碍了阴极相对基体溶解的促进和对亚稳态蚀点的诱导作用,降低亚稳态蚀点的形核速率.
图14显示了AA6063铝合金在3%NaCl溶液中浸泡53 h后的ECN以及向溶液中加入1000 mg·L-18-HQ 15 h后的ECN曲线.可见随着浸泡时间的延长,噪声峰密度略有下降.由于铝基体表面的金属间化合物发生了选择性溶解,8-HQ与溶出的Al3+、Mg2+等形成不溶性螯合物并沉积在铝合金表面,阻碍Cl-的进攻,从而降低点蚀发生几率.但与相比,羟基喹啉与Al3+形成的螯合物并不能形成致密的保护层,只能一定程度上抑制亚稳态蚀点形核,因此在局部缺陷区仍然有蚀点形核的机会.图14(b)显示在加入1000 mg·L-18-HQ的NaCl溶液中,仍可观察到明显的噪声峰,表明即使是高浓度的8-HQ,也无法抑制亚稳态蚀点的形核.通过与图3中的阻抗数据对比,可以推测,8-HQ与Al3+形成保护性螯合物沉积膜的速率较慢,当该沉积膜覆盖在铝合金基体表面时,可提高铝基体的全面腐蚀抗力,但对于快速形核的亚稳态蚀点,由于8-HQ不能及时迁移到蚀点内并形成沉积膜,因而对亚稳态蚀点的抑制能力有限.
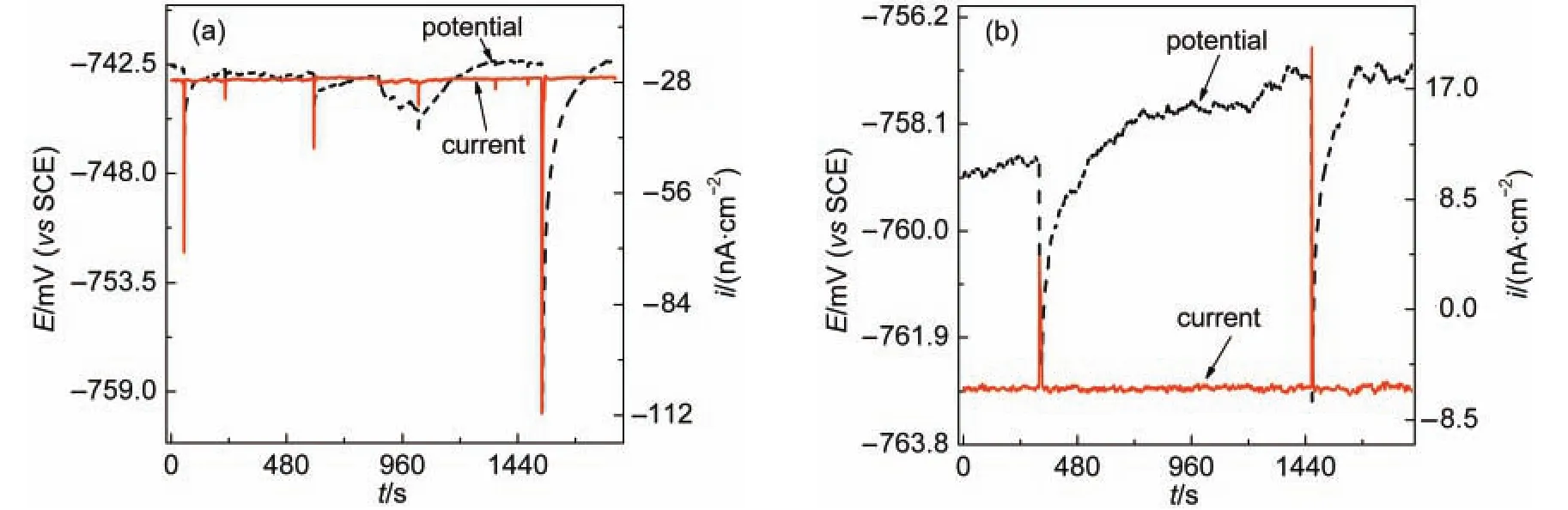
图14 AA6063铝合金在3%NaCl溶液中(a)53 h及(b)加入1000 mg·L-18-HQ 15 h后的电化学噪声Fig.14 Electrochemical noise ofAA6063 aluminum alloy in 3%NaCl solution(a)after 53 h and(b)after the addition of 1000 mg·L-18-HQ for 15 h
4 结论
随着AA6063铝合金表面的Al-Si-Fe阴极相(亚稳态蚀点引发源)逐步耗尽,其在NaCl溶液中的亚稳态蚀点形核速率也随时间缓慢下降,但其平均积分电量则有所增加;加入500 mg·L-1CeCl3后,蚀点形核速率和积分电量均迅速下降,极大地抑制了亚稳态蚀点的形核.Ce3+在Al-Fe-Si阴极相表面可形成难溶性Ce(OH)3沉积膜,阻碍了阴极相对基体溶解的促进和对亚稳态蚀点的诱导作用,因而抑制了铝合金的点蚀倾向.
EDX分析表明,蚀点中心区的阴极相表面Ce含量高达32.64%,而蚀坑壁的Ce仅为2.35%,基体表面仅为1.40%,表明Ce3+离子可优先沉积在亚稳态蚀点内的阴极相表面,而不是蚀孔内壁的活性Al基体表面,即Ce3+通过阻碍阴极过程来抑制蚀点生长.随着Ce3+浓度的提高,亚稳态噪声峰的平均积分电量随之递减,但噪声峰的平均寿命几乎没有变化,表明Ce3+并不能直接加速亚稳态蚀点的修复,但可降低蚀点内Al的溶解速率,减缓了蚀点生长速率.
铬酸盐能显著降低亚稳态蚀点的形核速率和平均寿命,促进蚀点的再钝化;8-HQ与Al3+结合形成不溶性螯合物并优先吸附于阴极区,增强了铝合金的全面腐蚀抗力,但并不能有效阻碍亚稳态蚀点的形核.
(1) Na,K.H.;Pyun,S.I.Corrosion Science 2008,50,248.doi: 10.1016/j.corsci.2007.05.028
(2) Cai,C.;Zhang,Z.;Cao,F.;Gao,Z.;Zhang,J.;Cao,C.Journal of Electroanalytical Chemistry 2005,578,143.doi:10.1016/ j.jelechem.2004.12.032
(3)Aballe,A.;Bethencourt,M.;Botana,F.J.;Marcos,M.;Osuna, R.M.Electrochimica Acta 2002,47,1415.doi:10.1016/ S0013-4686(01)00871-4
(4) Speckert,L.;Burstein,G.T.Corrosion Science 2011,53,534. doi:10.1016/j.corsci.2010.11.008
(5) Mansfeld,F.;Sun,Z.;Hsu,C.;Nagiub,A.Corrosion Science 2001,43,341.doi:10.1016/S0010-938X(00)00064-0
(6) Markley,T.A.;Forsyth,M.;Hughes,A.E.Electrochimica Acta 2007,52,4024.doi:10.1016/j.electacta.2006.11.028
(7) Davo,B.;de Damborenea,J.J.Electrochimica Acta 2004,49, 4957.doi:10.1016/j.electacta.2004.06.008
(8) Yu,P.;OʹKeefe,T.J.Journal of the Electrochemical Society 2006,153,C80.
(9) Yu,P.;Hayes,S.A.;OʹKeefe,T.J.;OʹKeefe,M.J.;Stoffer,J.O. Journal of the Electrochemical Society 2006,153,C74.
(10) Birbilis,N.;Buchheit,R.G.;Ho,D.L.;Forsyth,M. Electrochemical and Solid State Letters 2005,8,C180.
(11) Grilli,R.;Baker,M.A.;Castle,J.E.;Dunn,B.;Watts,J.F. Corrosion Science 2011,53,1214.doi:10.1016/j.corsci. 2010.12.006
(12) Ilevbare,G.;Scully,J.Journal of the Electrochemical Society 2001,148,B196.
(13) Soliman,H.Corrosion Science 2011,53,2994.doi:10.1016/ j.corsci.2011.05.045
(14) Li,S.M.;Zhang,H.R.;Liu,J.H.Transactions of Nonferrous Metals Society of China 2007,17,318.doi:10.1016/S1003-6326 (07)60092-2
(15) Dong,Z.H.;Guo,X.P.;Zheng,J.R.;Xu,L.M.Journal of Chinese Society for Corrosion and Protection 2002,22,290. [董泽华,郭兴蓬,郑家燊,许立铭.中国腐蚀与防护学报, 2002,22,290.]
(16) Dong,Z.H.;Shi,W.;Guo,X.P.Corrosion Science 2011,53, 1322.doi:10.1016/j.corsci.2010.12.028
(17) Zhang,J.Q.;Zhang,Z.;Wang,J.M.;Cao,C.N.Journal of Chinese Society for Corrosion and Protection 2001,21,310. [张鉴清,张 昭,王建明,曹楚南.中国腐蚀与防护学报, 2001,21,310.]
(18) Zheludkevich,M.;Yasakau,K.;Poznyak,S.;Ferreira,M. Corrosion Science 2005,47,3368.doi:10.1016/j.corsci. 2005.05.040
(19) Zhang,W.L.;Frankel,G.S.Electrochimica Acta 2003,48, 1193.doi:10.1016/S0013-4686(02)00828-9
(20)Yasakau,K.A.;Zheludkevich,M.L.;Lamaka,S.V.;Ferreira, M.G.S.Journal of Physical Chemistry B 2006,110,5515.doi: 10.1021/jp0560664
(21) Leblanc,P.;Frankel,G.Journal of the Electrochemical Society 2002,149,B239.
(22)Rosero-Navarro,N.C.;Curioni,M.;Bingham,R.;Duran,A.; Aparicio,M.;Cottis,R.A.;Thompson,G.E.Corrosion Science 2010,52,3356.doi:10.1016/j.corsci.2010.06.012
(23) MacDonald,D.D.;Al Rifaie,M.;Engelhardt,G.R.Journal of the Electrochemical Society 2001,148,B343.
(24) MacDonald,D.D.Electrochimica Acta 2011,56,1761.doi: 10.1016/j.electacta.2010.11.005
(25) Dong,Z.;Guo,X.;Zheng,J.;Xu,L.Electrochemistry Communications 2001,3,561.doi:10.1016/S1388-2481(01) 00220-X
(26) Dong,Z.H.;Zhu,T.;Shi,W.;Guo,X.P.Acta Phys.-Chim.Sin. 2011,27,905.[董泽华,朱 涛,石 维,郭兴蓬.物理化学学报,2011,27,905.]doi:10.3866/PKU.WHXB20110336
(27) Clark,W.J.;Ramsey,J.D.;McCreery,R.L.;Frankel,G.S. Journal of the Electrochemical Society 2002,149,B179.
May 7,2012;Revised:June 25,2012;Published on Web:June 25,2012.
Effect of Inhibitors on Pitting Corrosion of AA6063 Aluminium Alloy Based on Electrochemical Noise
RUAN Hong-Mei1DONG Ze-Hua1,*SHI Wei1CHEN Dong-Chu2
(1School of Chemistry and Chemical Engineering,Huazhong University of Science and Technology,Wuhan 430074,P.R.China;2Department of Chemistry and Chemical Engineering,Foshan University,Foshan 528000,Guangdong Province,P.R.China)
The pitting corrosion of AA6063 aluminum alloy in 3%(w)NaCl solution was investigated by electrochemical noise(ECN),electrochemical impedance spectroscopy(EIS),and polarization curves. Inhibition of nucleation and propagation of metastable pits by inhibitors,such as CeCl3,Na2CrO4,and 8-hydroxyquinoline(8-HQ),was evaluated based on ECN data statistics.It was found that the local pH could be over 8.4 near the cathode phase(Al-Si-Fe)due to dissolution of Al matrix,leading to preferential deposition of Ce(OH)3on the surface of the cathode phase,thereby inhibiting the cathodic process of pitting corrosion.The average electric charge(q)of metastable pits decreased with increasing the corrosion inhibitor concentration,but the average lifespan of noise transients remained almost constant, indicating that Ce3+ions did not accelerate the rehabilitation of metastable pits directly,but reduced the dissolution rate of Al inside active pits.However,CrO42-ions not only accelerated the rehabilitation of metastable pits,but also reduced the nucleation rate of the AA6063 aluminum alloy.In contrast,8-HQ acted as an effective corrosion inhibitor for AA6063 aluminum alloy through formation of insoluble chelate films with Al3+ions and Mg2+ions,but failed to enhance the pitting corrosion resistance of the aluminum alloy.
Aluminium alloy;Electrochemical noise;Pitting corrosion;Inhibitor;Nucleation rate
10.3866/PKU.WHXB201206251
O646
∗Corresponding author.Email:zehua.dong@gmail.com;Tel:+86-27-87543432.
The project was supported by the Foundation for Key Program of Ministry of Education of China(211129).
教育部科学技术研究重点项目(211129)资助