富含n-3LC-PUFA调和油的家庭烹饪氧化稳定性研究
姜元荣 张余权 梁俊梅
富含n-3LC-PUFA调和油的家庭烹饪氧化稳定性研究
姜元荣 张余权 梁俊梅
(丰益(上海)生物技术研发中心有限公司,上海 200137)
通过对DHA和EPA质量分数分别为0.23%、0.45%、0.90%、1.80%的调和油进行家庭炒菜试验的研究,考察了富含n-3长碳链多不饱和脂肪酸(Long chain polyunsaturated fatty acid,LC-PUFA)的调和油的家庭烹饪氧化稳定性。结果表明:炒土豆丝后,上述油样中DHA和EPA的损失分别为1.2%、2.9%、2.4%、1.4%;炒青椒肉片后其损失分别为:3.0%、2.2%、2.4%、4.5%。炒菜前后调和油的各项指标包括羰基价、总氧化值(TOTOX)、硫代巴比妥酸值(TBA)、酸价和聚合物含量与大豆油(对照样1)以及不含DHA和EPA的调和油(对照样2)相比,油样的氧化程度以及油脂品质与两个对照样接近。不同DHA和EPA含量的调和油炒菜之后其多不饱和脂肪酸保留率在95%以上,氧化稳定性和豆油接近,适合家庭烹饪。
二十二碳六烯酸(DHA) 二十碳五烯酸(EPA) 氧化稳定性 家庭烹饪
近年来,长碳链多不饱和脂肪酸因其众多的健康功效而倍受关注。n-3系列多不饱和脂肪酸(n-3 long chain polyunsaturated fatty acids,n-3 LC -PUFA)中二十碳五烯酸(Eicosapentaenoic Acid,简称EPA)和二十二碳六烯酸(Docosahexaenoic Acid,简称DHA)是其中两种最重要的营养元素[1]。国外大量的流行病学和临床试验表明DHA和EPA在生物体中有着重要的生理功能和保健作用。DHA和EPA具有抗血栓形成,调节血脂,抗凝血以及抗心律失常等作用,对于预防心脑血管疾病有积极作用[2-3]。另外,n-3系多不饱和脂肪酸中的DHA是大脑及视网膜中脂肪酸的主要成分,对视力和大脑发育有很好的促进作用[4-5]。在抗炎抗癌方面,DHA和EPA的临床功效也有不少报道[6-7]。因此,摄入足够量的DHA以及EPA非常必要。
很多国家权威机构都公布了DHA和EPA的每日摄入量,但调查资料显示,在全世界大多数地区的饮食习惯中DHA和EPA的摄入量严重不足[8]。如何补充DHA以及EPA是目前全球范围内广泛关注的课题,商业化的DHA和EPA多来自于海洋生物,如深海鱼类和海藻。鱼油的产量远远大于藻油,更经济。目前成人DHA和EPA的补充方式以鱼油胶囊为主。另外欧美日本也有一些强化营养的食品如面包、人造奶油、牛奶制品、果汁、能量棒以及食用油等产品,这方面的学术研究报导主要集中在添加技术以及添加方式对氧化稳定性的影响等方面[9-10]。
我国居民脂肪摄入量调查显示,中国居民n-3多不饱和脂肪酸特别是DHA和EPA摄入量远低于国际权威机构推荐量[11],并且中国居民服用胶囊营养补充剂也远远不及欧美国家普遍,因此在日常膳食中强化DHA和EPA迫在眉睫。在中国居民的饮食习惯中,食用植物油的应用非常普及,通过在食用油中添加鱼油来实现DHA和EPA的营养强化显然是一个普遍而且便捷的补充途径。在食用油中添加鱼油强化营养的产品在国外已有先例,如Crisco公司Omega-3 DHA卡诺拉油[12],鱼油添加量大约为7%。然而,由于鱼油中多不饱和脂肪酸含量高,比一般的植物油更容易被氧化,该特性可能会给食用油中添加鱼油带来一定挑战[13]。
本试验研究了添加一定量鱼油的植物调和油在烹饪过程中的氧化稳定性。模拟中国居民常用的烹饪方式和菜品,如炒土豆丝和炒青椒肉片,研究DHA和EPA在烹饪过程中的稳定性,并且进一步考察添加鱼油后调和油的品质稳定性,以此阐明鱼油作为强化营养的新资源食品添加到植物油中,应用于家庭烹饪的可行性。
1 材料与方法
1.1 材料
鱼油:加拿大Ocean Nutrition Canada公司提供,EPA:18.5%,DHA:12.7%;大豆油(TBHQ:80 mg/kg VE:1 100 mg/kg)、大豆菜籽调和油(TBHQ:80 mg/kg,VE:880 mg/kg):上海嘉里食品有限公司;大豆油和大豆菜籽调和油的脂肪酸组成面积百分比(A/A)见表1。大豆菜籽调和油种分别加入 0.75%、1.50%、3.00%、6.00%的鱼油,所得调和油经检测后DHA和EPA 的质量分数分别为0.23%、0.45%、0.90%、1.80%,分别命名为样品1,样品2,样品 3,样品 4;豆油和大豆菜籽调和油分别为对照组1和对照组2,土豆,青椒,肉片均来自副食市场。
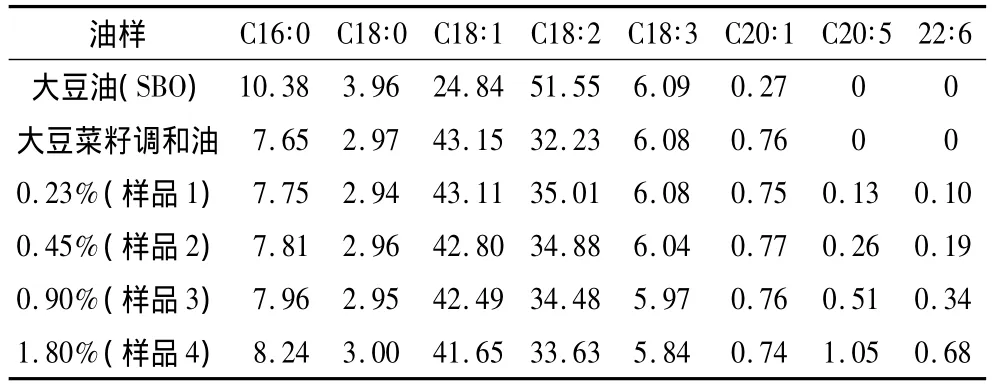
表1 样品以及对照组的脂肪酸组成/%(A/A)
1.2 设备
岛津UV-1700紫外可见分光光度计:日本岛津公司;气相色谱仪Agilent 6890:美国安捷伦科技有限公司。
1.3 方法
1.3.1 常规指标检测方法
酸值AV:GB/T 5530—2005;过氧化值PV:GB/T 5538—2005;色泽 COLOR:GB/T 22460—2008;茴香胺值:GB/T 24304—2009;羰基价:GB/T 5009.37—2003;TBA:AOCS 19—90;聚合物 AOCS Cd 22—91;DHA、EPA、α-亚麻酸(ALA)定量分析:GB/T 5009.168—2003。
1.3.2 烹饪试验
菜品配方为500 g土豆丝、80 g样品1。炒锅中加入80 g油开始加热,约50 s检测油温达到180℃后加入土豆丝不断翻炒至总加热时间为3 min,将炒好的土豆丝置于盘中,冷却后收集盘底的油进行分析检测。青椒250 g切片,瘦猪肉片50 g加少量淀粉拌匀,油70 g。炒菜过程同土豆丝,总加热时间为4 min。对照组1,对照组2以及样品2~样品4都重复以上试验,每个试验重复3遍。
1.3.3 数据处理
数据采用SPSS 17.0进行单因素方差分析,柱状图中的误差限为多次平行试验的标准偏差。
2 结果与讨论
2.1 烹饪后油样中DHA、EPA以及ALA的损失
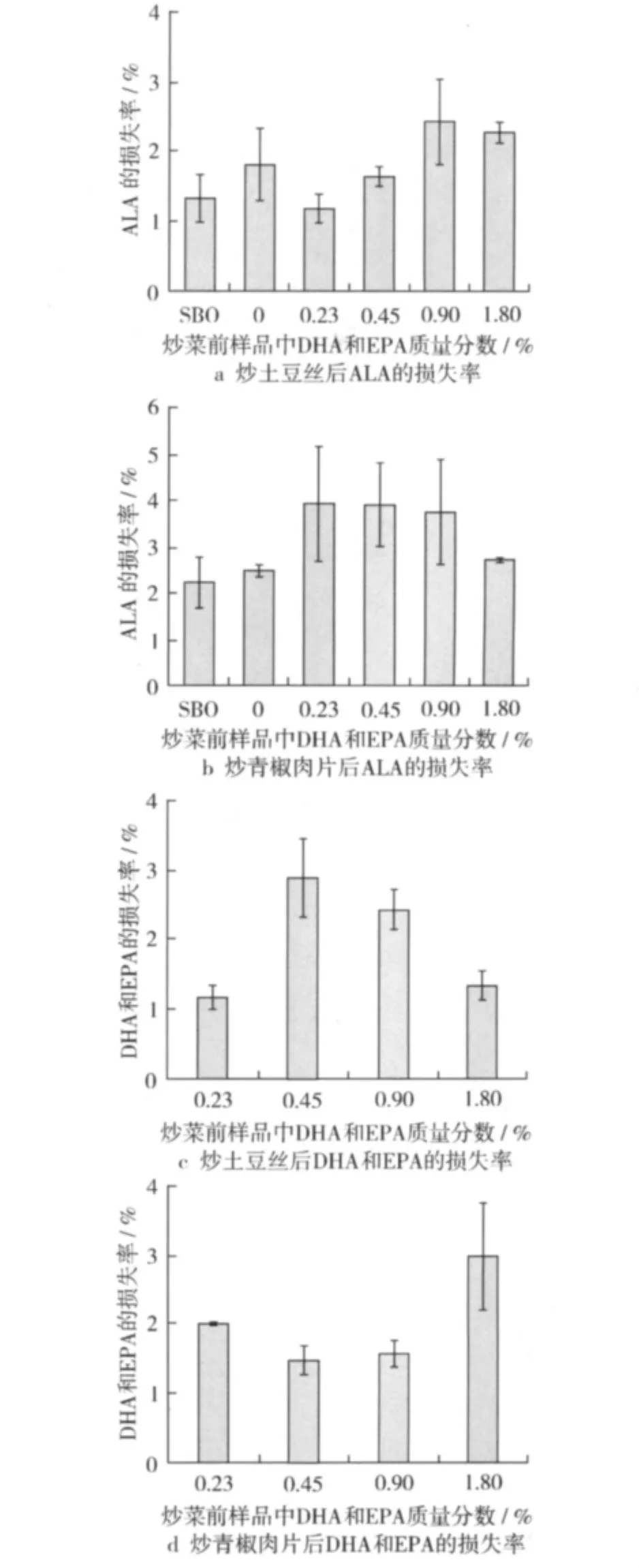
图1 炒土豆丝和炒青椒肉片试验中不同样品的ALA或DHA和EPA的损失情况
炒菜在中国居民的饮食习惯中是最普遍的烹饪方式之一。如果炒菜后DHA和EPA有足够高的保留量,则表明富含LC-PUFA的调和油可以通过膳食的方式有效补充DHA和EPA。另外,尽管添加鱼油的植物油中的氧化稳定性研究很少,但含PUFA的食用油并不罕见,如广泛用于中国家庭烹饪的大豆油和菜籽油中都有较高含量的ALA,这两种油在家庭烹饪中的稳定性是为大众所广泛接受的。将烹饪过程中DHA及EPA的稳定性与ALA做对比,对其是否为大众所接受具有指导意义。
检测结果(图1a)表明,炒土豆丝后样品1~样品4 中 ALA 的损失分别为:1.2%、1.7%、2.4%、2.3%,炒菜后对照组1和对照组2中ALA的损失分别为1.8%以及1.3%,损失率都比较低。炒土豆丝后样品1~样品4中DHA和EPA的损失分别为:1.2%、2.9%、2.4%、1.4%,接近 ALA 的损失程度(图1c)。炒青椒肉片的试验和炒土豆丝的方法一致,从开始加热油到炒熟共4 min,结果和炒土豆丝相差不大。如图1b,图1d所示,炒菜后油样中 DHA、EPA以及ALA的损失率都在2.2% ~4.5%之间。
从以上数据看,无论炒土豆丝,还是炒青椒肉片的试验,DHA和EPA的损失都低于5%,和ALA的损失程度非常接近。这说明如果将DHA和EPA的添加量控制在一定范围之内时,家庭日常烹饪方式对其的影响与对ALA的影响程度相当。尽管从理论上而言,DHA以及EPA的氧化速率约为ALA的2倍[14],但从烹饪试验结果来看两者氧化损失的差异并不显著,其原因可能是由于DHA和EPA充分稀释于调和油,同时烹饪时间较短所致。
2.2 烹饪后油脂氧化指标的变化
DHA和EPA的化学结构中含有多个双键,在有氧环境中高温加热时容易被氧化,但是由于鱼油体系比较复杂,生成一级氧化产物氢过氧化物之后很快就会分解成醛酮等二级氧化产物[15],因此单纯的过氧化值很难反映多不饱和脂肪酸的氧化程度。二级产物因为成分复杂,定量检测比较困难,因此通常将部分二级产物衍生为发色物质,通过吸光度来考察这些二级产物,这类方法常用的指标包括p-茴香胺值(p-Anisidine)、羰基价(carbonyl value)和硫代巴比妥酸值(TBA)等。
羰基价可以比较直观地反映油脂氧化后的醛酮等含羰基的一类氧化分解产物[16]。炒菜前的羰基价如表2所示,不同DHA和EPA含量的调和油的羰基价和豆油很接近,均不高于4 mmol/kg。不论是炒青椒肉丝还是炒土豆片,炒菜之后的样品1~样品4的羰基价都有所升高,分别升高到 5.7、5.3、5.9、5.6 mmol/kg(图2),和对照组1以及对照组2的的羰基价变化均无显著差异(P>0.05)。这表明富含n-3 LC-PUFA的调和油炒菜之后的含羰基类的氧化产物并没有比普通调和油以及豆油的这类氧化产物高。

表2 烹饪前各油样的总氧化值、羰基价及TBA

图2 炒土豆丝和炒青椒肉片试验中不同样品的羰基价
p-茴香胺值在多不饱和脂肪酸的氧化稳定性研究中很常用,该方法是通过检测油脂氧化产物中的醛酮类化合物与对茴香胺反应生成的发色物质来衡量油脂的二级氧化产物。油脂氧化后的一级氧化产物氢过氧化物和二级氧化产物醛酮类化合物构成了油脂的主要氧化产物,衡量一级二级氧化产物的指标总过TOTOX常被用来反映油脂的整体氧化情况。炒菜前油样的总氧化值如表2示,炒菜后富含LC-PUFA的调和油总氧化值分别上升到16.7、16.3、14.8、16.4(图3),炒土豆丝后样品1 ~样品4的总氧化值和两个对照组没有显著性差异(P>0.05)。炒青椒肉片后除样品4外,其他3个油样的总氧化值和两个对照组也没有显著性差异(P>0.05)。样品4的总氧化值比其他样品有明显升高,这是由于DHA和EPA质量分数的增加到1.8%时,茴香胺值会有比较明显的升高,因而导致总氧化值有所升高。分别分析这些样品的过氧化值和茴香胺值发现,即使是样品4中的茴香胺值也只有10.2,Casal论述过茴香胺在10以下时,其二级氧化产物很低,可以忽略不计[17]。这说明即使含DHA和EPA为1.8%的样品炒菜之后的二级氧化程度也可忽略。
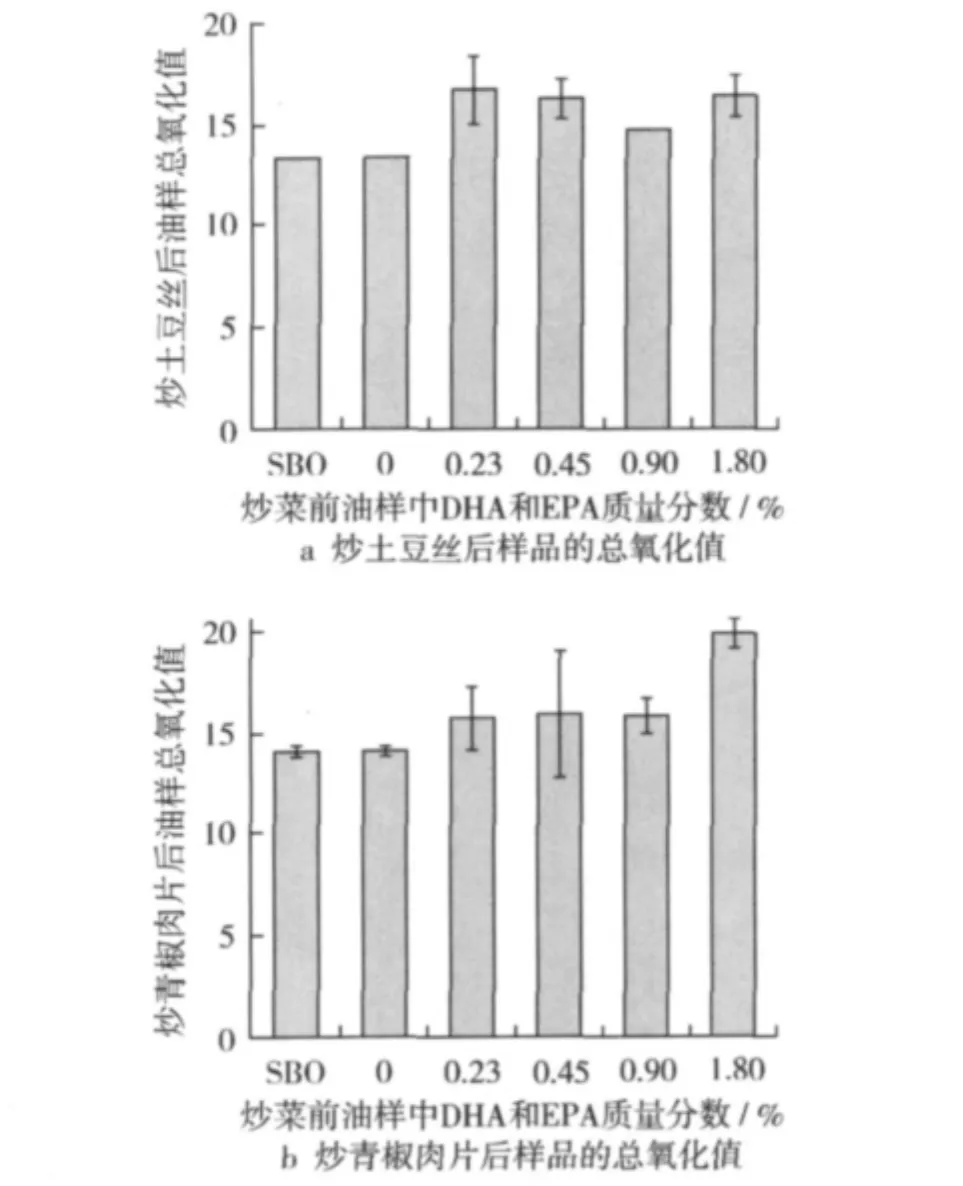
图3 炒土豆丝和炒青椒肉片试验中不同样品的总氧化值
硫代巴比妥酸值(TBA)也是一个常见的考察油脂氧化的指标,通常用来检测丙二醛类化合物的含量,有文献报道鱼油氧化后的主要分解产物如丙烯醛、丙二醛、乙醛以及己醛等均和TBA值有非常直接的相关性[18]。炒菜前的TBA见表2,调和油的起始TBA在0.06~0.12之间,和豆油的 TBA 接近,炒菜之后的TBA值见图4,可以看出炒菜前后所有油样的TBA变化较小,炒菜后TBA随着DHA和EPA含量的增加呈上升趋势,但炒菜后的TBA值最高不超过0.3,属于新鲜植物油TBA的合理范围内[19]。
综上所述,不同DHA和EPA含量的调和油在烹饪前后的氧化稳定性和不添加鱼油的对照组以及豆油没有明显差别,氧化程度基本一致。

图4 炒土豆丝和炒青椒肉片试验中不同样品的TBA(mg/kg)
2.3 烹饪之后油品的其他品质变化
除了以上氧化指标外,对富含n-3 LC-PUFA调和油炒菜后的酸价、聚合物等指标也进行了检测。表3和表4分别列出了不同DHA和EPA含量的调和油烹饪前后的酸价及聚合物含量。游离脂肪酸和聚合物都是在加热或者存储过程中油脂发生酸败变质的表现。LC-PUFA由于含有多个双键,氧化分解会产生游离脂肪酸[20]。但试验结果表明不同DHA和EPA含量的调和油炒菜之后的酸价变化与对照样没有明显差异,表明n-3 LC-PUFA调和油中少量的LC-PUFA对酸价变化未产生影响,主要可能是由于是LC-PUFA含量低,加热时间短。由于PUFA的聚合体系比较复杂,目前尚无研究表明由油脂氧化而引起的聚合物的产生与PUFA含量的直接相关[21-22]。试验结果也表明烹饪后DHA和EPA含量未对聚合物测产生有明显影响。

表3 烹饪前后调和油的酸价

表4 烹饪前后调和油的聚合物含量
3 结论
综上所述,模拟家庭烹饪的试验结果表明:适量添加鱼油的调和油在烹饪之后至少95%的n-3 LC-PUFA保留在菜里。炒菜之后DHA和EPA的保留率与ALA也比较接近,DHA和EPA的损失率并不因其氧化速率理论上是ALA的氧化速度的二倍而比ALA的损失更高,这可能是由于调和稀释作用对DHA和EPA起到一定缓冲氧化作用和保护作用,但真正原因还需要进一步研究。另外,不同DHA和EPA含量的调和油炒菜之后的氧化程度和豆油相似,羰基价、总氧化值、TBA、酸价以及聚合物等指标都和豆油接近。总之,将鱼油添加到调和油中是可行的,这种方式为中国居民提供了一种补充DHA和EPA的有效途径。
[1]William C E.Importance of n-3 fatty acids in health and disease[J].Am J Clin Nutr,2000,71(suppl):171- 175
[2]Balk M E,Lichtenstein A H,Chung M,et al.Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk:A systematic review[J].Atherosclerosis,2006,189:19-30
[3]Paul E Marik,M D,Joseph V.Omega- 3 Dietary Supplements and the Risk of cardiovascular Events:A Systematic Review[J].Clin Cardiol,2009,32(7):365-372
[4]Uauy R,Dangour A D.Nutrition in brain development and aging:role of essential fatty acids[J].Nutr.Rev2006,64,S24-33;discussion S72-91
[5]Neuringer M,Reisbick S,Janowsky J.The role of n- 3 fatty acids in visual and cognitive development;Current evidence and methods of assessment[J].J.PediaPediatrics,1994,125(5):S39-S47
[6]Stehr S N,Heller A R.Omega-3 fatty acid effects on biochemical indices following cancer surgery[J].Clinica Chimica Acta,2006,373:1-8
[7]Calder P C.n- 3 polyunsaturated fatty acids,inflammation,and inflammatory diseases[J].Am.J Clin Nutr,2006,83(suppl):1505-1519
[8]World Health Organization.Diet nutrition and the prevention of chronic disease[C].Geneva:WHO Technical Report Series No.916,2003
[9]Nielsen NS,Jacoben C.Methods for reducing lipid oxidation in fish- oil- enriched energy bars International[J].Int J Food Sci Technol,2009,44:1536- 1546
[10]Jacobsen M B,Nielsena N S,Meyer A S.Antioxidant strategies for preventing oxidative flavour deterioration of foods enriched with n-3 polyunsaturated lipids:a comparative evaluation[J].Trends Food Sci Technol,2008,19:76-93
[11]张坚,孟丽苹,姜元荣,等.中国成人膳食脂肪酸摄入和食物来源状况分析[J].营养学报,2009,31(5):424-427
[12]Introduction of Crisco DHA cooking oil from webpage of Crisco company[EB/OL].http://www.crisco.com/Products/ProductDetail.aspx?groupID=15&prodID=801
[13]Let M B,Jacobsen C,Meyer A S.Lipid Oxidation in Milk,Yoghurt,and Salad Dressing Enriched with Neat Fish Oil or Pre- Emulsified Fish Oil[J].J Agric Food Chem,2007,55,19:7802-7809
[14]Cho S Y,Miyashita K J,Miyazawa T,et al.Autoxidation of ethyl eicosapentaenoate and docosahexaenoate[J].JAm Oil Chem.Soc,1987,64:876-879
[15]Lee H,Kizito S A,Weese S J,et al.Analysis of headspace volatile and oxidized volatile compountsin DHA-enriched fish oil on accelerated oxidative storage[J].J Food Sci,2003,68(7):2169-2177
[16]Melton SL.Methodology for following lipid oxidation in muscle foods[J].Food Technol1983,37:105- 111
[17]Casal S,Malheiro R,Sendas A,et al.Olive oil stability under deep- frying conditions[J].Food Chem Toxic,2010,48:2972-2979
[18]Leon B C,King M F,Sheldon B.A Rapid Method for Determining the Oxidation of n- 3 Fatty Acid[J].J Am Oil Chem Soc,1992,69(4):325-330
[19]袁施彬,陈代文,韩飞.氧化时长对不同油脂过氧化指标的影响研究[J].饲料工业,2007,28(11):33-34
[20]Fritsch C W.Measurement of frying fat deterioration:a brief review[J].JAm Oil Chem Soc,1981,58(3):272-274
[21]Burkow IC,Henderson JR.Isolation and quantification of polymers from autoxidized fish oil by high performance size-exclusion chromatography with an evaporative mass detector[J].J.Chromatography,1991,552,501-506
[22]Dobarganes MC,Marguez- Ruiz G,Perez- Camino MC.Thermal stability and frying performance of Genetically modified sunflower seed oils[J],J Agric Food Chem.1993,41,678-681.
Home Cooking Oxidative Stability of n-3 LC-PUFA Enriched Blended Oil
Jiang Yuanrong Zhang Yuquan Liang Junmei
(Wilmar(Shanghai)Biology R & D Center LtdCo,Shanghai 200137)
Oxidative stability of n-3 long chain polyunsaturated fatty acids(n-3 LC-PUFA)enriched blended oil with different DHA & EPA mass fractions(0.23%,0.45%,0.90%and1.80%)was studied in family cooking.Stir-frying of shredded potatoes and green pepper with sliced lean pork were employed for the study.After the stir-frying of shredded potatoes,losses of DHA & EPA in the above-mentioned samples were 1.2%,2.9%,2.4%and 1.4%respectively;and after the stir- frying of green pepper with sliced lean pork,the losses were 3.0%,2.2%,2.4%and 4.5%respectively.Before and after stir-frying,the indexes of the blend oil include carbonyl value,TOTOX,TBA,AV,polymer content.The oxidation degrees and grease quality of oil samples were similar to those of soybean oil(control sample 1)and the blend oil without DHA& EPA(control sample 2).Conclusion:after stir-frying,95%or more of the polyunsaturated fatty acid in the blend oil containing various mass fractions of DHA& EPA remained,which meant that the oxidative stability of these samples are similar to that of soybean oil and suitable for cooking.
Docosahexaenoic Acid(DHA),Eicosapentaenoic Acid(EPA),oxidative stability,home stirfrying
TQ646
A
1003-0174(2012)01-0057-06
2011-04-14
姜元荣,女,1970年出生,高级工程师,粮食油脂与植物蛋白
张余权,男,1979年出生,博士,油脂营养与健康

