连续性静脉静脉血液滤过治疗肝肾综合征的临床研究
李 靖 肖 琼 韩志武 夏小红 涂 娟 王 芳 徐友平 姚国乾
中国人民解放军第161医院全军血液净化中心 (湖北武汉,430010)
肝肾综合征 (hepatorenal syndrome,HRS)是慢性肝病患者出现进展型肝功能衰竭和门脉高压时,以肾功能损伤、肾血流灌注减少和内源性血管活性物质分泌异常为特征的一种综合征。目前尚无有效治疗措施,患者存活率低、预后差。我们应用连续性静脉静脉血液滤过 (continuous venovenous hemofiltration,CVVH)治疗肝硬化肝肾综合征患者,并与对照组进行比较,现将结果报告如下。
1 资料与方法
1.1 一般资料 2004年1月至2010年12月在我院住院的患者32例,均符合1996年国际腹水研究小组发表的关于肝肾综合征的定义与诊断标准[1];其中男17例,女15例;年龄26~72岁,平均 (47.8±26.7)岁;肝肾综合征Ⅰ型26例,Ⅱ型6例;原发疾病为乙型肝炎肝硬化20例,丙型肝炎肝硬化4例,胆汁性肝硬化2例,酒精性肝硬化1例,原因不明肝硬化3例,肝硬化合并原发性肝癌2例。所有HRS患者均无肝昏迷,无合并呼吸衰竭、心力衰竭、糖尿病及周围血管病变存在。患者入院接受治疗时均签署知情同意书。将32例病例随机分为两组,每组16例,两组患者在基线水平临床及生化指标差异无统计学意义 (P>0.05),具有可比性 。见表1。
表1 两组患者基线水平及临床生化指标比较 ()
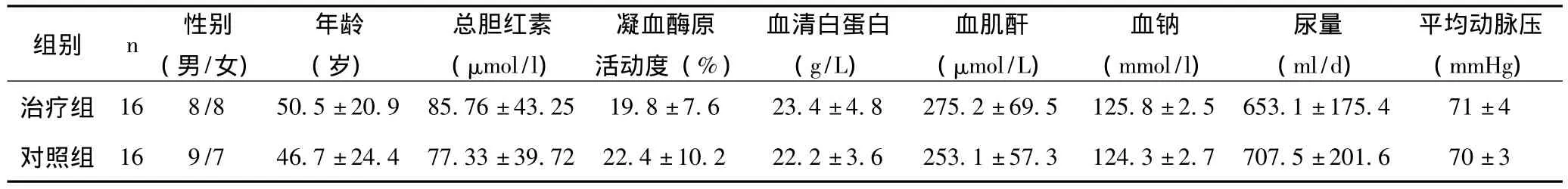
表1 两组患者基线水平及临床生化指标比较 ()
表2 两组患者治疗前及治疗2周时生化指标、尿量、平均动脉压变化比较()
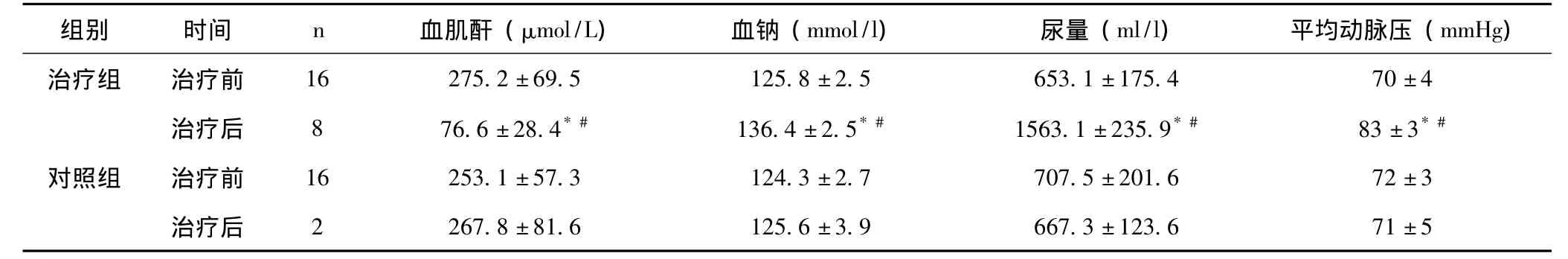
表2 两组患者治疗前及治疗2周时生化指标、尿量、平均动脉压变化比较()
与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
表3 两组治疗前后血浆TNF-α、内毒素、肾素、血管紧张素Ⅱ变化()

表3 两组治疗前后血浆TNF-α、内毒素、肾素、血管紧张素Ⅱ变化()
与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
1.2 治疗方法 所有患者均给予内科基础治疗,补充足够能量,维持水、电解质和酸碱平衡,补充白蛋白、新鲜血浆、支链氨基酸,使用甘草酸二铵及抗生素等。
对照组患者在基础治疗上,采用去甲肾上腺素持续静脉泵入,根据临床平均动脉压和尿量改变,去甲肾上腺素由0.5 mg/h逐渐增加至最大剂量3 mg/h,用至HRS恢复或至14天,而后3天内逐渐停药。根据尿量,呋塞米起始量40 mg/d,最大量160 mg/d。
治疗组患者在基础治疗上采用CVVH治疗,具体实施方法:血管通路均为深静脉置管 (颈内静脉插管或股静脉插管)。使用设备为PRISMATM机器 (Hospal)以及配套的M60管路和滤器 (AN69膜,0.6 m2),置换液采用Port配方配制,加温后前稀释法输入,流量为1500~2000 ml/h,5%NaHCO3另路同步匀速输入。普通肝素抗凝。血流量为150~180 ml/min,超滤量200~300 ml/h,严密观察患者生命体征,治疗时间为8~10小时,2~3次/W。两组患者疗程均为两周。
1.3 观察指标 观察患者临床症状、腹围、饮食、精神状态、尿量、生化指标,同时评估终止治疗事件及转归。两组患者在治疗两周时留取血清样本,进行肝、肾功能、凝血功能、电解质、肿瘤坏死因子-α(TNF-α)、血清内毒素及肾素、血管紧张素Ⅱ检测。
TNF-α测定应用ELISA双抗体夹心法,试剂由深圳晶美生物工程有限公司提供。血清内毒素测定采用鲎试验检测,试剂由上海伊华临床科技公司提供。肾素、血管紧张素Ⅱ采用放射免疫竞争结合法,试剂盒由中国北方生物技术研究所提供。
1.4 统计学方法 应用SPSS 13.0软件进行统计分析,计量资料用()表示,治疗前后比较应用配对资料t检验,组间比较应用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗后临床症状、预后及转归 治疗组患者治疗后临床症状改善优于对照组,患者腹水减少或消失8例。对照组仅1例腹水减少。治疗组存活患者腹胀减轻,腹围缩小,体重下降,精神及食欲明显改善。治疗两周时,治疗组16例存活8例 (50%),死亡8例,对照组16例存活2例(12.5%),死亡14例,两组存活率比较,差异有显著性意义 (P<0.05)。治疗期间两组患者均无不良反应发生。
2.2 两组患者治疗前后血清生化指标及尿量变化 见表2。
2.3 两组患者治疗前及治疗两周时血浆TNF-α、内毒素、肾素、血管紧张素Ⅱ变化 见表3。
3 讨论
肝肾综合征是肝病终末期常见的严重并发症[1],发病机制主要是全身血流动力学的改变,表现在内脏血管扩张,输出量相对不足和有效血容量不足,肾素-血管紧张素-醛固酮系统和交感神经系统被进一步激活,最终导致肾皮质血管强烈收缩、肾小球滤过率下降[2]。肝移植虽是治疗肝肾综合征的有效方法,但由于患者生存时间短及肝源有限很难实施。因此,采取积极有效的方法,改善肝肾功能,使患者渡过危险期,为肝移植作准备,具有重要的临床价值。
CVVH治疗具有稳定血液动力学,精确控制容量,维持水、电解质酸碱平衡、改善平均动脉压和外周血管阻力,改善氮质血症的作用,能清除包括细胞因子、炎症介质在内的小分子、中分子物质[3,4]。
肝硬化患者常由于肠黏膜渗透性增高、肝脏清除及灭活内毒素功能降低、门-体分流等原因导致血浆内毒素升高,而发生内毒素血症。有研究显示,HRS患者血浆内毒素水平与NO(一氧化氮)、TNF-α呈直线正相关,提示内毒素血症和TNF-α在HRS发病机制中发挥非常重要的作用[5,6]。有研究表明,内毒素血症可激活循环肾素-血管紧张素-醛固酮系统,引起机体血管强烈收缩[7]。同时低钠血症与有效血容量降低、肾灌注减低等因素可促进肾素-血管紧张素-醛固酮系统进一步激活[8,9],而诱发HRS。
本研究中应用CVVH治疗HRS,一方面通过清除患者体内内毒素等代谢产物,创造稳定的内环境;另一方面调理炎症介质及血管活性物质。结果显示:治疗组患者的临床症状得到不同程度的改善,低钠血症、血流动力学、肾脏功能得到改善,生存率明显提高。
究其机制可能为:①有效地清除血中的内毒素及炎症因子,调理血管活性物质,改善血液循环功能紊乱状态。②通过清除间质水分,改善微循环和细胞摄氧力,从而改善组织的氧利用率。③持续稳定调控氮质血症和水、电解质及酸碱平衡。④为营养及代谢支持创造条件,从而使患者内稳机制得以重建。CVVH治疗HRS疗效肯定,简便易行,值得进一步研究和推广使用。
[1]ARROYO V,GINES P,GERBES AL,et al.Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis.International Ascites Club [J].Hepatology,1996,23(1):164-176.
[2]SALERNO F,GERBES A,GINE SP,et al.Diagnosis,prevention and treatment of hepatorenal syndrome in cirrhosis [J].Gut,2007,56(9):1310-1318.
[3]KADA K,PIERRE C,PIERRE P,et al.Continuous veno-venous hemofiltration improves hemodynamics in septic shock with acute renal failure without modifying TNF and IL6 plasma concentrations[J].Nephrol,2002,15(1):150-157.
[4]于光,田野芊,袁伟杰,等.连续性血液净化对全身炎性反应综合症合并急性肾衰患者血浆炎性介质水平的影响 [J].中国急救医学,2002,22(1):74-77.
[5]SUCH J,HILLEBRAND DJ,GUARNER C,et al.Tumor necrosis factor-alpha,interleukin-6,and nitric oxide in sterile ascetic fluid and serum from patients with cirrhosis who subsequently develop ascetic fluid infection [J].Dig Dis Sci,2001,46(10):2360-2366.
[6]卢放根,吴小平,霍继荣,等.肝肾综合征患者血浆TNF-α、NO及内毒素水平变化[J].暨南大学学报 (医学版),2007,28(4):401-403.
[7]李晶铃,王超,文艳,等.内毒素血症时循环肾素血管紧张素系统改变的实验研究[J].中国危重病急救医学,2006,18(2):92-95.
[8]顾锡炳,陈浩坤,朱银芳,等.补钠与限钠对肝硬化血肾素、血管紧张素Ⅱ、醛固酮及肾功能的影响[J].中华肝脏病杂志,2004,12(6):370.
[9]高宝秀,贺勇,李贵星,等.慢性重型肝炎并发肝肾综合征的相关因素分析 [J].临床肝胆病杂志,2011,27(7):749-751.

