运动负荷骤降对生长期大鼠长骨骨量和骨代谢生化指标的影响①
阚世锋,余波,陈文华,张雯,祁奇
合理的运动对人一生的骨健康都有着积极影响,能有效提高成长期的骨峰值,维持成年期的骨密度(bone mineral density,BMD),降低老年期骨量(bone mass,BMC)的丢失[1-2]。骨骼的质量和结构主要取决于其遗传因素,但也依赖其所处的应力环境。施加在骨上的载荷在骨的生理活动中起着“方向盘”的作用,它决定了骨形成、骨吸收发生的部位,也决定着骨重建的形式[3]。大量研究表明,持续高强度运动负荷能有效刺激骨组织,使骨形成大于骨吸收,骨矿物质沉积,骨量增加。但当高强度的运动负荷骤然降低或停止后,如专业运动员退役后,骨代谢会如何发生变化,对应力部位骨骼的骨量和骨密度又有何影响,国内此类研究甚为少见。本研究拟用大鼠做跑台运动,大强度运动一段时间后骤降其运动强度,观察大鼠骨代谢生化指标及应力部位长骨骨量和骨密度的变化,以期为建立科学的运动训练方法提供理论基础。
1 材料和方法
1.1 实验动物分组与饲养 雄性3月龄SD大鼠48只,购于中科院上海实验动物中心,平均体重(305±8)g。购回后适应性喂养2 d,按体重匹配分成大强度运动组(T1)、大强度转低强度运动组(T2)、低强度运动组(T3)、对照组(Con),每组12只。大鼠分笼饲养,自由进食、饮水,以国家标准啮齿类动物常规饲料喂养。动物房温度20℃~24℃,相对湿度45%~55%,自然光照。
1.2 主要试剂与仪器 血清碱性磷酸酶(ALP)、骨钙素(BGP)和抗酒石酸性磷酸酶(TRACP5b)ELISA试剂盒:上海瑞齐生物科技有限公司;Hologic Discovery A骨密度仪:美国Hologic公司;小动物跑台(JD-PT):上海继德教学实验器械厂。
1.3 运动干预 所有运动组大鼠在小动物跑台上适应性训练1周。T1、T2组进行18 m/min,跑台倾斜0°正式跑台运动,持续20 min;随后隔日跑速增加3 m/min,持续时间增加10 min;第2周起跑速达30 m/min,持续60 min,跑台倾斜5°。维持此强度,5 d/周,持续6周。T3组跑速12 m/min,持续时间20 min,跑台倾斜度0°,5 d/周,运动6周。6周后T2组跑台运动强度降低,与T3组一致,T1、T3组运动强度不变,继续运动6周。对照组不做运动干预。
1.4 实验动物取材 第6周末,每组随机抽取6只大鼠,按体重腹腔注射水合氯醛麻醉,脱颈处死,腹主动脉抽血,迅速放入离心机,2000 r/min离心10 min,分离上清液待测。取其左侧股骨,小心去除骨组织上附着的软组织,用生理盐水浸湿的纱布包裹,放入-20℃冰箱保存待测。12周末,剩余大鼠按上述方法取其标本。
1.5 生化指标的检测 酶标仪法测定ALP、BGP和TRACP5b,按照ELISA试剂盒说明书进行。
1.6 BMC及BMD测定 股骨室温下自然解冻,用Hologic DiscoveryA骨密度仪对股骨进行扫描。
1.7 统计学分析 采用SPSS 13.0统计软件处理,参数以(±s)表示,组间差异显著性采用One Way-ANOVA检验,显著性水平α=0.05。
2 结果
实验过程中T1组1只大鼠因跑台后部电极刺激电流过大电击而死,余47只顺利完成实验。
2.1 6周末BMC和BMD比较 6周运动后,T1、T2组BMC高于对照组(P<0.05),而BMD与对照组无显著性差异(P>0.05)。T3组BMC和BMD与对照组无显著性差异(P>0.05)。见表1。
2.2 6周末ALP、BGP和TRACP5b比较 T1、T2组BGP明显高于对照组(P<0.01),ALP高于对照组(P<0.05),TRACP5b低于于对照组(P<0.05);T3组ALP、BGP、TRACP5b与对照组无显著性差异(P>0.05)。见表2。

表1 6周末各组大鼠股骨BMC和BMD的比较

表2 6周末各组大鼠ALP、BGP和TRACP5b的比较
2.3 12周末BMC和BMD比较 12周末,T1组BMC高于其他3组(P<0.05),BMD各组间无显著性差异(P>0.05)。
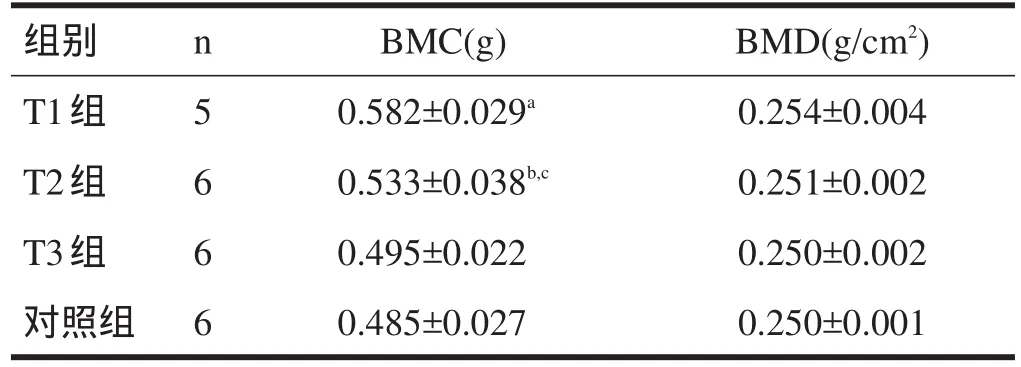
表3 12周末各组大鼠股骨BMC和BMD的比较
2.4 12周末ALP、BGP和ACTRP5b比较 T2组BGP明显低于T1组(P<0.01),低于T3组(P<0.05);ALP低于T1组(P<0.05),与T3组和对照组无显著性差异;TRACP5b明显高于T1组(P<0.01),高于T3组和对照组(P<0.05)。此外,T1组ALP、BGP和ACTRP5b均与对照组有显著性差异(P<0.05)。见表4。
2.5 T2组运动负荷降低前后各观测值的比较 将T2组两次检测值进行t检验,BMC和BMD无显著性差异(P>0.05);运动负荷降低后,BGP和ALP降低(P<0.05),TRACP5b升高(P<0.05)。见表5。
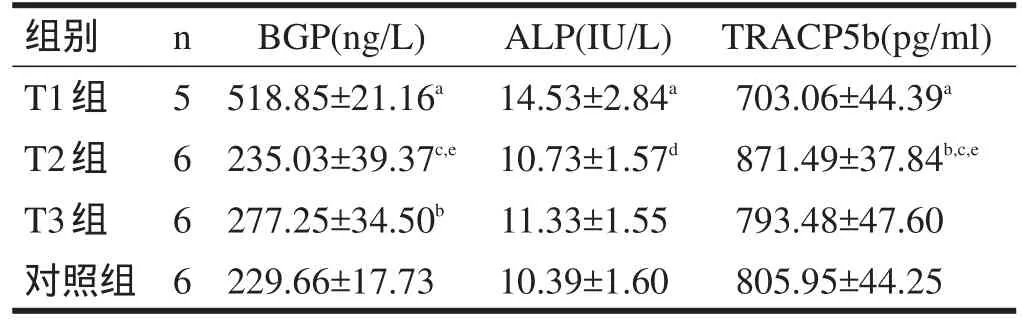
表4 12周末各组大鼠ALP、BGP和TRACP5b的比较
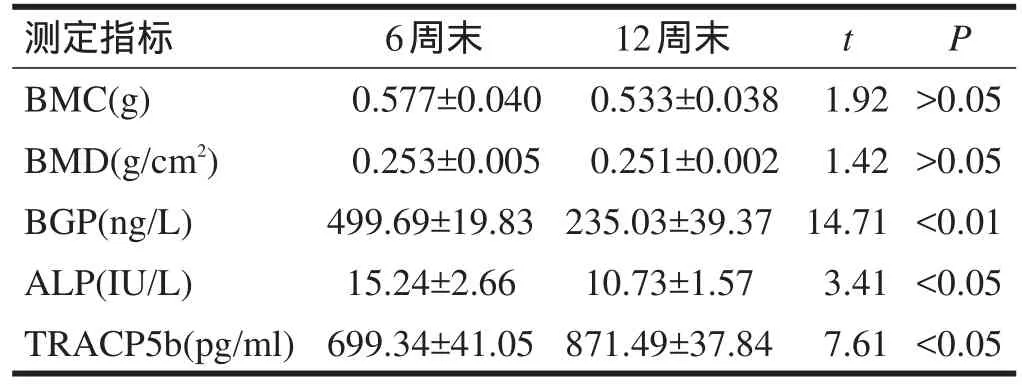
表5 T2组运动负荷降低前后各观测值的比较(n=6)
3 讨论
骨组织持续不断地重建,使骨量维持着动态平衡。通过检测血、尿骨代谢生化指标的变化,可间接反映骨的生理状况。骨代谢生化指标分为骨形成性和骨吸收性两大类,BGP和ALP都是骨形成性指标,其中BGP是活跃、成熟的成骨细胞分泌的非胶原蛋白,是骨形成的决定因素,血清BGP与骨内BGP含量成正相关,测定血中BGP浓度可反映骨组织中BGP的水平[4];ALP是骨形成所必需的酶,是成骨细胞分化成熟和功能的标志,其活性反映了成骨细胞的活性。TRACP为骨吸收性指标,是酸性磷酸酶的第5型,血清中TRACP分为5a和5b两型,研究证实,TRACP5b由破骨细胞分泌,能够反映破骨细胞的活性[5]。
骨代谢也就是骨的重建过程,包括骨形成、骨吸收和静止阶段。骨代谢的变化最终会影响骨量及骨密度:当骨代谢活动以骨形成为主时,骨量增加,骨密度提高;当骨代谢活动以骨吸收为主时,骨量减少,骨密度降低。
6周跑台运动使BGP、ALP升高,TRACP5b降低,与国外研究结果相似[6]。表明适量机械负荷能有效诱导成骨细胞的增殖和活性提高,抑制破骨细胞的活性。高强度跑台运动使大鼠股骨BMC增加,但BMD变化不明显。这是因为跑台运动能促进成长期大鼠受应力部位长骨的纵向生长,增加骨皮质厚度,而不能显著提高长骨的骨密度[6-7]。低强度的机械负荷不足以有效刺激骨组织,不能影响成骨细胞和破骨细胞的数量和活性,不能改变骨重建过程。
跑台运动由大强度转低强度后,骨形成指标降低,而骨吸收指标升高,即运动负荷骤降抑制了骨形成,促进骨吸收。值得注意的是,T2组骨形成指标不但低于T1组,甚至还低于T3组,骨吸收指标高于T3组,而T3组实验过程中各项指标无明显变化。提示持续的低强度运动负荷不会引起骨代谢显著变化,而当运动负荷由高强度转为低强度后,成骨细胞活性降低,破骨细胞活性增高,骨代谢出现负平衡。
Weiler等以英国某足球俱乐部的20名足球运动员作为研究对象,观察2007/2008赛季结束后经8周休息调整,运动员骨吸收和骨形成标记物跟赛季结束初做比较,结果发现,停止大强度运动8周后,骨吸收标记物CTx升高17.7%,骨形成标记物PINP降低9.9%[8]。Karlsson 等也有类似报道[9]。
成骨细胞、破骨细胞活性的变化必然导致BMC和BMD的变化。运动负荷骤降后大鼠BMC和BMD较前都有所下降,但无显著性差异。我们分析原因可能为BMC和BMD的变化滞后于骨细胞活性及骨代谢的变化[10],6周时间过短,不足以出现BMC和BMD的显著性变化。Nordstrom等对平均年龄为21岁的男性运动员(足球、曲棍球)退役后的随访中发现,退役运动员的股骨颈BMD较未退役运动员下降,全身性BMD也低于后者[11]。运动强度降低使处于生长期骨的BMC和BMD都有不同程度下降[12-13]。
Lanyon提出最小有效应力与刺激理论,即保持骨量所需的应力大小,随着应力的分布、速度以及控制器的非机械性因素的变化而变化。根据Lanyon的理论,作用在骨细胞上的有效机械应力可引起骨组织产生形变,导致骨组织内的DNA和骨胶原合成增加,从而使骨量增加;当机械应力减少时,骨量也随着应力减少而出现废用性下降。
Frost提出“力学稳态理论”来解释应力引起骨量重新分配而适应力学环境的机制。他认为,骨量的增减取决于外力作用的大小,当应力作用于骨产生的应变处于生理范围时,骨吸收和骨形成速度相等,骨量维持平衡;应变超过生理范围上限时,骨形成速度大于骨吸收速度,骨量增加,骨骼进行塑建,即在骨表面形成板层骨,从而降低局部应变;应变小于生理范围下限时,骨吸收速度大于骨形成速度,总骨量减少,骨骼进行重建过程,即被吸收,从而使局部应变增大到生理范围[14]。
基于上述理论,我们认为,经过一段时间大强度训练后,应力部位骨骼的应变生理范围上调,即维持骨量所需的最小应力提高,这时只有在大强度负荷水平下才能保持骨代谢平衡。当运动强度下降,降低的运动负荷即使还处于正常骨的应变生理范围内,但低于已上调的最小应力阈值,使骨吸收大于骨形成,骨代谢出现负平衡。这可解释实验中运动强度骤降后骨细胞活性的改变和BMC和BMD的降低,也可解释大强度转低强度运动组骨形成指标低于持续低强度运动组,骨吸收指标高于持续低强度运动组。
运动对骨健康有着重要影响。持续的一定强度的运动能有效刺激骨组织,使骨形成大于骨吸收,有利于骨健康。当骤然出现明显的运动强度降低、运动量减少后,骨组织因承受的应力的改变而发生骨代谢的变化,骨形成减少,骨吸收增加,骨量出现废用性下降,增加骨质疏松的风险。总之,运动作为健骨手段,要有科学、规律的训练方法,才能真正起到促进骨健康、预防骨质疏松的作用。
[1]Kohrt WM,Bloomfield SA,Little KD,et al.Physical activity and bone health[J].Med Sci Sport Exer,2004,27:1985-1996.
[2]Benell KL,Khan KM,Warmington S,et al.Age does not influence the bone response to treadmill exercise in female rate[J].Med Sci Sport Exer,2002,10:1958-1962.
[3]房东梅.不同模式的跑台运动对生长期大鼠骨矿含量和力学特性的影响[J].体育科学,2009,29(6):73-76.
[4]邱平,李育民,高谨,等.运动对中老年人骨代谢生化指标的影响[J].中国康复医学杂志,2005,20:340-342.
[5]Lam KW,Li CY,Yam LT,et al.Comparison of the tartrateresistant acid phosphatase in Gaucher's disease and leukemic reticuloendotheliosis[J].Clin Biochem,1981,1:177-181.
[6]Iwamoto J,Shimamura C,Takeda T,et al.Effects of treadmill exercise on bone mass,bone metabolism,and calciotropic hormones in young growing rats[J].J Bone Miner Metab,2004,22:26-31.
[7]Iwamoto J,Takeda T,Sato Y.Effect of treadmill exercise on bone mass in female rats[J].ExpAnim,2005,54(1):1-6.
[8]Weiler R,Keen R,Wolman R.Changes in bone turnover markers during the close season in elite football(soccer)players[J].J Sci Med Sport,2011,9:1-4.
[9]Karlsson KM,Karksson C,Ahlborg HG,et al.Bone turnover responses to changed physical activity[J].Calcif Tissue Int,2003,72(6):675-680.
[10]Vincent KR,Braith RW.Resistance exercise and bone turnover in elderly men and women[J].Med Sci Sport Exer,2001,4:17-23.
[11]Nordstrom A,Karlsson C,Nyquist F,et al.Bone loss and fracture risk after reduced physical activity[J].J Bone Miner Res,2005,20(2):202-207.
[12]GustavssonA,Olsson T,Nordstrom P.Rapid loss of bone mineral density of the femoral neck after cessation of ice hockey training:a 6-year longitudinal study in males[J].J Bone Miner Metab,2003,18(11):1964-1969.
[13]Rautava E,Lehtonen-Veromaa M,Kautiainen H,et al.The reduction of physical activity reflects on the bone mass among females:a follow-up study of 142 adolescent girls[J].Osteoporos Int,2007,18:915-922.
[14]Frost HM.The role of changes in mechanical usage set points in the pathogenesis of osteoporosis[J].J Bone Miner Res,1992,7(3):253-261.

