药物和行为干预对缺血缺氧性脑损伤大鼠功能恢复的影响①
侯梅,杨会娟,姜艳平
缺血缺氧性脑损伤(hypoxic-ischemic brain damage,HIBD)是早产及低出生体重儿神经系统残疾的重要原因,严重影响着患儿、家庭和社会。单唾液酸神经节苷脂(GM1)和神经生长因子(NGF)作为神经营养药物被广泛用于HIBD后遗症患儿的临床治疗,其疗效、用药方法有待进一步验证。
1 资料和方法
1.1 动物模型 选择2日龄SD大鼠,雌雄不限。抽取7只入假手术组。其余幼鼠参照Han以及改良Rice法[1-2]制作脑室周围白质软化(PVL)动物模型:分离、结扎、切断左侧颈总动脉,入自制密封舱,通入6%O2+94%N2混合气体4 h,氧浓度范围为(6±0.3)%。观察模型制作后24 h大鼠活动情况,将能够正常吮乳的48只乳鼠分为:GM1治疗组、NGF治疗组、药物联合(GM1+NGF)治疗组、行为干预治疗组、药物联合+行为干预治疗组、模型对照组,每组8只。分组后,所有幼鼠由母鼠自由哺乳,单组单笼,每天更换干刨花,保持环境干燥。幼鼠在笼里自由活动,自然光环境生长。
1.2 干预措施
1.2.1 药物干预 GM1(博司捷):黑龙江哈尔滨医大药业有限公司,批准文号:国药准字H20060422;注射用鼠NGF(金路捷):武汉海特生物制药股份有限公司,批准文号:国药准字S20060051。采用腹腔内药物注射,自4日龄开始,每日1次连续7 d。药物治疗方案见表1。对照组采用等量生理盐水腹腔内注射。
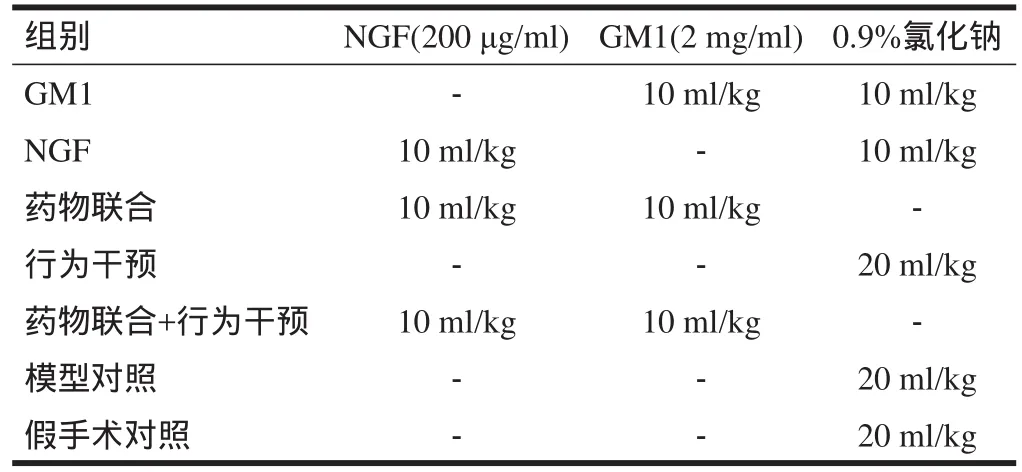
表1 实验动物腹腔内注射药物治疗方案
1.2.2 行为干预 行为干预自15日龄开始,共持续14 d。干预内容包括:①感觉促进训练:用硬毛刷刷右侧上下肢,按肢体长轴方向由近端至远端,加压快速刷4个8拍,每天1次;②肢体协调性及肌力训练:15日龄大鼠眼睛已睁开,放置于转笼里活动15 min/d,必要时给予夹尾刺激,使其转笼;③游泳训练:放置于水深约30 cm的温水槽(80×50×55 cm)中,水面离槽口20 cm左右,避免大鼠跳出水槽。用木棒驱赶大鼠在水中游泳10~15 min。
1.3 行为学测试 大鼠30日龄(相当于人类2~5岁)时进行神经行为学检测。
1.3.1 悬吊试验 大鼠前爪抓住一根水平悬吊的尼龙绳(直径约0.4 cm),尼龙绳长50 cm,离开桌面75 cm。记录大鼠在绳上的时间。评分标准:1分:<10 s,2分:10~30 s,3分:30 s~2 min,4分:2~5 min,5分:>5 min;当大鼠出现双上肢沿绳横走或屈曲躯干试图使下肢抓绳时,每项另加0.5分。
1.3.2 斜坡试验 将大鼠头向下倒置于45°的斜面上,记录转头向上>135°所需要的时间,取3次计算平均值。
1.4 统计学分析 采用SPSS 13.0统计软件进行处理。结果以(±s)表示。对于正态分布的计量资料,用单因素方差分析(ANOVA)进行显著性检验,需进行两两比较时,应用q检验。析因设计资料采用相应的方差分析进行比较。所有假设检验显著性水平α=0.05。
2 结果
2.1 生长情况 1日龄及4日龄各组大鼠体重无显著性差异(P>0.05)。10日龄各组大鼠间体重有显著性差异(P=0.032),NGF组大鼠体重高于其他各组(P<0.05),而其余各组间无显著性差异(P>0.05)。见表2。
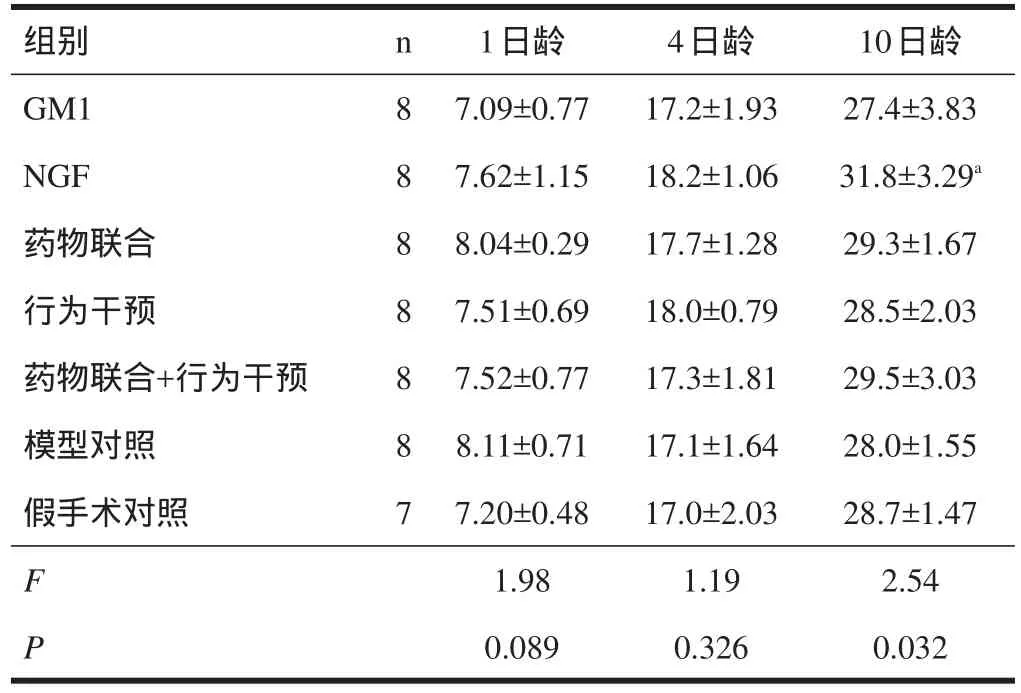
表2 各组大鼠体重比较(g)
2.2 悬吊实验 除NGF组外,其他各组动物成绩均高于模型对照组(P<0.05);各实验组成绩均低于假手术组,差异有统计学意义(P<0.05);药物联合+行为干预组成绩优于GM1组、NGF组及药物联合组(均P<0.05)。见表3。
田歌依然冷冷地回绝:“没什么好谈的。你不走,我就走。”思雨有些生气了。他愤愤地看了妻子一眼,然后离开了。
2.3 斜坡实验 各治疗组成绩均优于模型对照组(均P<0.05);除药物联合+行为干预组外,其余各组成绩均较假手术组低(均P<0.05);行为干预组、药物联合+行为干预组的成绩优于GM1、NGF及药物联合组(均P<0.05)。见表3。

表3 各组大鼠行为学测试比较
2.4 析因设计分析
2.4.1 悬吊实验 GM1与NGF无交互效应(F=1.620,P=0.214);GM1存在主效应(F=5.185,P=0.031),NGF无主效应(F=2.322,P=0.139)。药物联合治疗及行为干预无交互效应(F=0.348,P=0.560)。药物联合治疗(F=5.887,P=0.022)和行为干预(F=14.467,P=0.001)均存在主效应。
2.4.2 斜坡实验 GM1与NGF无交互效应(F=6.546,P=0.160); GM1(F=22.299,P=0.000)和 NGF(F=21.386,P=0.000)均存在主效应。药物联合治疗与行为干预存在交互效应(F=12.241,P=0.002),药物联合治疗(F=25.035,P=0.000)及行为干预(F=8.548,P=0.000)均存在主效应。
3 讨论
未成熟HIBD的细胞分子学及生物化学机制包括[3]:①缺氧缺血后脑灌注及代谢的变化;②细胞毒性机制;③缺氧缺血后神经元死亡的机制;④基因表达的改变:热休克蛋白(heat shock proteins,HSP)生成上调,神经营养因子的分泌等。
2日龄大鼠的脑组织处于少突胶质细胞前体细胞发育时期,相当于人类妊娠24~32周胎儿发育时期[4]。此阶段出生的活产儿中,PVL的发生率约为2‰~4‰,且随着出生胎龄的降低而升高[5]。
研究证实[6-8],中枢神经系统具有高度的可塑性,主要表现为突触的形成、结构及功能的调节。早期给予丰富环境、各种感觉运动刺激、神经营养因子等均能够增强神经可塑性。GM是组成细胞膜结构和维持膜功能的基本物质,外源性GM1能够透过血脑屏障,嵌入膜结构中,调节膜介导的细胞功能,启动受损后潜在的代偿机制,促进神经重构,保护未受损害的神经组织,阻止损害进一步发展[9]。NGF不但具有促进神经元原有轴突的出芽、分枝及生长的功能[10],而且还能够促进那些未长出轴突的神经干细胞在神经元分化过程中向极化状态转变,并增加生长锥的生成,增加分化后神经元轴突的数量。
本研究通过行为学评分观察神经营养药物对大鼠脑功能的影响,结果表明,单一药物治疗即可取得满意结果,联合用药并不能增加疗效。本实验中,单纯NGF治疗在改善上肢肌力以及随意运动能力(悬吊试验)方面没有显示疗效,原因可能与该组动物的体重增长较其他各组快,影响了悬吊实验测试结果有关。
临床上,运动疗法是改善HIBD后遗症患儿躯体功能最主要的治疗方式。Jones对实验动物进行了行为干预与突触可塑性之间的相关性研究,发现大鼠前肢感觉运动皮质损伤后,综合的复杂运动技能训练要比重复性简单运动更能刺激大脑皮质突触的发生、促进运动功能恢复[14]。行为干预能够增强感觉输入,改善神经元的微环境,刺激多种神经营养因子的分泌,诱导神经前体细胞分裂和增殖[15-16],从而促进损伤修复。我们的观察显示,单纯行为干预及联合药物治疗均能够明显提高实验动物的肌力、随意运动以及躯体的平衡和协调功能(斜坡试验),并存在协同效应,证实了临床运动疗法的价值。
本实验提示,GM1及其与NGF联用都能够明显改善实验动物的肌力和随意运动以及躯体平衡和协调功能;对于NGF,本次实验只发现了其对躯体平衡和协调功能有改善,两者联用较单药治疗并未表现出明显优势,提倡单药治疗。行为干预能够提高实验动物的肌力和随意运动能力、改善实验动物的躯体协调及平衡功能,联合药物治疗可取得协同效应。
[1]Back SA,Lou NL,Borenstein NS,et al.Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury[J].J Neurosci,2001,21(4):1302-1312.
[2]Rice JE 3rd,Vannucci RC,Brierley JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131-141.
[3]Vexler ZS,Ferriero DM.Molecular and biochemical mechanisms of perinatal brain injury[J].Semin Neonatol,2001,6(2):99-108.
[4]Fukuda S,Kato T,Kakita H,et al.Hemodynamics of the cerebral arteries of infants with periventricular leukomalacia[J].Pediatrics,2006,117(1):1-8.
[5]Bajwa NM,Berner M,Workey S,et al.Population based age stratified morbidities of premature infants in Switzerland[J].Swiss Med Wkly,2011,141:w13212.
[6]Klinstsova AY,Greenough WT.Synaptic plasticity in cortical systems[J].Curr Opin Neurobiol,1999,9(2):203-208.
[7]Kreisel SH,Hennerici MG,Bazner H.Pathophysiology of stroke rehabilitation:the natural course of clinical recovery,use-dependent plasticity and rehabilitative outcome[J].Cerebrovasc Dis,2007,23(4):243-255.
[8]Navarro X,Vivo M,Valero-cabro A.Neural plasticity after peripheral nerve injury and regeneration[J].Prog Neurobiol,2007,82(4):163-201.
[9]Wu G,Lu ZH,Obukhov AG,et al.Induction of calcium influx through TRPC5 channels by cross-linking of GM1 ganglioside associated with alpha beta1 integrin initiates neurite outgrowth[J].J Neurosci,2007,27(28):7447-7458.
[10]Panni MK,Cooper JD,Panni MK,et al.Ganglioside GM1 potentiates NGF action on axotomised medial septal cholinergic neurons[J].Brain Res,1998,812(1-2):76-80.
[11]Huang F,Liu Z,Liu H,et al.GM1 and NGF modulate Ca2+homeostasis and GAP43 mRNA expression in cultured dorsal root ganglion neurons with excitotoxicity induced by glutamate[J].Nutr Neurosci,2007,10(3-4):105-111.
[12]Huang F,Dong X,Zhang L,et al.GM1 and nerve growth factor modulate mitochondrial membrane potential and neurofilament light mRNA expression in cultured dorsal root ganglion and spinal cord neurons during excitotoxic glutamate exposure[J].J Clin Neurosci,2010,17(4):495-500.
[13]Duchemin AM,Neff NH,Hadjiconstantinou M.GM1 increases the content and mRNA of NGF in the brain of aged rats[J].Neuroreport,1997,8(17):3823-3827.
[14]Jones TA,Chu CJ,Grande LA,et a1.Motor skills training enhances lesion-induced structural plasticity in the motor cortex of adult rats[J].J Neurosci,1999,19(22):10153-10163.
[15]袁华,龙华,李玲.康复训练对脑梗死大鼠皮质S-100、GFAP和Nestin表达的影响[J].中华物理医学与康复杂志,2003,25:520-523.
[16]Binemaskie J,Corbett D.Enriched rehabilitative training promotes improved forelimb motor function and enhanced dendritic growth after focal ischemic injury[J].J Neurusci,2001,21(14):5272-5280.

