人颞叶内侧癫痫海马组织星形胶质细胞水通道蛋白4和内向整流性钾离子通道4.1的再分布①
徐仟,孙振荣,李桂林,孙异临,杨少华,,袁芳
颞叶内侧癫痫(mesial temporal lobe epilepsy,MTLE)是顽固性癫痫中最常见的类型,发作起源于颞叶内侧结构,主要病理改变是海马硬化,表现为星形胶质细胞大量增生和神经元显著丢失;切除硬化海马是临床控制癫痫发作的有效方法。MTLE特殊的病理变化促进人们开始关注星形胶质细胞在癫痫发病中的作用。
星形胶质细胞是大脑中数量最多的神经细胞,在维持脑内微环境稳定方面发挥重要作用。已有的研究表明,神经元的兴奋性与细胞外间隙及K+浓度变化密切相关。近年来的研究已证实,水通道蛋白4(aquaporin 4,AQP4)和内向整流性钾离子通道(inwardly rectifying potassium channel,Kir4.1)在星形胶质细胞血管周围足突(perivascular astrocyte end-feet,pAST-ef)上呈现极性分布,两者不仅在结构上共表达[1-2],而且在功能上相耦联[3-4]:AQP4介导水分子跨细胞膜转运的同时,伴随着Kir4.1对细胞外K+缓冲作用,共同维持脑组织内环境的稳定[5]。Amiry-Moghaddam等发现,敲除α-syntrophin基因的小鼠惊厥易感性增加,同时海马区域pAST-ef存在AQP4显著缺失和Kir4.1部分缺失,细胞外K+清除时间延长,提示AQP4和Kir4.1极性分布改变可能参与癫痫的发生[6]。本实验拟应用手术切除MTLE海马组织,运用免疫荧光染色技术观察星形胶质细胞AQP4和Kir4.1的分布情况,为探讨星形胶质细胞在颞叶内侧癫痫发生中的作用提供形态学依据。
1 材料与方法
1.1 实验试剂和实验器材 胶质纤维酸性蛋白抗体(glial fibrillary acidic protein,GFAP): DAKO,Z0334;AQP4抗体:ABCAM,ab46182;Kir4.1抗体:ABCAM,ab80959;山羊抗兔荧光二抗:中杉金桥,IgG/Dylight594,红色;山羊抗兔荧光二抗:中杉金桥,FITC,绿色;DIPA封片剂:中杉金桥,ZLI-9057;光学显微镜:OLYMPUS,SZX-MVX10;透射电子显微镜:HITACHI,H-7650;倒置相差荧光显微镜:NIKON,Eclipse E600)。
1.2 实验材料 收集2009年9月~2011年4月首都医科大学附属北京天坛医院神经外科16例行海马切除术治疗癫痫患者的海马组织。切除海马组织离体后,即刻放入4%多聚甲醛及2.5%戊二醛中固定,分别进行后续处理。
1.3 实验方法
1.3.1 分组 海马组织经常规固定、包埋、切片(片厚4µm)及HE染色后,在光学显微镜下观察。依据病理学改变将海马组织分为病例组(MTLE)和对照组(非颞叶内侧癫痫,non-mesial temporal lobe epilepsy,non-MTLE)。MTLE海马硬化诊断标准为海马组织神经元丢失>50%及大量星形胶质细胞增生[7],共10例;non-MTLE诊断标准为海马组织表现为轻度神经元丢失(<25%)及少量星形胶质细胞增生,存在海马结构附近脑组织的病变[7],共6例,分别为节细胞胶质瘤1例、皮层发育不良4例、静脉瘤1例。详见表1。
1.3.2 透射电镜检查 海马组织2.5%戊二醛4℃固定2 h后,依次1%锇酸固定,环氧丙烷置换,树脂(EPON 812)包埋,1µm半薄切片定位,40 nm超薄切片醋酸双氧铀-枸橼酸铅染色,在透射电镜(H-7650)下观察。对照组选择4例,病例组选择7例。
1.3.3 免疫荧光组织化学染色及图像分析 制备4µm石蜡切片,0.01 mol/L枸橼酸钠缓冲液(pH=6.0)微波热修复,山羊血清封闭,分别滴加一抗GFAP(1∶400)、AQP4(1∶80)、Kir4.1(1∶20),4 ℃孵育过夜;IgG/Dylight594或FITC标记荧光二抗(山羊抗兔1∶100)室温孵育2 h;DIPA封片剂封片,倒置相差荧光显微镜观察、拍照。阴性对照用PBS代替一抗,其余步骤相同。应用Image-Pro Plus 6.0图像分析软件,将图片黑白反相处理,随机选取6个pAST-ef区域及6个等面积其他部位区域计算平均光密度值(average optical density,AOD),分别记为AOD1和AOD2,以AOD1/AOD2值表示pAST-ef部位AQP4或Kir4.1的蛋白表达水平。
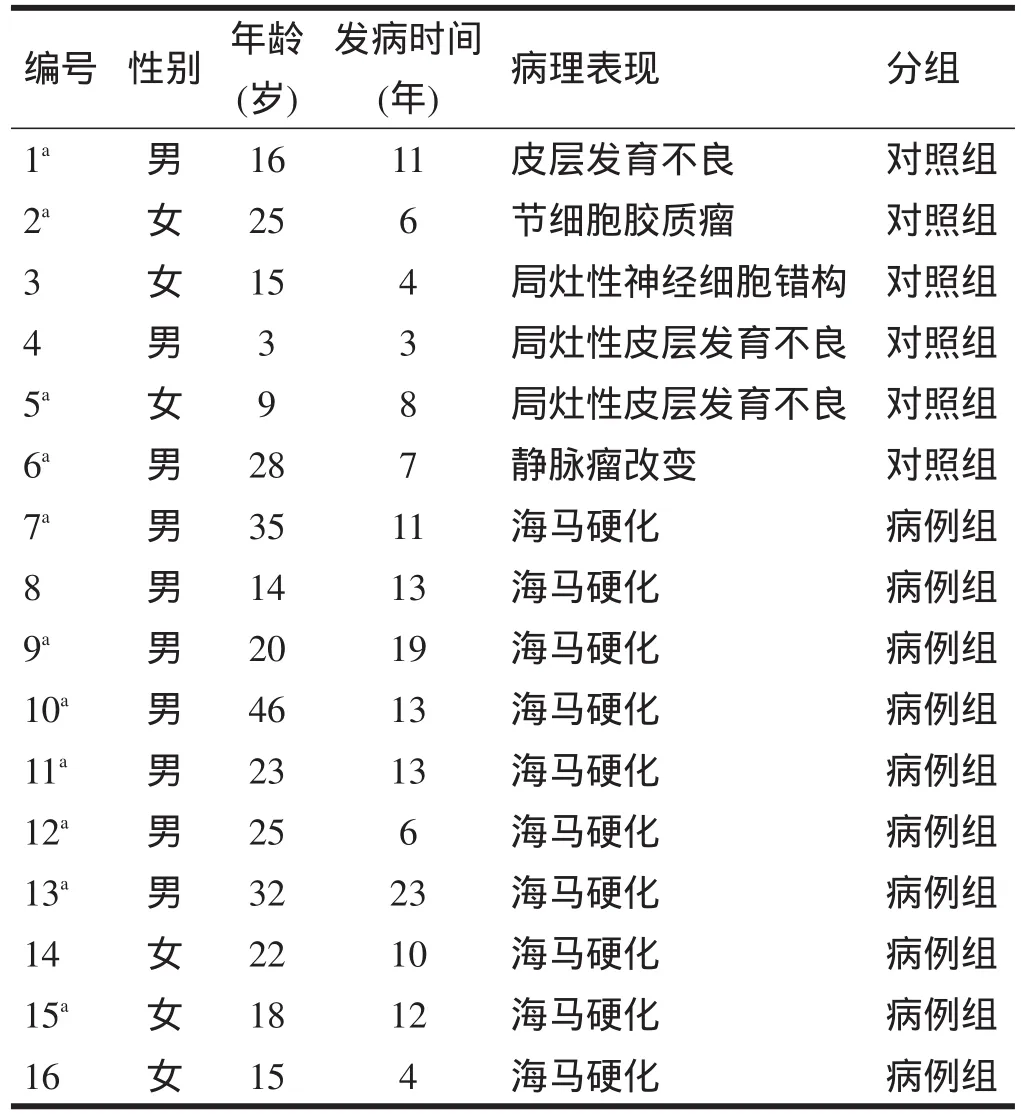
表1 患者基本资料
1.4 统计学分析 采用SPSS 13.0 for Windows统计软件进行t检验,显著性水平α=0.05。应用Microcal Origin统计绘图软件做图。
2 结果
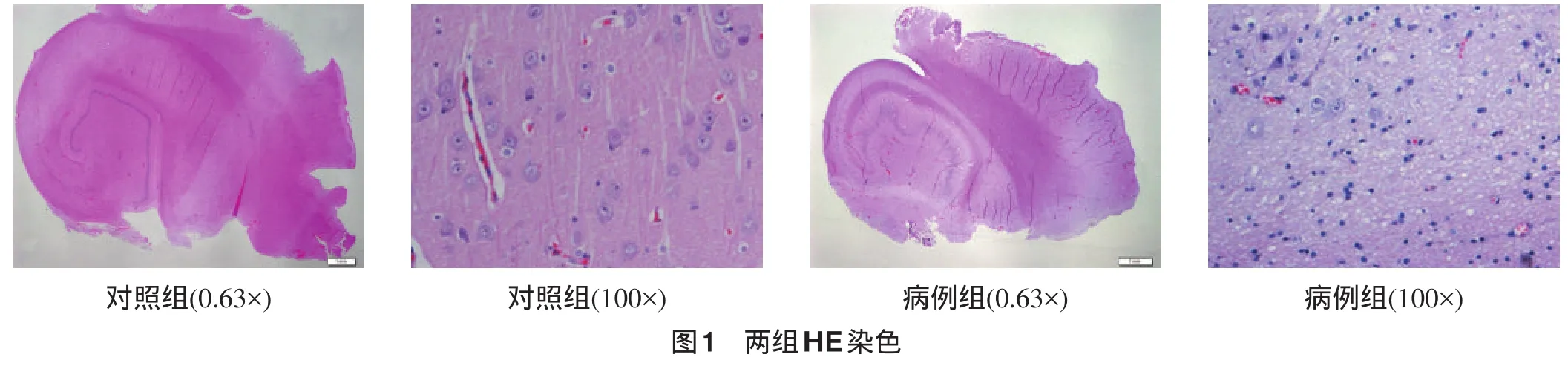
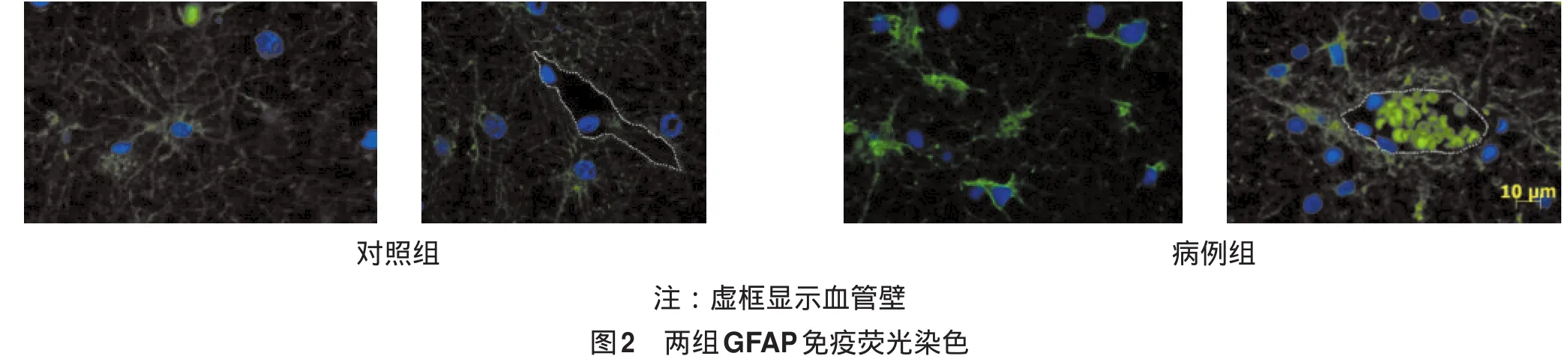
2.1 光镜检查 HE染色显示对照组海马CA3区神经元形态正常,星形胶质细胞轻度增生(图1);GFAP免疫荧光染色显示阳性细胞着色浅淡,血管周围绿色荧光提示星形胶质细胞足突包绕血管(图2)。病例组海马CA3区神经元显著丢失,星形胶质细胞大量增生(图1),GFAP阳性细胞着色加深,血管周围绿色荧光着色较细胞其他部位浅淡,同时与血管壁之间间隙增大(图2)。阴性对照未见GFAP着色。
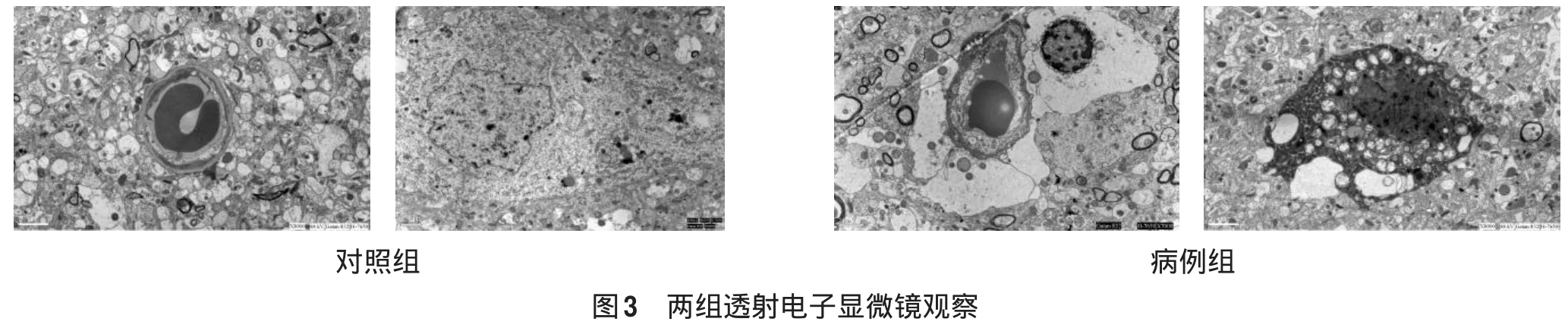
2.2 透射电镜检查 对照组海马组织星形胶质细胞胞体轻度肿胀;神经元核膜轻度凹陷,线粒体轻度肿胀;血管形态正常(图3)。病例组海马组织星形胶质细胞胞体及血管周围足突均高度肿胀;神经元核膜皱缩,核内染色质聚集,线粒体高度肿胀;血管受压,管腔狭长,内皮细胞不同程度增生(图3)。
2.3 免疫荧光组织化学染色 对照组中AQP4主要分布于pAST-ef,其他部位没有分布;病例组中AQP4在pAST-ef分布减少,而其他部位分布明显增加(图4)。Kir4.1的分布及变化与AQP4相似(图4)。阴性对照均未见AQP4及Kir4.1着色。图像分析显示,pAST-ef部位AQP4蛋白表达量在对照组及病例组分别为(27.69±5.42)及(2.93±0.48)(P<0.05);Kir4.1蛋白表达量分别为(39.33±5.18)及(13.77±2.72)(P<0.05)。
3 讨论
人MTLE特殊的病理改变为研究星形胶质细胞在癫痫发病中的作用提供了一个很好的模型。本研究发现,MTLE患者硬化海马区域星形胶质细胞大量增生伴高度肿胀,星形胶质细胞上AQP4和Kir4.1发生再分布,提示两者极性分布的改变参与了MTLE的病理过程。
AQP4是中枢神经系统分布最广泛的水通道蛋白,特异地在星形胶质细胞膜上表达,起着跨膜转运水分子的作用[8]。生理状态下,AQP4在星形胶质细胞膜上呈极性分布,主要分布在pAST-ef,细胞外间隙水分子通过星形胶质细胞转运到血管,以维持细胞内外水分代谢平衡[9-10]。本研究发现,MTLE患者硬化海马区域星形胶质细胞肿胀,AQP4极性分布发生改变,在pAST-ef显著减少,而其他部位分布增加,说明AQP4功能障碍导致星形胶质细胞肿胀。Eid等也报道,与non-MTLE相比,MTLE患者硬化海马pAST-ef处AQP4分布减少44%左右[11]。我们推测,AQP4的再分布影响了星形胶质细胞对水平衡的调节作用,水分子滞留于星形胶质细胞内,导致细胞肿胀,细胞外间隙容积减少,间接引起细胞外兴奋性氨基酸和K+浓度增加,提高局部脑组织的兴奋性;另有研究显示,肿胀的星形胶质细胞通过容积敏感性阴离子通道(volume-regulated anion channels,VRACs)释放兴奋性氨基酸,导致脑组织细胞外间隙兴奋性氨基酸浓度增高,从而激活神经元引起颞叶癫痫发生[12]。
Kir4.1亦是中枢神经系统一种重要的膜蛋白,主要在星形胶质细胞膜上表达,起着跨膜转运K+的作用,且呈电压依赖性[13]。星形胶质细胞静息膜电位取决于K+扩散平衡电位,Kir4.1主要介导K+由细胞外向细胞内运输;当神经元兴奋时细胞外K+浓度增加,细胞内外电压差增高,K+通过星形胶质细胞上Kir4.1进入细胞内,再由pAST-ef处Kir4.1输送到血管内,达到清除细胞外K+,维持内环境稳定的作用[14]。虽然在星形胶质细胞瘤及胶质母细胞瘤上观察到pAST-ef处Kir4.1极性分布改变[15],但是在癫痫患者脑组织中Kir4.1分布变化还未见报道。本研究发现,MTLE患者硬化海马区域Kir4.1在pAST-ef分布减少,极性分布改变,推测可能会引起星形胶质细胞清除K+能力降低。Hinterkeuser等利用膜片钳技术发现,MTLE患者硬化海马星形胶质细胞上Kir4.1对于细胞外K+缓冲能力降低,细胞外间隙K+聚集[16]。而细胞外K+浓度不足微摩尔水平的升高就可以急剧增加癫痫样活动的发生[17-18]。另外,Kuncheryavykh等采用siRNA技术敲除大鼠大脑皮层胶质细胞的Kir4.1基因后发现,星形胶质细胞呈现去极化状态,并且对细胞外谷氨酸摄取减少33%,使得细胞外谷氨酸浓度增加引起癫痫发生[19]。
根据以上研究结果推测,Kir4.1的再分布使K+由细胞运送到血管内产生障碍,K+在细胞内过量聚集及清除细胞外K+功能降低,细胞内外电压差减低,呈现去极化状态;Kir4.1对K+缓冲能力减弱,以及对谷氨酸摄取能力的减低,加之AQP4再分布引起的胞外容积减少,使得神经元产生兴奋性后释放到胞外的K+及谷氨酸异常聚集,引起局部脑组织兴奋性增加,参与MTLE的发生。
[1]Masaki H,Wakayama H,Hara H,et al.Immunocytochemical studies of aquaporin 4,Kir4.1,and α1-syntrophin in the astrocyte endfeet of mouse brain capillaries[J].Acta Histochem Cytochem,2010,43(4):99-105.
[2]Ruiz-Ederra J,Zhang H,Verkman AS.Evidence against functional interaction between aquaporin-4 water channels and kir4.1 potassium channels in retinal muller cells[J].J Biol Chem,2007,282(30):21866-21872.
[3]Dibaj P,Kaiser M,Hirrlinger J,et al.Kir4.1 channels regulate swelling of astroglial processes in experimental spinal cord edema[J].J Neurochem,2007,103(6):2620-2628.
[4]Liu XQ,Kobayashi H,Jin ZB,et al.Differential expression of Kir4.1 and aquaporin 4 in the retina from endotoxin-induced uveitis rat[J].Mol Vis,2007,13:309-317.
[5]Nagelhus EA,Mathiisen TM,Ottersen OP.Aquaporin4 in the central nervous system:Cellular and subcellular distribution and coexpression with Kir4.1[J].Neuroscience,2004,129(4):905-913.
[6]Amiry-Moghaddam M,Williamson A,Palomba M,et al.Delayed K+clearance associated with aquaporin-4 mislocalization:Phenotypic defects in brains ofα-syntrophin-null mice[J].Proc NatlAcad Sci USA,2003,100(23):13615-13620.
[7]de Lanerolle NC,Kim JH,Williamson A,et al.A retrospective analysis of hippocampal pathology in human temporal lobe epilepsy:evidence for distinctive patient subcategories[J].Epilepsia,2003,44(5):677-687.
[8]师忠芳,袁芳.脑内水通道蛋白4表达调节的研究进展[J].中国康复理论与实践,2007,13(8):724-726.
[9]Yang B,Zador Z,Verkman AS.Glial cell aquaporin-4 overexpression in transgenic mice accelerates cytotoxic brain swelling[J].J Biol Chem,2008,283(22):15280-15286.
[10]Manley GT,Binder DK,Papadopoulos MC,et al.New insights into water transport and edema in the central nervous system from phenotype analysis of aquaporin-4 null mice[J].Neuroscience,2004,129(4):983-991.
[11]Eid T,Lee TS,Thomas MJ,et al.Loss of perivascular aquaporin 4 may underline deficient water and K+homeostasis in the human epileptogenic hippocampus[J].Proc Natl Acad Sci USA,2005,102(4):1193-1198.
[12]Benfenati V,Caprini M,Nicchia GP,et al.Carbenoxolone inhibits volume-regulated anion conductance in cultured rat cortical astroglia[J].Channels(Austin),2009,3(5):323-336.
[13]Neusch C,Weishaupt JH,Bahr M.Kir channels in the CNS:emerging new roles and implications for neurological diseases[J].Cell Tissue Res,2003,311(2):131-138.
[14]Hibino H,Inanobe A,Furutani K,et al.Inwardly rectifying potassium channels:their structure,function,and physiological roles[J].Physiol Rev,2010,90(1):291-366.
[15]Warth A,Mittelbronn M,Wolburg H,et al.Redistribution of aquaporin 4 and Kir4.1 differs in low-and high-grade human brain tumors[J].Acta Neuropathol,2005,10(4):418-426.
[16]Hinterkeuser S,Schroder W,Hager G,et al.Astrocytes in the hippocampus of patients with temporal lobe epilepsy display changes in potassium conductances[J].Eur J Neurosci,2000,12(6):2087-2096.
[17]Benfenati V,Nicchia GP,Svelto M,et al.Functional down-regulation of volume-regulated anion channels in AQP4 knockdown culture rat cortical astrocytes[J].J Neurochem,2007,100(1):87-104.
[18]Devin K,Steinhauser B,Steinhauser C.Role of astrocytes in epilepsy[M].//Parpura V,Haydon PG.Astrocytes in(Patho)Physiology of the Nervous System.Berlin:Springer,2009:649-671.
[19]Kucheryavykh YV,Kucheryavykh LY,Nichols CG,et al.Downregulation of Kir4.1 inward rectifying potassium channels subunits by RNAi impairs potassium transfer and glutamate uptake by cultured cortical astrocytes[J].Glia,2007,55(3):274-281.

