骨髓瘤细胞裂解物致敏的DC-CIK细胞抗骨髓瘤细胞作用①
罗 云 白凤霞 张 萍 娄世锋 (重庆医科大学附属第二医院血液科,重庆400010)
多发性骨髓瘤(Multiple Myeloma,MM)是浆细胞的恶性肿瘤,好发于老年人,占血液肿瘤的第二位。随着多发性骨髓瘤治疗新药的出现及干细胞移植技术的进步,多发性骨髓瘤治疗缓解率较前大为提高,生存时间明显延长[1];但复发、难治仍是临床面临的巨大难题。寻找新的治疗手段或联合治疗方案仍然具有紧迫性,过继细胞免疫治疗毒副反应轻,适应人群广,通过直接向肿瘤患者输注具有抗肿瘤活性的免疫活性细胞,使其在体内发挥抗肿瘤作用。CIK细胞单独或与DC细胞联合已广泛用于实体肿瘤和白血病,但鲜见用于骨髓瘤。我们自2011年7月~2011年12月体外培养负载骨髓瘤裂解物的健康供者DC联合CIK细胞,观察其对骨髓瘤U266细胞株的杀伤作用,以期进一步应用于临床。
1 材料与方法
1.1 材料 U266细胞株购自中国医学科学院肿瘤医院细胞库,RPMI1640培养基购自 Gibco公司,IFN-γ购自上海凯茂生物公司,IL-2购自北京双鹭药业、IL-4、rhGM-CSF厦门特宝生物公司馈赠,淋巴细胞分离液购自天津灏洋生物制品公司,TNF-α购自Protech公司,蛋白定量试剂盒购自南京凯基生物公司,NP40购自Abbott公司;荧光素FITC标记的鼠抗人CD3、CD1a及CD83,藻红蛋白PE标记的鼠抗人CD8和CD56及CD86和CD80单克隆抗体购自BD公司;CO2培养箱(上海力申科学仪器公司),倒置显微镜(重庆光学仪器厂),全自动生化仪(日本日立公司),离心机(湖南平凡仪器厂),流式细胞仪(美国BD公司)。
1.2 骨髓瘤U266细胞抗原制备 U266细胞在含10%胎牛血清的RPMI1640培养液中培养,每3~4日换液;取足够的对数生长期细胞,在-80℃深低温冰箱冰冻,然后复温至37℃,反复冻融3次,再于冰浴中超声波破碎后,离心(1 000 r/min,5分钟),收集上清液,用孔径为0.22 μm滤膜过滤灭菌,通过蛋白定量试剂盒检测蛋白含量,最后-80℃保存,作为抗原备用。
1.3 CIK细胞的培养征得异基因干细胞移植供者知情同意并签署知情同意书后,用血细胞分离机(COBE公司)单个核程序单采健康供者(共5例,具体见表1)。
单个核细胞悬液100 ml,自体血浆200 ml,然后淋巴细胞分离液再次分离收集细胞,分装,部分细胞冻存,剩余细胞培养在含10%自体血浆RPMI1640培养液中,4~6小时后,贴壁细胞用于DC细胞培养,取悬浮细胞离心,重悬细胞,调整细胞密度为1 ×106ml-1,加入含 IFN-γ(1 000 U/ml)培养1 日,第2日加入含小鼠抗人CD3单克隆抗体(100 mg/ml)、IL-2(1 000 U/ml)的CIK培养液,置于37℃,5%CO2体积分数为的培养箱中,每隔3天补充新鲜培养液。
1.4 DC细胞的培养 取上述贴壁细胞培养在含10%自体血浆RPMI1640培养液中,培养液中加入rhGM-CSF(1 000 U/ml)和 IL-4(1 000 U/ml);每3天换液,第7日将培养DC细胞分为2组,一组加入TNFα 500 U/ml,另一组加入U266细胞裂解物100 μg/ml,分别与上述培养 CIK细胞再共培养7日(n=5)。
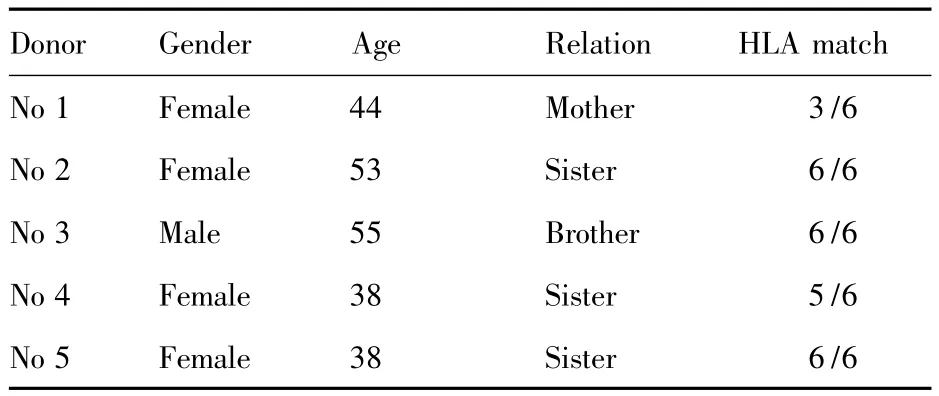
表1 异基因干细胞供者资料Tab.1 Donor characteristics
1.5 CIK及DC细胞形态观察 在倒置显微镜下观察培养细胞的形态,收集培养细胞PBS洗涤后涂片,3%戊二醛4℃固定2小时,再以体积分数为1%锇酸固定,梯度酒精脱水,用六甲基二硅胺烷干燥,喷镀、导电,KYKY 1000B型扫描电镜观察,并摄片。
1.6 CIK及DC细胞表型测定 收集培养的细胞1×106ml-1,离心用PBS洗涤2次,每管分别加入藻红蛋白PE标记,荧光素FITC标记CD单抗各10 μl,室温避光孵育30分钟,再用PBS洗掉未结合单抗,流式细胞仪上机检测细胞表面标志(n=5)。
1.7 CIK细胞及DC-CIK细胞杀伤活性检测(LDH法) 24孔板中将培养的CIK与DC-CIK细胞与靶细胞 U266 按5∶1、10∶1 及20∶1 混合,同时设定自然释放孔及单独加NP40的最大释放孔,每组设3个复孔;37℃ 5%CO2培养箱孵育4小时后离心取上清液,全自动生化仪测定LDH含量,同时以白血病K562细胞株作为对照组(n=5)。按如下公式计算杀伤率:杀伤率(%)=(试验孔-靶细胞自然释放孔)/(靶细胞最大释放孔-靶细胞自然释放孔)×100%。
2 结果
2.1 CIK及DC细胞形态 培养的CIK细胞大部分为圆形,少数为梭形(图1),DC细胞培养3~4天后开始出现突起,有聚集成簇现象(图2),贴壁5~6日后逐渐开始悬浮生长,扫描电镜下可见:DC体积较大,胞体突起形成不规则形态,表面粗糙,有圆形或椭圆形隆起,层叠状皱襞(图2)。

图1 倒置显微镜下培养12日的CIK细胞(×200)Fig.1 CIK cells were observed by inverted microscope at 12 days(×200)
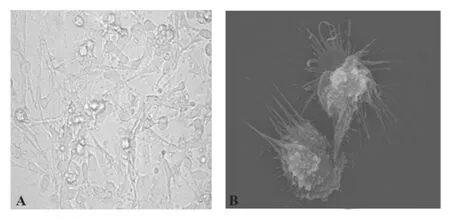
图2 倒置显微镜(A,×400)及扫描电镜(B,×1 500)下观察培养7日的DC细胞图片Fig.2 Dendritic cells were observed by inverted microscope(A,×400)and scanning(B,×1 500)
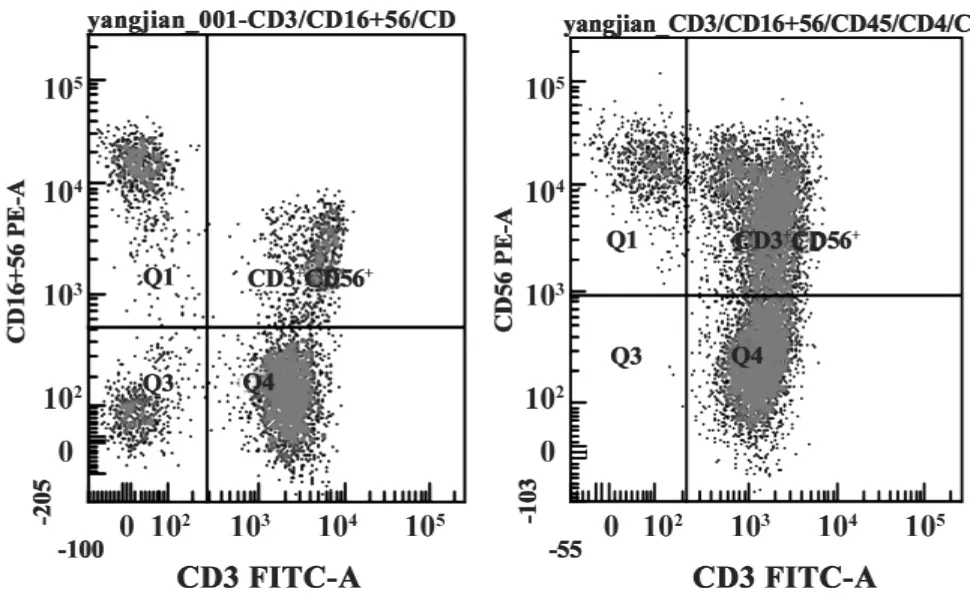
图3 培养第7日及培养第14日的CIK细胞CD3、CD56共表达Fig.3 CIK cells surface co-expressed CD3 and CD56 at 7 days and 14 days
2.2 CIK及DC细胞表面标志 利用流式细胞仪检测培养12~14日CIK细胞高表达CD3,CD3及CD56共表达明显升高(图3),未成熟DC细胞高表达CD1a,经过 TNF-α或瘤细胞裂解物刺激表达CD86、CD80明显升高。
2.3 CIK和负载瘤细胞裂解物DC-CIK对U266杀伤作用 U266细胞自然释放及培养CIK细胞和DC-CIK作用U266细胞后乳酸脱氢酶经过全自动生化仪检测,两组各自的杀伤活性均随效靶比升高而增强,各效靶比间的差异有显著统计学意义(P<0.05)。负载瘤细胞裂解物DC-CIK与单独CIK在同效靶比下杀伤性更强,各组间差异有显著统计学意义(P<0.05)。培养的CIK细胞对K562细胞杀伤率亦随效靶比升高而增加,但负载骨髓瘤细胞抗原DC细胞与CIK细胞共培养后对K562细胞杀伤率与单独CIK细胞比较无明显差异(P>0.05),见图4、5。
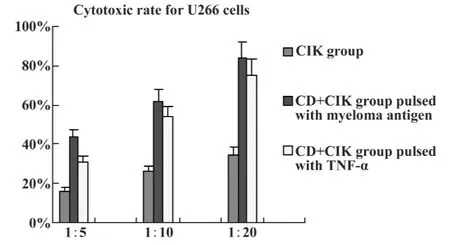
图4 CIK及DC+CIK对U266细胞作用(n=5)Fig.4 CIK cells or DC+CIK cytotoxic effect for myeloma U266 cell(n=5)
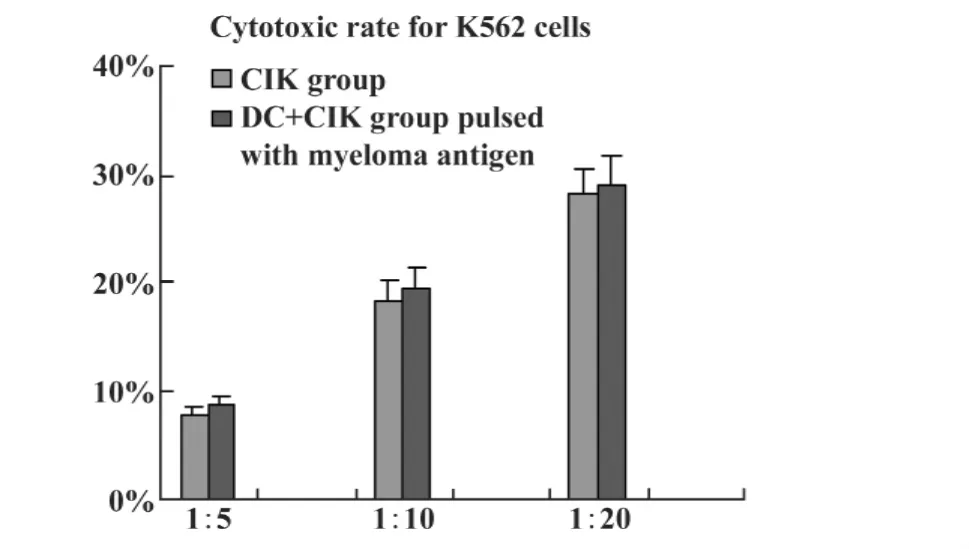
图5 CIK及负载骨髓瘤抗原的DC+CIK对K562细胞作用(n=5)Fig.5 CIK cells or DC+CIK cells cytotoxic effect for K562 cell(n=5)
3 讨论
多发性骨髓瘤是高发于老年人的血液系统常见恶性肿瘤,发展较为缓慢。临床治疗效果欠佳,完全缓解率(CR)低,自体移植可提高CR率,但多数患者因体内残留的瘤细胞而使疾病复发。异基因干细胞移植因患者年龄问题多采用非清髓移植方式,本研究通过异基因CIK细胞及负载瘤细胞抗原的DCCIK细胞证实了两种培养细胞均对骨髓瘤细胞U266有杀伤活性,为骨髓瘤自体或非清髓异基因干细胞移植术后应用CIK或DC-CIK细胞清除体内残留的瘤细胞以减少疾病复发提供理论和实验依据。LDH释放法检测结果显示:负载瘤细胞抗原的DCCIK细胞对U226细胞的杀伤活性在相同效靶比时比单独CIK细胞更强,差异有显著统计学意义。
CIK细胞为一异质细胞群,大于90%表达CD3,这其中包括约35%共表达CD 56的细胞[2]。CIK细胞输注首先要保证质量及数量,应减少或避免传染疾病的机会,常规的来源以自体外周血居多,经过体外培养后CD3+CD56+细胞能够大量扩增,而在未培养的外周血中含量极少,只有1% ~5%。在培养2~3周后,CIK细胞比例可由0.1% ~0.13%上升至19%~20.5%,细胞数量平均增加25倍(2.2~525倍)。我们培养的CIK细胞表型与文献相似,与以往的LAK、CD3AK细胞相比,CIK细胞扩增能力及杀伤活性均有提高。CIK细胞既有T淋巴细胞的抗肿瘤特性,又有NK细胞的非MHC限制性杀瘤特点,对很多肿瘤均有杀伤活性,很多研究也已证实了该活性,如对结肠癌SW620和LOVO细胞株;鼻咽癌 CNE-1、CNE-2Z、NP69 细胞株;肾癌 A704;宫颈癌、卵巢癌等,且对自体和异体肿瘤等均有较好的抗瘤效果。CIK细胞作用机理在于可分泌穿孔素(Perforin)及颗粒酶(Granzyme)杀伤靶细胞;同时CIK细胞活化后可分泌多种细胞因子,如IL-2,TNF-α,IFN-γ等,不仅可直接杀伤肿瘤细胞,还可通过对机体免疫系统的调节来间接杀伤肿瘤细胞[3]。Introna等[4]做了异基因(供者)CIK治疗异基因造血干细胞移植后复发病例的Ⅰ期临床研究:移植后复发的11例患者入组,治疗后1例病情稳定,1例血液学情况改善,3例完全缓解,结果令人鼓舞。
DC是已知功能最强的抗原呈递细胞(APC),存在于除脑组织外的所有组织器官中,与B细胞、巨噬细胞、活化的T淋巴细胞等其它APC不同的是,DC是唯一能刺激初始T淋巴细胞增殖的APC,是机体免疫反应的始动者。DC通过MHCⅡ类分子途径激活初始CD4+T细胞,DC也能直接向CD8+CTL呈递抗原,CD4+和CD8+T 细胞通过共同分泌细胞因子或直接杀伤肿瘤细胞而产生抗肿瘤反应[5]。DC在体内的数量极少,占人外周血单个核细胞的1%以下,体外分离肿瘤抗原脉冲DC,使其致敏得到DC瘤苗,该瘤苗进入体内不仅保证肿瘤抗原被有效摄取、呈递,还可提供攻击肿瘤细胞必需的共刺激分子,能够结合并杀伤肿瘤细胞[6]。负载肿瘤抗原DC细胞与CIK细胞共培养取得更强杀伤活性,估计与CIK细胞不均质,部分CD8细胞被激活有关。
1 Bladé J,Rosiñol L,Cibeira M T et al.Hematopoietic stem cell transplantation for multiple myeloma beyond 2010[J].Blood,2010;115(18):3655-3663.
2 Linn Y C,Lau L C,Hui K M et al.Generation of cytokine-induced keller cells from leukaemic samples with in vitro cytotoxicity against autologous and allogeneic leukaemic blasts[J].Br J Haemat,2002;116(1):78-86.
3 杨 葳,徐铭宝.CIK细胞治疗恶性肿瘤研究进展[J].国用医药,2009;29(4):217-219.
4 Introna M,Borleri G,Conti E et al.Repeated infusions of donor-derived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation:a phase I study[J].Haematologica,2007;92(7):952-959.
5 Fields R C,Shimizu K,Mule J J.Murine dentritic cells pulsed with whole tumor lysates mediates potent antitumor immune responses in vitro and in vivo[J].Proc Natl Acad Sci USA,1998;95:9482-9487.
6 Raje N,Hideshima T,Davies F E et al.Tumour cell/dendritic cell fusions as a vaccination strategy for multiple myeloma[J].Br J Haemat,2004;125:343-352.

