纤维环切开法建立猪腰椎间盘退变动物模型
康然 黄桂成 李海声 李青 胡春萍 刘彬彬 戚晴雪 谢林
椎间盘退变随着年龄的增加而加重,其发生发展的病理生理学机制复杂,治疗棘手[1]。随着分子生物学及组织工程技术的发展,椎间盘内注射生长因子、干细胞及细胞支架移植促进髓核及纤维环的再生为椎间盘退变的治疗提供了新的途径[2-3]。制备一种与人类椎间盘结构、大小相似,便于操作,可靠的动物模型作为载体是研究的前提。本研究采用刀刺损伤纤维环建立了猪腰椎间盘退变模型,同时观察穿刺针穿刺纤维环对椎间盘退变的影响。
1 材料和方法
1.1 实验动物 健康雌性家猪6头(由江苏省中西医结合医院动物实验中心提供),3月龄,平均体质量(24.00 ±3.54)kg。
1.2 实验步骤
1.2.1 术前准备:术前禁食24 h,腹腔注射3%戊巴比妥1 ml/kg,臀部肌肉注射阿托品0.05mg/kg,动物进入较好的麻醉状态,行MRI检查。耳缘静脉穿刺,建立静脉输液通道,血氧监护,推注丙泊酚3mg/kg,气管插管,丙泊酚20 ml/h、瑞芬太尼15 ml/h静脉泵入。
1.2.2 手术方法:实验猪右侧卧位于透X线手术台上,左侧腰腹部常规备皮、消毒、铺无菌手术单。切口以末节肋骨与脊柱交点前下方2 cm处开始,沿着腰椎横突的前方3 cm向下,共15 cm。分离腹外斜肌、腹内斜肌、腹横肌至腹膜,沿腹膜后间隙至椎体侧前方,保护腹膜、肾脏、输尿管、腹主动脉。“C”臂X线机透视定位,23号刀片于纤维环的左前外侧平行于椎间隙刺入至刀柄处,长度为17 mm(术前椎间盘MRI横断面测量,此方向椎间盘直径35 mm,纤维环宽6 mm),停留5 min。或用18号穿刺针沿同样方向穿刺,深度17 mm,停留5 s。对照组椎间盘只暴露不进行穿刺。止血,逐层缝合,包扎伤口,臀部肌肉注射青霉素320万U。动物清醒后拔管。手术后2周6只实验猪再次腹腔注射3%的戊巴比妥,麻醉下行MRI检查。手术后4、6周,对其中空白1只进行MRI检查,6周时静脉内注射过量苯巴比妥钠处死该头实验猪,取椎间盘行病理切片检查。
1.3 指标检测
1.3.1 MRI检查:应用美国GE公司1.5T MRI设备检查。参数 O-Sag T2 frFSE:TR=2800,TE=102,ETL=21,Bandwidth=41.67,Mtrix=256 ×480,Nex=2,FOV=32,thickness=3 mm,spacing=0。于正中矢状位,选择髓核高信号区域,测量信号值,即MEANS值。并以同一次检查的T13~T14椎间盘信号值为基准,计算各椎间盘的相对信号强度,以消除干扰。相对信号强度=所测椎间盘信号值/T13~T14椎间盘信号值。椎间盘高度以正中矢状位椎间隙中心为测量点,应用Centricity DICOM Viewer中Distance软件测量。
1.3.2 病理组织学检测:实验动物处死后,取出整段腰椎,沿各椎体中央水平锯开,然后纵向锯开,保留完整椎间盘,进行大体形态观察。甲醛液固定,硝酸脱钙,石蜡包埋,切成6μm厚的切片。HE染色后光学显微镜下观察。
1.3.3 统计学分析:所有数值采用SPSS软件统计,椎间盘MRI相对信号强度及椎间盘高度数据以均数±标准差(珋)表示,同组前后对照采用配对t检验,组间比较采用方差分析,LSD及SNK分析。等级资料采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
6头实验猪,末节胸椎T14至首节骶椎S1共42个椎间盘,其中对照组9个,针刺模型组8个,刀刺模型组25个。手术后4周、6周,仅1头实验猪的7个椎间盘列入观察,其中对照组2个,针刺模型组2个,刀刺模型组3个。
2.1 MRI影像变化特征 造模手术后2周,刀刺模型组椎间盘MRIT2加权像信号降低、颜色灰暗,髓核缩小,纤维环面积增大,椎间盘高度降低,其余2组无明显变化。术后4周、6周,刀刺模型组椎间盘信号进一步降低,颜色变暗变黑,髓核逐渐消失;而另外2组无明显变化。虽然模型数量少,但仍可以看出趋势,见图1。

图1 同一头实验猪术前、术后2周、术后4周、术后6周MRIT2加权像
2.2 椎间盘MRI信号强度及椎间隙高度变化 各组椎间盘MRI信号强度及椎间隙高度数据见表1。造模前,各组数据无显著差异。造模手术后2周刀刺模型组椎间盘相对信号强度与其术前比较显著降低(P<0.01),与手术后2周其余2组比较差异亦显著(P<0.01)。造模手术后2周刀刺模型组椎间盘高度与其术前比较显著降低(P<0.01),与手术后2周其余2组比较差异亦显著(P<0.05)。针刺模型组术后2周,椎间盘高度稍有降低,但与手术前比较无差异。
表1 椎间盘MRI信号强度及椎间隙高度变化

表1 椎间盘MRI信号强度及椎间隙高度变化
注:与术前比较,**P<0.01;与其他2组比较,△P<0.05,△△P<0.01
组别MRI 相对信号强度 椎间盘高度(mm)术前 术后2周 术前 术后2周对照组(n=9)1.00±0.08 0.98±0.14 2.82±0.60 2.96±0.77针刺模型组(n=8) 0.99±0.14 0.92±0.12 2.81±0.56 2.44±0.37刀刺模型组(n=25) 0.98±0.13 0.77±0.17**△△ 2.64±0.41 1.98±0.32**△
2.3 椎间盘退变MRI评分 参照Pfirrmann分级系统分级比较[4]。各组椎间盘手术前均为Ⅰ级,手术后2周Pfirrmann分级情况,见表2。造模手术后2周,刀刺模型组相比其他2组退变迅速,差异显著(P<0.01)。对照组和针刺模型组之间无明显差异。
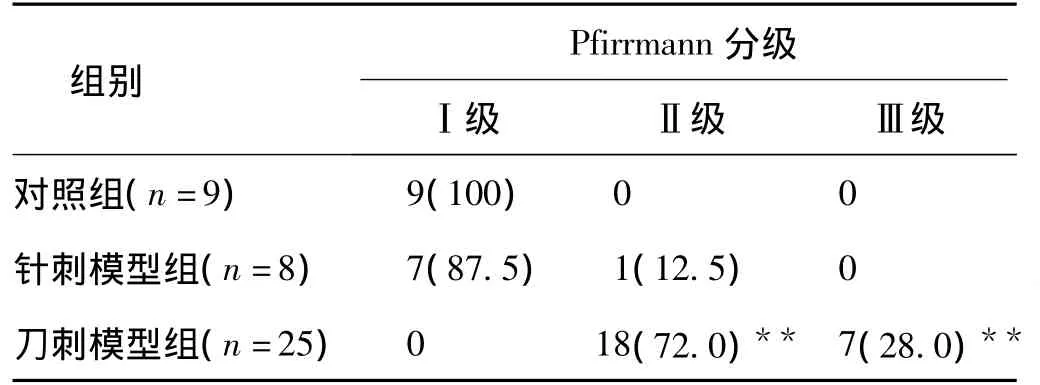
表2 手术后2周Pfirrmann分级(n,%)
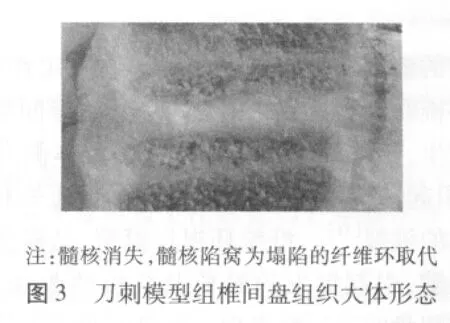
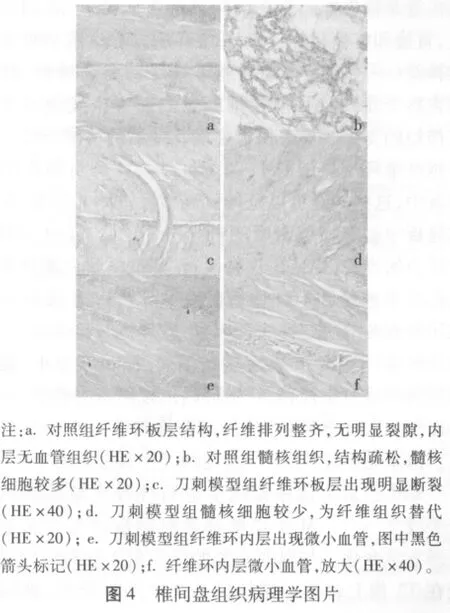
2.4 组织病理学表现 大体观察可见对照组及针刺模型组椎间盘髓核组织为透明胶冻状,椎间隙清晰,纤维环及髓核的界限清楚(图2)。刀刺模型组不能分辨髓核组织,纤维环及髓核无明显界限(图3)。镜下见,对照组及针刺模型组髓核细胞均匀分布,形态正常,纤维环呈板层结构;刀刺模型组髓核组织缩小,细胞密度小,纤维向内塌陷,纤维环板层出现明显断裂,并可见纤维环内层有少量毛细血管生长(图4)。

图2 对照组椎间盘组织大体形态
3 讨论
椎间盘退变是临床常见腰腿痛疾患的主要病因,其机制复杂,治疗棘手,为脊柱相关疾病研究的热点。椎间盘的退变应该区别于椎间盘的生长、老化以及生理适应性改造,它应该与临床上的功能障碍和疼痛相关[5]。年龄增加引起的改变,如细胞基质组成改变,从出生就开始出现[6],并不和疼痛相关[7];年龄增加,椎间盘终板血管减少和椎间盘内细胞密度下降,只是反应了椎间盘对增加的机械负荷和较低代谢转运的必要适应;年龄增加,椎间盘内微小裂隙的逐渐增多,这种裂隙在所有的椎间隙水平均存在,并可能在以后的时间里变成更大的裂隙,但只要这种裂隙保持不发展扩大,它对椎间盘的功能就不会有影响[8]。细胞代谢的指标,如细胞因子、基质金属蛋白酶活性的变化[9],它们与椎间盘结构的损坏相关[10],如果我们把椎间盘的退变归咎于这些指标,那么就像把战争归咎于士兵一样。模仿关键病理因素是本研究制备动物模型的思路。
结构的破坏在椎间盘退变中起着决定性的作用,手术破环椎间盘终板或纤维环可以导致椎间盘退行性改变的发生。终板损伤模型,通过在椎体侧方途径穿刺终板,引起髓核的压力降低,蛋白多糖流失和纤维环内层结构的破裂[11]。纤维环损伤模型,是模仿纤维环周围的裂隙,引起继发的髓核及终板的改变[12-13],导致出现椎间盘的退行性表现。向椎间盘内生长的神经及血管是损伤椎间盘在结构上的重要特点,不同程度上,直接和疼痛相关[14]。纤维环后方和后纵韧带受窦椎神经(一种自主神经和躯体神经的混合神经,具有伤害感受器)支配,但在椎间盘的前方以及侧方受自主神经的支配。具有伤害疼痛感受器的神经纤维仅仅穿越纤维环最外层的1~3 mm[15],在严重损伤的椎间盘中,这些神经可以延伸到髓核和椎体的前方,在椎体终板中也有相似密度的神经分布[16]。椎间盘内正常压力的丧失,促使了这种生长,降低的蛋白聚糖含量也有助于神经和毛细血管的长入[17-19]。本研究针对椎间盘退变的决定性病理因素,破坏椎间盘结构,刀片切开纤维环造模,6周后髓核消失,椎间隙变小,髓核陷窝为纤维组织代替,纤维环内出现明显的裂隙,并有小血管长入纤维环的内层,符合椎间盘退变的病理特征。但未见神经长入,可能与神经生长缓慢有关。
MRI已成为诊断椎间盘退行性改变最精确的检查手段之一[4]。MRI能够描述椎间盘的水分含量以及形态学变化。与退变有关的椎间盘生化和结构的改变在T2像上表现为髓核信号强度明显降低,椎间高度下降。由于各节段椎间盘在磁场中所处的位置存在一定差异和仪器本身存在的不稳定因素,参考文献方法[18],本研究以正中矢状位T13~T14正常椎间盘髓核信号作为对照标准,所得相对信号强度值,更加准确、客观。本研究中采用23号手术刀片全程穿刺纤维环,2周时MRI即可检测到椎间盘的退行性改变,髓核信号降低,椎间隙高度下降,纤维环向外、向内扩展。Pfirrmann分级,刀刺模型组椎间盘出现明显的退变。采用18号针穿刺纤维环组没有上述病理及MRI检测的明显变化,可能与猪的椎间盘较大,刺针的直径未达到椎间盘高度的40%有关[19],同时也说明适当大小的穿刺针,可以进行椎间盘的穿刺注射治疗,对椎间盘无损伤。
椎间盘退变是一个缓慢的过程,在年轻人中,终板损伤需要几年的时间才能表现出椎间盘退变的现象[20]。动物实验通过人为的损伤干预,加快退变过程,可以检测到椎间盘退变的时间跨度从1周到几个月[12-14]。本实验中刀片直接刺穿纤维环,2周即可从MRI上检测到退变现象,退变程度集中在PfirrmannⅡ、Ⅲ级,随着时间的推移逐渐加重。本模型造模周期短,干扰因素少,退变程度较一致,便于进行治疗干预疗效的比较。
鼠、兔、猪、羊等多种动物被用来进行椎间盘退变模型的制备[21-22]。小动物椎间盘退变模型的缺陷是椎间盘具有较高的细胞密度,较好的代谢转运途径,成年椎间盘中脊索细胞的存在[23],这些差别,使得它们具有较好的椎间盘修复能力,与人类差别较大。猪为大型哺乳动物,其脊柱的形态及大小与人类相似,是理想的模型来源。猪的椎间盘较大,便于操作,适合进行椎体融合,椎间盘的穿刺、注射,纤维环修复等研究。此类实验常为腰椎腹膜后入路,切口较长,大多选择母猪,因为母猪的输尿管相比公猪在手术中更不容易被损伤[24-25]。本实验中无1例出现输尿管损伤。
猪的解剖跟人很接近,腹膜后入路暴露椎间盘,临床脊柱外科医师一般很容易操作。造模手术中动物的麻醉及监护需要充分准备,由于是大型动物实验,代价较高,单纯使用戊巴比妥腹腔或静脉注射,麻醉深度较难控制,效果不佳,比较危险,本研究预实验中2头实验猪因麻醉意外死亡。而全麻下动物麻醉状态良好,相对安全。猪为杂食性动物,胃肠内可能残留影响MRI检测的杂物,实验之前必须禁食较长时间,以免影响检查,同时手术中予以足够的静脉补液。确保动物的安全,是造模成功的前提。
刀刺损伤猪椎间盘纤维环可以在较短的时间内成功建立椎间盘退变模型。MRI及病理表现与人类的椎间盘退变相似。手术操作相对简单,易于复制,模型个体间差异小,造模成功率高。与人类相仿的椎间盘形态及大小,为进行椎间盘退变的穿刺注射治疗,髓核、纤维环及终板的再生研究提供了合适的实验载体。
[1]马荣连,金宏柱.综合治疗老年腰椎间盘突出症的回顾及分析[J].实用老年医学,2007,21(4):273-274.
[2]Yoshikawa T,Ueda Y,Miyazaki K,etal.Disc regeneration therapy using marrow mesenchymal cell transplantation:a report of two case studies[J].Spine,2010,35(11):475-480.
[3]Freimark D,Czermak P.Cell-based regeneration of intervertebral disc defects:Review and concepts[J].Int JArtif Organs,2009,32(4):197-203.
[4]吴剑宏,阮狄克.腰椎间盘退变的MRI诊断分级及其临床应用进展[J].中国脊柱脊髓杂志,2010,20(6):511-515.
[5]AdamsMA,Roughley PJ.What is intervertebral disc degeneration,and what causes it[J].Spine,2006,31(18):2151-2161.
[6]Boos N,Weissbach S,Rohrbach H,etal.Classification of age-related changes in lumbar intervertebral discs:2002 Volvo Award in basic science[J].Spine,2002,27(23):2631-2644.
[7]Battie MC,Videman T,Parent E.Lumbar disc degeneration:Epidemiology and genetic influences[J]. Spine,2004,29(23):2679-2690.
[8]Adams MA,McNally DS,Dolan P.‘Stress’distributions inside intervertebral discs,the effects of age and degeneration[J].JBone Joint Surg,1996,78(6):965-972.
[9]Le Maitre CL,Freemont AJ,Hoyland JA.Localization of degradative enzymes and their inhibitors in the degenerate human intervertebral disc[J].J Pathol,2004,204(1):47-54.
[10]Weiler C,Nerlich AG,Zipperer J,etal.2002 SSE Award Competition in Basic Science:Expression of major matrix metalloproteinases is associated with intervertebral disc degradation and resorption[J].Eur Spine,2002,11(4):308-320.
[11]Holm S,Holm AK,Ekstrom L,etal.Experimental disc degeneration due to endplate injury[J].Spinal Disord Tech,2004,17(1):64-71.
[12]胡鹏,刘勇,胡有谷,等.一种羊腰椎间盘退变模型的建立[J].青岛大学医学院学报,2007,43(2):167-168.
[13]罗平,刘玉林,陈仲.纤维环穿刺法与纤维环切开法建立兔椎间盘退变模型[J].中国组织工程研究与临床康复,2010,14(11):1955-1958.
[14]Freemont AJ,Peacock TE,Goupille P,etal.Nerve ingrowth into diseased intervertebral disc in chronic back pain[J].Lancet,1997,350(9072):178-781.
[15]Palmgren T,Gronblad M,Virri J,etal.An immunohistochemical study of nerve structures in the anulus fibrosus of human normal lumbar interver-tebral discs[J].Spine,1999,24(20):2075-2079.
[16]Fagan A,Moore R,Vernon Roberts B,etal.ISSLS Prize Winner:The innervation of the intervertebral disc:A quantitative analysis[J].Spine,2003,28(23):2570-2576.
[17]Melrose J,Roberts S,Smith S,etal.Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine anular lesionmodelof experimental disc degeneration[J].Spine,2002,27(12):1278-1285.
[18]丛琳,屠冠军.退行性变腰椎间盘 MRI信号强度与aggrecan含量的相关性研究[J].中国医科大学学报,2009,38(9):687-689.
[19]Elliott DM,Yerramalli CS,Beckstein JC,etal.The effect of relative needle diameter in puncture and sham injection animalmodels of degeneration[J].Spine,2008,33(6):588-596.
[20]Kerttula LI,Serlo WS,Tervonen OA,etal.Post-traumatic findings of the spine after earlier vertebral fracture in young patients:Clinical and MRIstudy[J].Spine,2000,25(9):1104-1108.
[21]Lotz JC,Colliou OK,Chin JR,etal.Compression-induced degeneration of the intervertebral disc:An in vivo mouse model and finite-element study[J].Spine,1998,23(23):2493-506.
[22]戚晴雪,康然,谢林.腰椎间盘退变动物模型建立的国内外研究进展[J].辽宁中医药大学学报,2011,13(2):79-81.
[23]Lotz JC.Animalmodels of intervertebral disc degeneration:Lessons learned[J].Spine,2004,29(23):2742-2750.
[24]Li H,Zou X,Springer M,etal.Instrumented anterior lumbar interbody fusion with equine bone protein extract[J].Spine,2007,32(4):E126-E129.
[25]Xue Q,LiH,Zou X,etal.Alendronate treatment improves bone—pedicle screw interface fixation in posterior lateral spine fusion:An experimental study in a porcinemodel[J].Int Orthop,2010,34(3):447-451.

