铜绿假单胞菌整合子Ⅰ和ISCR1分布及ERIC-PCR分型
孙静静,吴奎海,芮勇宇
(南方医科大学南方医院 检验科,广东 广州510515)
铜绿假单胞菌(PAE)广泛分布于自然界及健康人的皮肤、肠道和呼吸道中,具有极强的环境适应能力,是临床常见的条件致病菌,当机体免疫力低下时可引起人体局部化脓性炎症和全身性感染,常危及生命。近年来其高分离率、高耐药性、高病死率对临床感染控制构成严重威胁。整合子[1]和插入序列共同区[2](Insertion sequences common regions,ISCR/orf513)作为可移动耐药元件,在介导多重耐药方面具有重要意义。整合子携带位点特异性重组系统组分,可将许多耐药基因盒整合在一起。细菌通过整合子系统,在整合酶的作用下,可以捕获外来的耐药基因,并在位于整合子上游的启动子的作用下得到表达,从而具有耐药及多重耐药性。插入序列共同区ISCR可通过滚环复制转座邻近的耐药基因,并为其提供启动子。本实验主要对临床上分离的铜绿假单胞菌整合子Ⅰ和ISCR1分布研究,同时用肠杆菌科间的重复序列(Entrobacter repetive intergenic consensus,ERIC)-PCR[3]方法进行分子流行病学研究。
1 材料与方法
1.1 菌株来源 本实验所用菌株分离自2010年5月至2010年9月南方医院患者的痰液、尿液、分泌物、血液等各类标本,共234株,均为初次分离株,且已剔除重复标本。科室分布以重症监护室(ICU)、呼吸内科、神经外科、烧伤科为主,总共171株(73.1%)。利用BD Phoenix100全自动微生物分析仪析系统及其配套细菌鉴定卡进行菌种鉴定和药敏试验,头孢哌酮/舒巴坦和米诺环素药敏试验采用K-B法,药敏纸片购自英国OXOID公司,用 WHONET5.4分析菌株药敏情况。质控菌株为大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853。
1.2 主要试剂和仪器 dNTPs、TaqDNA聚合酶、蛋白酶K和DNA Marker由大连瑞真生物技术有限公司提供。引物由上海英潍捷基贸易有限公司提供。Tris饱和酚、氯仿、异戊醇、10%十二烷基磺酸钠(SDS)为北京鼎国生物技术有限公司产品。德国Eppendorf公司的PCR扩增仪器,Bio-Rad公司的凝胶成像仪。
1.3 方法
1.3.1 菌株基因组 DNA的抽提SDS-蛋白酶K-酚-氯仿方法进行提取细菌DNA并用TE液溶解,于-20℃保存。
1.3.2 整合酶Ⅰ检测引物序列int1-F:5’-GCATCCTCGGTTTTCTGG-3’,int1-R:5’-GGTGTGGCGGGCTTCGTG-3’,目的片段457bp。反应总体积为20μl,含 Mg2+的10×buffer 2μl,dNTP终浓度为200μmol/L,上下游引物终浓度分别为0.2μmol/L,DNA模板1μl,TaqDNA聚合酶1U,加入灭菌去离子水至20μl。反应条件为95℃预变性5min;94℃变性30s,55℃退火40s,72℃延伸40s,30个循环;72℃延伸5min。PCR产物在1.5%的琼脂糖凝胶中(含0.5g/ml溴化乙锭),电压5V/cm,电泳20min,用凝胶成像仪观察结果。阳性对照菌株为NF813152,由本实验室PCR检测阳性且经测序验证。
1.3.3 整合子Ⅰ检测引物序列5’-CS:5’-GGCATCCAAGCAGCAAG-3’,5’-CS: AAGCAGACTTGACCTGA-3’,目的片段可变。反应体系及退火温度同整合酶Ⅰ。
1.3.4 ISCR1基因以及ISCR1携带耐药基因的检测:ISCR1 基因的引 物 序 列ISCR1-F:5’-ATGGTTTCATGCGGGTT-3’, ISCR1-R: 5 ’-CTGAGGGTGTGAGCGAG-3’,目的片段475bp。反应体系同整合酶Ⅰ,退火温度为55℃。阳性对照菌株分别为NF511434,由本实验室PCR检测阳性且经测序验证。ISCR1携带耐药基因的引物序列ISCR1-F: 5 ’-ATGGTTTCATGCGGGTT-3 ’,SUL1-R:5’-TTTGAAGGTTCGACAGC-3’,退 火温度60℃,片段大小为可变。
1.3.5 同源性分析 用ERIC-PCR对118株整合酶Ⅰ阳性的铜绿假单胞菌基因进行扩增并进行同源性 分 析。 引 物 序 列 ERIC-2:5’-AAGTAAGTGACTGGGGTGAGCG-3’。反应体系同整合酶,反应条件为95℃预变性5min;94℃变性1min,26℃退火2min,72℃延伸1min,4个循环;94℃变性1 min,40℃退火1min,72℃延伸1min,40个循环;72℃延伸10min。
2 结果
2.1 药敏结果
234株铜绿假单胞菌对常见细菌的总耐药率及整合子与耐药的相关性分析见表1。

表1 铜绿假单胞菌耐药情况
2.2 PCR扩增结果 有118株(50.4%)整合酶Ⅰ阳性,95株(40.6%)整合子Ⅰ可变区阳性;ISCR1基因阳性菌株有28株(11.9%),其中有3株(1.3%)携带耐药基因,同时整合子阳性(图1,2)。118整合酶Ⅰ阳性菌经ERIC-PCR共分为89个基因型,部分电泳图片见图3。其中菌株2、6、11、25、26、29、31、32、34、53、62、64、76、110为同一基因型,其他菌株多为散发。
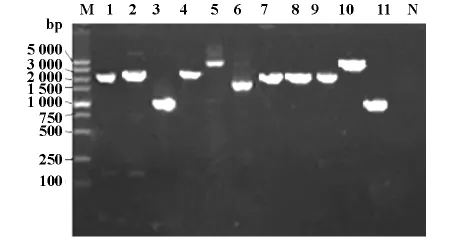
图1 Ⅰ类整合子可变区电泳结果

图2 ISCR1可变区电泳结果

图3 整合酶Ⅰ阳性铜绿假单胞菌的ERIC-PCR结果
3 讨论
铜绿假单胞菌为医院感染的主要病原菌,在我院分离率仅次于大肠埃希氏菌、鲍曼不动杆菌位居第三,主要是痰液,其次是伤口分泌物、血液、中段尿,且具有病区集中趋势,ICU、神经外科、呼吸内科和烧伤科总的检出构成比>70.0%,与患者患基础疾病、抵抗力差有关。
药敏试验结果显示,铜绿假单胞菌耐药现象严重,并且是医院获得性感染重要条件致病菌,应引起临床抗感染治疗的高度重视[4]。在β-内酰胺酶类抗生素中,可以选用碳青霉烯类药物、头孢他啶以及酶抑制剂复合物。在氨基糖苷类抗生素中,阿米卡星的抗菌活性最强。在喹诺酮类抗生素中,环丙沙星的抗菌活性较强。此外,也可以采用以上抗菌药物联合用药治疗铜绿假单胞引起的感染。
铜绿假单胞菌的耐药机制极为复杂[5],包括质粒和转座子的介导、酶的修饰钝化作用、外膜通透性的改变、生物被膜的形成等,近年来整合子介导的耐药越来越被学者们关注[6]。整合子能识别并捕获外来基因盒,通过整合子的位点特异性基因重组机制使细菌耐药基因发生扩散。依据整合酶序列的不同,整合子可分成4种类型,Ⅰ类整合子广泛存在于革兰阴性杆菌中,与细菌的多重耐药密切相关。实验结果显示,我院分离出的铜绿假单胞菌中整合酶Ⅰ、整合子Ⅰ检出率分别为50.4%、40.6%,说明Ⅰ类整合子在临床铜绿假单胞菌分离株中广泛存在,整合子检出率和南京地区[7](40.8%)一致。有23株整合酶Ⅰ阳性菌而整合子Ⅰ扩增却是阴性,可能是缺少典型的3’末端结构[8]。ISCR1常连同多种耐药基因插入到普通Ⅰ类整合子的3’保守末端[9],比如A、C类β-内酰胺酶、甲氧苄啶、氨基糖苷类耐药基因,可介导形成复杂Ⅰ类整合子。本研究ISCR1的检出率仅为11.9%,有3株菌ISCR1可变区扩增阳性,在加上整合子Ⅰ同时阳性,这会使该类菌的耐药播散性更强。
多重耐药铜绿假单胞菌可以在特定的病房引起大规模的暴发流行[10],给患者生命、经济带来很大损失。临床分离菌株的基因同源性分析对于流行病学调查,特别是传染源和传播途径的追踪具有重要意。对流行病学调查具有重要意义。肠杆菌科基因间重复序列(ERIC),其核酸为126bp,其中包含了一个高度保守的中央倒置重复序列并位于细菌染色体中的基因外区域,现已证实在大肠埃希菌和沙门菌属的序列资料中是极其重要的。118株整合酶Ⅰ阳性铜绿假单胞菌分为89个基因型,说明铜绿假单胞菌呈散发存在,ERIC-PCR可把118株菌全部分型,扩增出多态性的DNA图谱,而且条带清晰,其可重复性、稳定性高。ERIC-PCR易在临床微生物实验室建立,是铜绿假单胞菌医院感染流行病学研究的较理想方法。
[1]郭 宇,张 正.整合子基因盒系统与铜绿假单胞菌多重耐药的研究进展[J].中国实验诊断学,2008,12(8):4.
[2]Toleman M A,Bennett P M,Walsh T R.ISCR elements:novel gene-capturing systems of the 21st century?[J].Microbiol Mol Biol Rev,2006,70(2):296.
[3]Wolska K,Szweda P.A comparative evaluation of PCR ribotyping and ERIC PCR for determining the diversity of clinical Pseudomonas aeruginosa isolates[J].Pol J Microbiol,2008,57(2):157.
[4]李 秀,吴敏飞,徐雪松.亚胺培南耐药铜绿假单胞菌的耐药性分析[J].中国实验诊断学,2008,(11).
[5]Alexandre P Zavascki C G C R.Multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii:resistance mechanisms and implications for therapy[Z].2010.
[6]Labbate M,Case R J,Stokes H W.The integron/gene cassette system:an active player in bacterial adaptation.[J].Methods Mol Biol,2009,532:103.
[7]顾 兵,童明庆,宁明哲,等.南京地区铜绿假单胞菌的整合子流行性调查[J].临床检验杂志,2006,24(2):4.
[8]Lee M F,Peng C F,Hsu H J,et al.Use of inverse PCR for analysis of class 1integrons carrying an unusual 3'conserved segment structure[J].Antimicrob Agents Chemother,2011,55(2):943.
[9]Kim S H,Lee B Y,Lau G W,et al.IscR modulates catalase A(KatA)activity,peroxide resistance and full virulence of Pseudomonas aeruginosa PA14.[J].J Microbiol Biotechnol,2009,19(12):1520.
[10]欧阳金鸣,康 辉,王 倩,等.医院非发酵菌感染及耐药性分析[J].中国实验诊断学,2006,(06).

