骨肽对骨髓间充质干细胞TGF-β1表达的影响
王维刚,王志刚,李大鹏
(吉林医药学院附属465医院,吉林 吉林132013)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种来源于骨髓的具有多向分化潜能的成体干细胞,可在体外培养,具有自我更新能力;在一定的诱导条件下,MSCs具有向成骨细胞、软骨细胞、神经细胞、脂肪细胞等多向分化的能力[1]。同时因其具有取材方便,易于分离培养,体外扩增快,且自体骨髓干细胞移植不易产生免疫排斥等优点而备受重视,成为组织工程、细胞治疗、基因治疗等领域的研究热点。
本实验研究骨肽对体外培养MSCs不同时间点TGF-β1表达的影响,初步探讨骨肽在促进 MSCs成骨分化的作用。
1 材料与方法
1.1 实验动物 SD大鼠购自吉林大学动物实验中心。
1.2 主要试剂 DMEM-L培养基、胎牛血清(美国Gibco公司);Percoll(密度1.073g.mL-1,Pharmacia);骨 肽 (黑 龙 江 江 世 药 业 有 限 公 司)TGF-β1 ELISA试剂盒(厦门慧嘉生物科技有限公司)。
1.3 方法
1.3.1 MSCs培养与鉴定参考已发表的文章[2],将分离获得的第三代MSCs用含10%胎牛血清的DMEM-L,置于培养箱中,37℃,5%CO2,饱和湿度下培养。
1.3.2 骨肽对MSCs表达的影响 待MSCs融合至85%,胰酶消化,计数活细胞以每孔1×106接种于24孔板中,培养24小时后,加入不同浓度的骨肽(0.002mg/ml、0.008mg/ml、0.032mg/ml),对照组加入基础培养基。分别在1d、3d、5d、7d利用ELISA法检测细胞培养液中TGF-β1的含量。
2 结果
与对照组相比,骨肽浓度为0.002mg/ml时,细胞上清中TGF-β1含量有无明显改变。随着骨肽浓度增高,TGF-β1的表达含量有增高的趋势,0.008mg/ml组与对照组有统计学差异P<0.05;0.032mg/ml剂量组与对照组相比时 TGF-β1增高更加明显,统计学有显著性差异(P<0.01)。0.008 mg/ml和0.032mg/ml剂量组培养5d、7dTGF-β1含量与1d、3d相比有下降趋势。
表1 不同剂量、不同时间骨肽对MSCs TGF-β1含量的影响(±s)
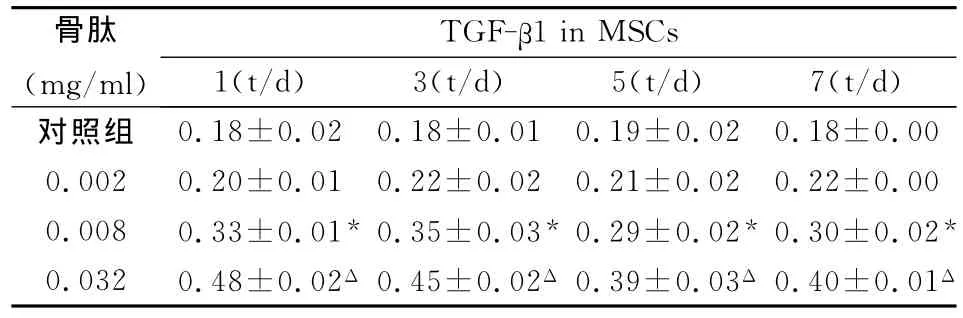
表1 不同剂量、不同时间骨肽对MSCs TGF-β1含量的影响(±s)
与对照组相比*P<0.05,ΔP<0.01;
骨肽(mg/ml)1in MSCs 1(t/d) 3(t/d) 5(t/d) 7(t/d)TGF-β对照组0.18±0.02 0.18±0.01 0.19±0.02 0.18±0.00 0.002 0.20±0.01 0.22±0.02 0.21±0.02 0.22±0.00 0.008 0.33±0.01*0.35±0.03*0.29±0.02* 0.30±0.02*0.032 0.48±0.02Δ 0.45±0.02Δ 0.39±0.03Δ 0.40±0.01Δ
3 讨论
MSCs的多向分化潜能及其体外增殖力强,大量传代培养后仍具有很强的成骨能力等优点成为骨组织工程的首选种子细胞。以往研究表明,MSCs的定向分化成骨仍是通过外部物质进行诱导,诱导剂使用大多是激素、细胞因子之类[3-5],开发新型安全有效的MSCs成骨分化诱导剂,具有良好的应用价值。
TGF-β可由成骨细胞产生并以自分泌的形式对成骨细胞的复制和基质的合成起双向调节作用,尤其TGF-β1是骨骼中重要的传导物质之一[6]。既往的实验研究表明TGF-β1能促进骨膜间充质细胞增殖和分化,促进骨细胞增殖;且TGF-β1还能增加成骨细胞定向迁移的能力,这在骨再建过程中吸收成骨细胞前祖向激活的骨吸收部位移动,有重要的趋化作用,骨微环境中潜在的TGF-β1激活对于调节控制骨再建过程中有十分重要的作用[7]。
骨肽是从中经高科技生物技术精制提取的一种新型骨病治疗药物,内含有多种与骨代谢有关的生长因子及钙、磷等元素,具有广泛的生物学活性,在体内可参与骨钙的吸收和释放,调节骨代谢的平衡,促进骨痂和新血管的形成,因此在临床上广泛应用于骨折和骨折疏松的治疗。
本实验采用ELISA方法检测骨肽作用后MSCs细胞上清中 TGF-β1蛋白含量变化,发现0.002mg/ml组与对照组相比,各时间段 TGF-β1蛋白无明显改变,而0.008mg/ml和0.032mg/ml两组各时间段表达明显增强,而且0.032mg/ml剂量组TGF-β1表达量与0.008mg/ml相比有增高趋势。此结果显示,在各时间段骨肽对MSCs TGF-β1的表达从无明显作用到刺激增强,提示骨肽影响MSCs TGF-β1的表达具有剂量依赖效应。在本研究中,0.008mg/ml和0.032mg/ml两个剂量组在5d和7d两个时间点TGF-β1表达量与1d和3d比较有下降趋势,考虑与在3d时已经有足够的TGF-β1表达并启动下游信号分子引导 MSCs分化,或者与在此时间MSCs已达到最大增殖并有部分发生凋亡有关,有关这部分机制研究需要进一步探讨。
[1]Premjit Arpommaeklong,Shelley E,Brown,Zhuo Wang,et al.Phenotypic characterization,osteoblastic differentiation and bone regeneration capacity of human embryonic stem cell derived mesenchymal stem cells[J].Stem Cells Dev,2009,18(7):1.
[2]郭新,赵东海,何旭,等.大鼠骨髓间充质干细胞的分离培养[J].吉林大学学报(医学版),2005,31(3),469.
[3]Oreffo RO,Triffitt JT.Future potentials for using osteogenic stem cells and biomaterials in orthopedics[J].Bone,1999:25(2 supply):5.
[4]Maniatopoulos C,Sodek J,Melcher A H,Bone formation in vitro by stromal cells obtained from bone marrow of young adult rats[J].Cell Tissue Res,1988,:254(2):317.
[5]Gronthos S,Zannettino A C,Hay Sjpurified,et al.Molecular and cellular characterization of highly stromal cells derived from human bone marrow[J].J Cell Sci halford K W,2003,116(9):1827.
[6]Choi EM,Suh KS,Kim YS,et al.Soybesb ethanol extract increases the function of osteoblastic MC3T3-E1cell[J].Phyto chemismtry 2001,56(7):733.
[7]Randy N,Rosier M D,Ragis J,et al.The potential role of transforming growth factor bata in fracture healing[J].Clin Orthop & Res,1998,355:294.

