基于常规血液检测的腹部外科危重病评估模型探索
邢 帅,陈剑秋*,张 磊
(1.天津医科大学 第二医院,天津300211;2.天津医科大学,天津300070)
在腹部外科危重病学研究领域,如何早期判断病情变化和评估预后一直是国内外临床医生研究的热点。为了对危重病进行早期干预,降低腹部外科危重病人的死亡率,大量实验室检验项目应用于临床。这些缺乏针对性的检验项目不仅增加了病人的住院费用,也大大浪费医疗资源。本研究搜集了天津医科大学第二医院2005年10月至2010年12月206例入住外科危重病房(SICU)腹外科危重病患者完整的病历资料,结合急性生理学与慢性健康状况评分系统II(APACHEII)进行评分,比较不同评分下的实验室检查指标的差异,并探讨其临床意义。
1 资料与方法
1.1 病例与分组 根据206例患者入住SICU时的APACHEII评分将其分为3组:6~10分的40例为甲组,男23例,女17例;平均年龄为(57.32±8.7)岁。11~16分的72例为乙组,男38例,女34例;平均年龄为(63.74±10.12)岁。16分以上的94例为丙组,男51例,女43例;平均年龄为(68.46±13.23)岁。3组病种及病例数见图1。根据病人住院期间是否死亡分为存活组与死亡组。各组患者性别、年龄、病种之间经过方差齐性检验总体差别无统计学意义(P>0.05),具有可比性,且各组均排除了合并有肝脏慢性疾病,肾脏疾病,高脂血症,糖尿病,血液病,原发性甲亢等的病例。

图1 3组病人病种及病例数比较
1.2 研究方法 以病人入住SICU后24小时内(手术患者在术后24小时内)各项生理参数最差值进行APACHEII评分,同时记录甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、凝血酶原时间(PT)、凝血酶时间(TT)、部分凝血活酶活化时间(APTT)、纤维蛋白原(Fg)、血小板(PLT)、D-二聚体(D-D)、C反应蛋白(CRP)、中性粒百分比(NEU%)、血清钙离子(Ca)、氯离子(Cl)、血乳酸(Lac)、血碳酸氢根离子(HCO3-)、血糖(Glu)、总蛋白(TP)、白蛋白(Alb)、血红蛋白(HGB)等的检测结果。根据上述两种分组方法分别进行统计筛选,有统计学意义的指标采用Logistic多元回归分析建立数学模型。
1.3 统计学处理 应用SPSS 17.0统计分析软件进行分析。定量资料:正态分布资料用均数±标准差(±s)表示,组间比较经方差齐性检验后采用方差分析,提示预后的两组间的比较用配对t检验,计数资料及样本率的比较用χ2检验,偏态分布或方差不齐资料采用Kruskal-Wallis秩和检验,经过组间比较有统计学意义的变量分别予以统计学变量赋值,再纳入多因素Logistic回归分析,P<0.05认为有统计学意义。
2 结果
2.1 血凝和血脂分析 对于凝血指标和血脂指标对病情及预后的评估,样本资料符合正态分布,且各组间方差齐,故采用方差分析进行统计处理。甲乙丙3组随着APACHEII评分的升高,住SICU时间延长,血清 TC、TG、LDL值降低,APTT延长,D-D阳性率增加,PLT计数降低,组间比较有统计学意义(P<0.05),而 HDL、TT、Fg未见显著性差异;死亡组APACHEII评分明显比存活组高,而血清TC、TG、LDL则更低,APTT、TT 延长,D-D 阳性率增加,有统计学意义(P<0.05),而PLT、HDL、TT及Fg却未见显著性差异,见表1。
2.2 血常规、电解质、营养指标及血气分析 由于样本其它血样本指标大多数为偏态分布或方差不齐,故采用Kruskal-Wallis秩和检验来比较不同指标与 APACHEII评分的关系。Lac、CRP、Alb、HCO3-在不同评分组间比较具有显著地统计学差异,由于APACHEII评分标准中包括白细胞(WBC)、pH 值、红细胞压积(HCT)、血清钠(Na)和血清钾(K),故病情组中这五项未作比较;存活组与死亡组相比,Alb、Lac、PH、CRP值有显著性差异,见表2。
2.3 所筛选指标的Logistic回归分析 经过上述统计分析,获得如下结果:TC、TG、LDL、PT、APTT、D-D、PLT、Lac、CRP、Alb、HCO3-和pH 值等12项指标的异常为腹部外科危重病恶化的危险因素。为进一步研究此12项指标是否可独立预测死亡,将其带入Logistic多因素回归模型进行分析。结果显示:TC、PT、D-D、Lac、pH 和 Alb是预测腹部外科危重病人死亡的独立预测因素,其中TC,pH及Alb为保护性因素,而PT、D-D及Lac为死亡的危险因素,见表3。根据公式Y=logit(odds)=b0+得出回归方程:Y=-1.164+1.784PT+1.833D-D-1.439TC-1.773pH+1.957Lac-0.053Alb,此基于血标本检测的数学模型可用于评估腹部外科危重病人的病情及预后。
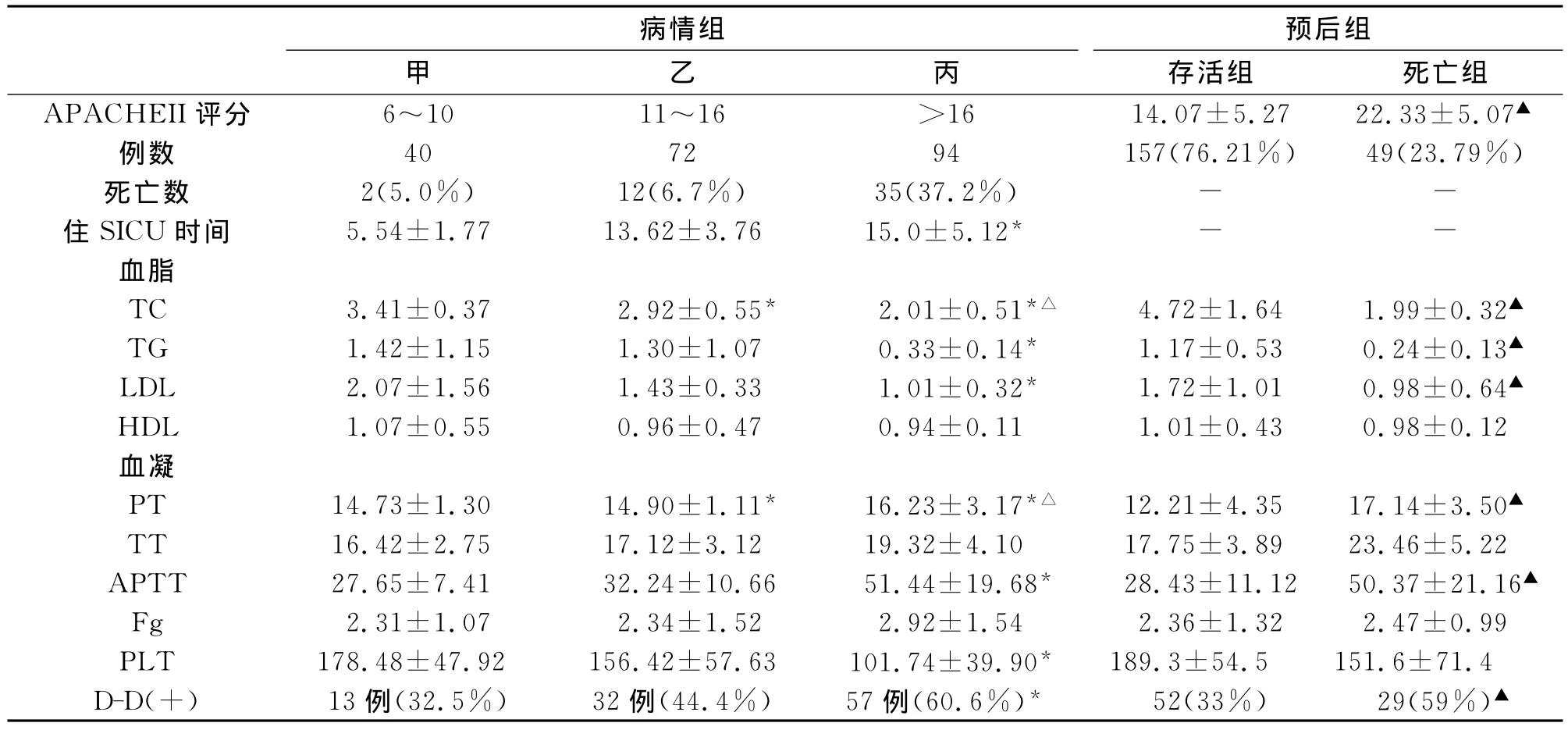
表1 血脂血凝指标与APACHEII评分及预后的关系
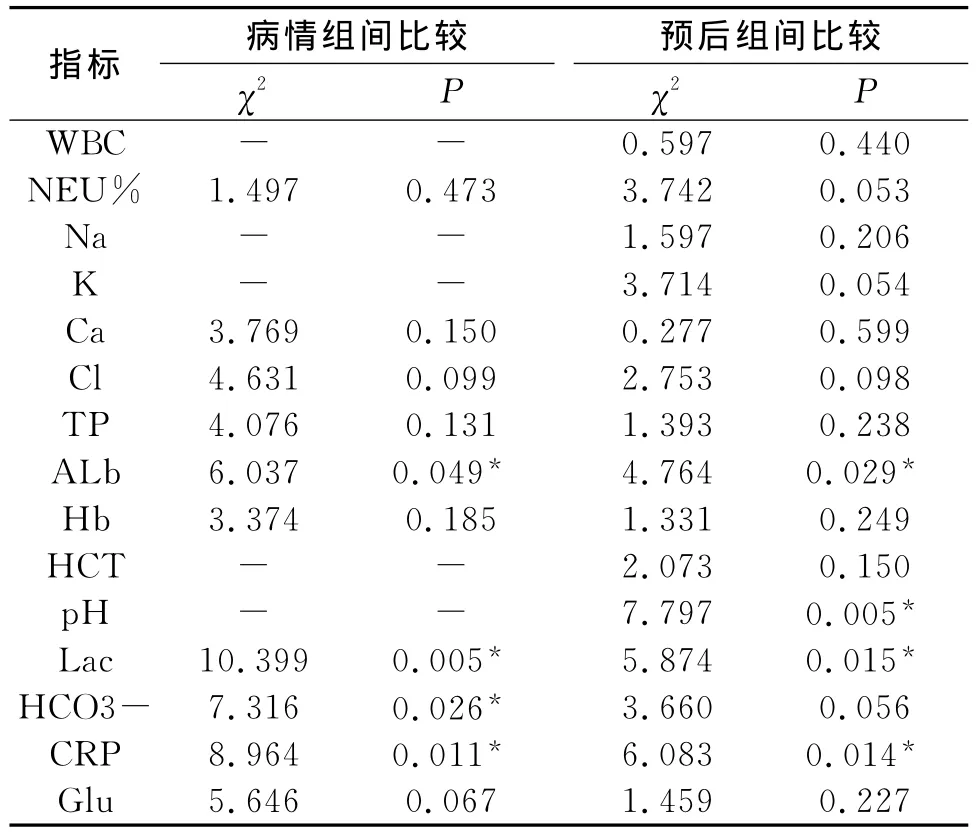
表2 各实验室指标和APACHEII评分及预后的关系
3 讨论
腹部外科危重病人多处于术后、创伤、感染等重度应激反应状态,存在极其复杂的病理生理学改变。机体内环境的急剧改变可导致多脏器功能不全,以致三大营养代谢,凝血系统及血生化和电解质的紊乱。某些实验室指标可很大程度上反映患者的病情,提示疾病的转归。自从Knaus等提出APACHEII评分系统以来[1],凭借其计分容易、可重复操作等优点,越来越受到国内外学者的青睐。但由于腹部外科危重病具有病种多样,起病急骤,病情进展迅速,易于手术干预等特点,其在评估SICU病人病情和预后方面仍缺乏一定的灵敏度和时效性。国内外学者和临床医生已着力研究新的指标以便更全面地评估外科危重病人的病情。本研究探讨出了几种较为灵敏的常用实验室检查指标作为APACHEII评分系统的补充,联合评估SICU病人病情及预后。
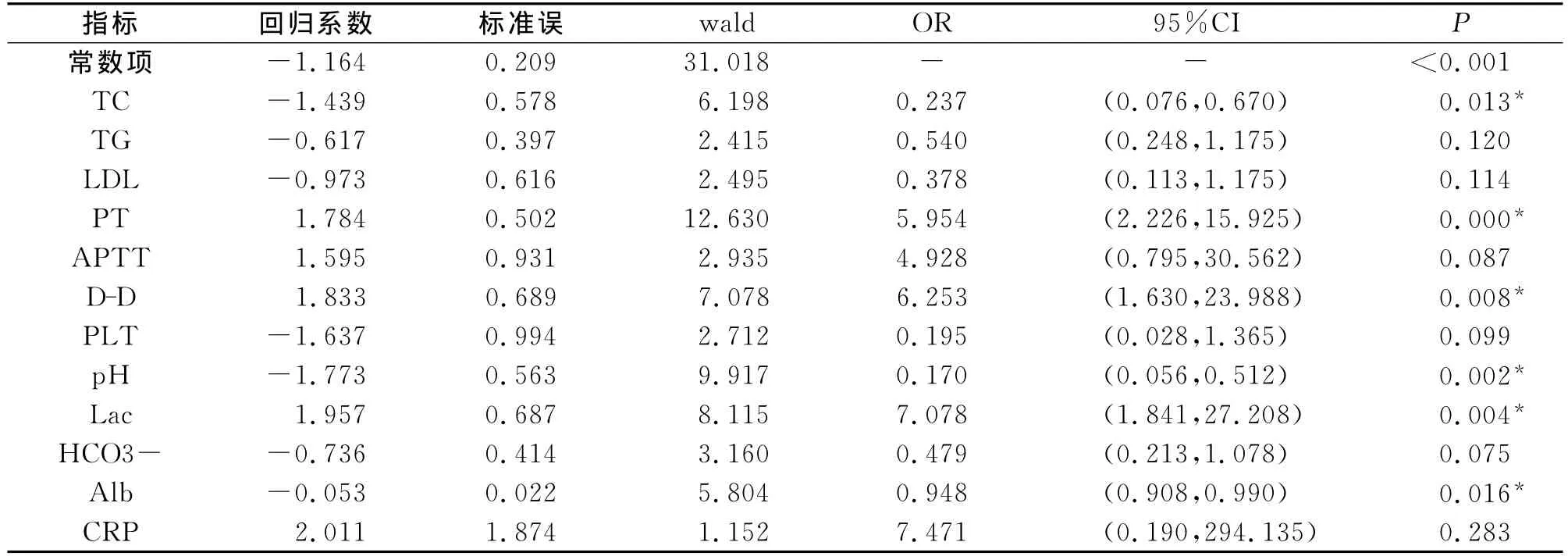
表3 有意义的12个指标逐步Logistic多元回归分析
本研究所选取的危重病例大部分均有不同程度的全身炎症反应综合症(SIRS)表现,SIRS所致的内皮细胞损伤加速了内、外源性凝血系统的激活,诱导纤溶系统的紊乱,进而加速病情进展[2]。本研究结果表明,随着APACHEII评分的升高,PT、TT、APTT、Fg、D-D均升高,PLT计数则逐渐降低,且大部分差异均具有显著性。死亡组与存活组相比,随PLT计数降低病死率增加,但差异无显著性,这可能与治疗的干预作用有关。在研究凝血指标时,我们排除了肿瘤术后组和当时正在使用抗凝药物的25例病人,排除可能的混杂因素的干扰。通过Logistic回归分析,我们得出PT与D-D在反映腹外科危重病凝血功能和纤溶活性方面较为灵敏,Dhainaut等[3]研究也发现PT延长大于2秒及D-D升高大于20%对多脏器功能不全的发生具有预测意义。PLT与Fg在有明显凝血功能障碍的危重病患者中却无显著性变化,这与Levi M等[4]的报道相符。
在蛋白质和糖代谢方面,随着APACHEII评分的升高,CRP和Alb的差异最具有显著性,此两种指标可用于独立预测腹部外科危重病人的死亡,而HGB、TP和GLu的均值虽有所递变,但差异却无显著性。国外最近有文献[5]报道,CRP与危重病人的代谢综合征密切相关,可做为多种疾病临床诊断,治疗和判断预后的良好指标。腹外科病人机体常常处于高分解代谢状态,呈负氮平衡,Alb水平正提示病人高分解的营养代谢状况,此时Alb的变化很灵敏,对疾病的危重判断也很及时。同时,机体糖代谢紊乱也较为显著,高分解的同时出现应激性高血糖,加之外科医师较为重视糖代谢紊乱,适时给予调糖处理,且外科危重病人总处于禁食水的状态,可能均会影响本次研究结果,虽然组间糖代谢未见显著性差异,但我们仍不能忽略外科危重病人糖代谢紊乱的问题,应视情况及时给予干预。
本研究表明,随着APACHEII评分的升高,血脂水平有所降低,除HDL外,余多数均具有统计学意义,这与Fraunberger.P等[6]描述的相同。事实上,在SICU病人中,三大营养代谢均会发生显著性变化,而血脂的变化更与疾病的严重程度和预后密切相关[7]。至于血脂下降的确切机制,目前尚未完全阐明,可能为多因素共同作用的结果,包括应激状况下氧化供能增加,合成减少,肠道吸收减少,激素调节,细胞因子调节[8],血液稀释等。本研究通过多因素Logistic回归发现TC水平对死亡具有独立的预测意义。危重病急性期低水平的TG、LDL提示病情危重。所以我们在关注糖与蛋白质代谢的同时,重视血脂水平的改变,可能会收到更加理想的治疗效果。
本结果显示,SICU病人普遍存在电解质紊乱和酸碱平衡失调,其中以代谢性酸中毒最为常见。HCO3-的显著下降提示病情危重,但却不能作为预测患者死亡的指标。血液PH值的下降和乳酸水平的升高亦可独立预测患者的死亡,与国内外学者研究相报道一致[9,10],这可能与SICU 病人患高儿茶酚胺血症和全身组织低灌注有关。
综上所述,本研究在腹外科危重病人种类繁多的血液学检验项目中分析归纳出六大检验指标,把血凝,血脂,血气及营养状况指标引入了APACHEII评分系统,并建立了病情评估的数学模型,可以更加可靠地评估腹外科病人的病情及预后。当然,可预测腹部外科危重病人预后的血液检测指标还有很多,还包括补体系统,免疫球蛋白系统,肝肾功和酶学系统等尚未纳入本次讨论,有必要进行前瞻性研究,进一步完善评估模型,并验证其诊断价值。由于样本例数较少而疾病种类较多,使本研究缺乏一定的同质性,一些混杂偏倚无法避免,组织多中心,大样本的临床病例分析将是我们后续研究的重点。相信不久的将来,此血液指标评估模型会更加完善。
[1]Knaus WA,Draper EA,Wagner DP,et al.APACHEII:a severity of disease classification system[J].Crit Care Med,1985;13(10):818.
[2]Hukkanen RR,Liggitt HD,Murnane RD,et al.Systemic inflammatory response syndrome in nonhuman primates culminating in multiple organ failure,acute lung injury,and disseminated intravascular coagulation[J].Toxicol Pathology,2009,37(6):799.
[3]Dhainaut JF,Shorr AF,Macias WL,et al.Dynamic evolution of coagulopathy in the first day of severe sepsis:relationship with mortality and organ failure[J].Crit Care Med,2005,33(2):341.
[4]Levi M,Schultz M.Coagulopathy and platelet disorders in critically ill patients[J].Minerva Anestesiologica,2010,76(10):851.
[5]Pravenec M,Kajiya T,Zídek V,et al.Effects of human C-reactive protein on pathogenesis of features of the metabolic syndrome[J].Hypertension,2011,57(4):731.
[6]Fraunberger P,Nagel D,Walli A K,et al.Serum Cholesterol and Mortalit Y in Patient S with Multiple Organ Failure[J].Crit Care Med,2000,28(10):3574.
[7]Pavel Vyroubal,Carlo Chiarla,Ivo Giovannini,et al.Hypocholesterolemia in clinically serious conditions[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008,152(2):181.
[8]BonvilleDA,ParkerTS,Levine DM,et a1.The relationships of hypocholesterolemia to cytokine concentrations and mortality in critically ill patients with systemic inflammatory response syndrome[J].Surg Infect(Larchmt),2004,5(1):39.
[9]陈 涛,梅 红,刘 映,等.危重病患者动脉血乳酸水平与急性生理学及慢性健康状况评分Ⅱ相关性研究[J].中国全科医学,2010,13(30):3419.
[10]Jansen TC,van Bommel J,Bakker J,et al.Blood lactate monitoring in critically ill patients:a systematic health technology assessment[J].Crit Care Med,2009,37(10):2858.

