蜕皮素对大鼠肺血管通透性影响的实验研究
陈 江 池达智 林昭伟 黄东平 南方医科大学珠江医院急诊科(地址102820)
蜕皮甾酮(Ecdysterone,EDS)即β蜕皮激素,是具最强生理活性的蜕皮激素,研究表明EDS能促进创伤愈合、调节免疫3。本实验旨在从肺水肿及肺血管通透性的角度探索EDS是否能减轻肺损伤。
1 材料和方法 1.1 材料和试剂 LPS购自sigma公司,蜕皮甾酮由中国科学院昆明植物研究所提供,其余试剂均为南方医科大学试剂中心提供。
1.2 大鼠急性肺损伤模型及分组 雄性 Wstar大鼠64只,体重200±20g,购自南方医科大学实验动物中心,随机分为正常对照组、损伤组、地塞米松干预组和EDS干预组,每组8只。①正常对照组(N组):大鼠尾静脉注射生理盐水。②损伤组(C组):大鼠尾静脉注射LPS(5mg/kg)。③地塞米松干预组:注射LPS的同时注射地塞米松(5mg/kg)④EDS干预组:注射LPS的同时注射EDS(15mg/kg);另外每组各取8只大鼠于注射LPS(对照组于注射生理盐水)前1min尾静脉注射伊文思蓝50mg/kg。
1.3 肺系数、肺水含量及肺通透指数测定 注射后6h腹主动脉抽动脉血后处死动物,取全肺,计算肺系数(Lungindex)[全肺重(g)/体重(g)]。取左肺上叶测定肺水含量(Lungwater)[肺湿重-肺干重]×100/肺湿重]。取右肺下叶行支气管肺泡灌洗,用Lowry法测定支气管灌洗液(bronchoalveolar,BALF)和血浆的蛋白含量,计算肺通透指数(Lung permeability index,LPI)[BLAF蛋白含量/血浆蛋白含量]。
1.4 肺血管通透性变化 根据Standiford11方法改进,先描绘evans蓝的甲酰胺溶液的标准曲线,各组注射Evans蓝(50mg/kg)动物在注射染料6h后开胸取肺组织300mg,浸泡在4mL甲酰胺分析纯液中,置45~500C温箱中温育72h,待组织中色素与浸泡液中色素达到平衡,取出组织,离心,取上清液,用752型分光光度计λ620nm进行比色,根据标准曲线计算每克肺组织中Evans蓝含量,以反映肺血管通透性变化。
1.5 血气分析 取各组未经伊文思蓝注射的8只大鼠,腹主动脉抽血,所抽动脉血送动脉血气分析。
1.6 病理形态学计分方法[10]将左肺上叶用10%福尔马林固定,常规石腊包埋切片,HE染色,观察肺组织病理改变,并根据肺间质水肿、肺泡水肿、炎细胞浸润、肺泡出血、透明膜形成、肺不张改变,按程度“无、轻、中、重”分别计“0、1、2、3”,累计总分,予统计学处理。
1.7 数据处理 采用方差分析(One-way Anova),比较组间差异。
2 结 果 2.1 肺系数、肺水含量、肺通透指数变化结果表明,地塞米松组的肺系数、肺水含量、肺通透指数均显著低于损伤组,但高于正常组,EDS组的肺系数、肺水含量、肺通透指数与地塞米松组相比无显著性差异。
表1 EDS对大鼠肺水肿参数的影响(n=8,±s)
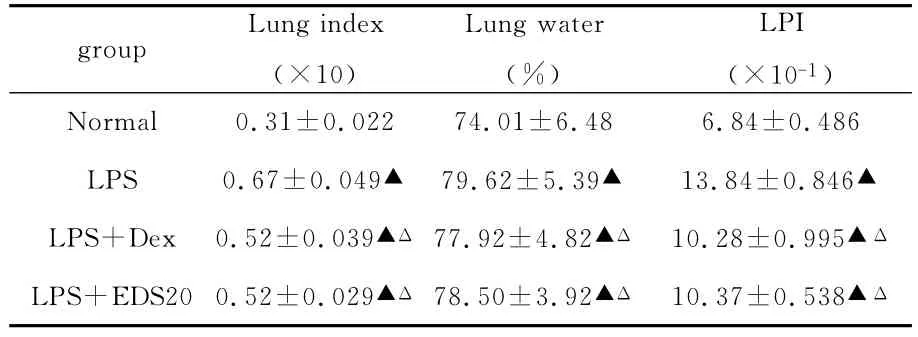
表1 EDS对大鼠肺水肿参数的影响(n=8,±s)
与生理盐水对照组比较,▲P<0.01,与LPS损伤组比较,ΔP<0.01。
group Lung index(×10)Lung water(%)LPI(×10-1)Normal 0.31±0.022 74.01±6.48 6.84±0.486 LPS 0.67±0.049▲ 79.62±5.39▲ 13.84±0.846▲LPS+Dex 0.52±0.039▲Δ 77.92±4.82▲Δ 10.28±0.995▲Δ LPS+EDS20 0.52±0.029▲Δ 78.50±3.92▲Δ 10.37±0.538▲Δ
2.2 肺血管通透性变化 2.2.1evans蓝-吸光度标准曲线:根据evans蓝含量与吸光度,回归方程y=3.2284x-0.0792,(y:evans蓝 mg/100mL,x:吸光度,r2=0.9944,P=0.00)(图1)
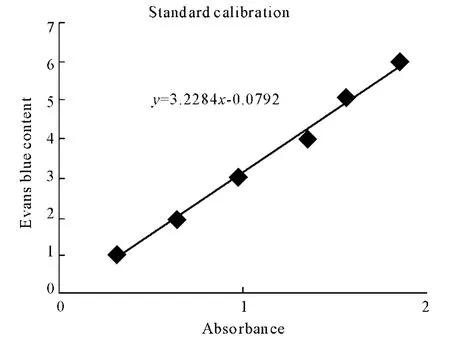
图1 伊文思蓝含量-吸光度标准曲线
2.2.2 各组肺血管通透性比较:根据回归方程,换算出单位组织中evans蓝含量(mg),以表示血管通透性大小。结果如表2所示,在伤后6h,地塞米松组的肺血管通透性显著低于损伤组,但高于正常组,EDS组的肺血管通透性与地塞米松组相比无统计学意义。
2.3 肺组织的病理学变化(见插图)肺大体观察,盐水对照组外观基本无明显异常变化;损伤组肺体积增大,包膜下有点、片状出血;地塞米松干预组较内毒素组明显减轻,EDS干预组则与地塞米松干预组类似。光镜下观察,盐水对照组基本正常;内毒素组肺泡壁破坏严重,肺间质、肺泡水肿,肺泡隔明显增宽,大部分肺泡萎陷,肺泡及肺间质有较多中性粒细胞浸润,部分肺泡可见出血;地塞米松干预组及EDS组肺组织中上述改变明显减轻。病理计分
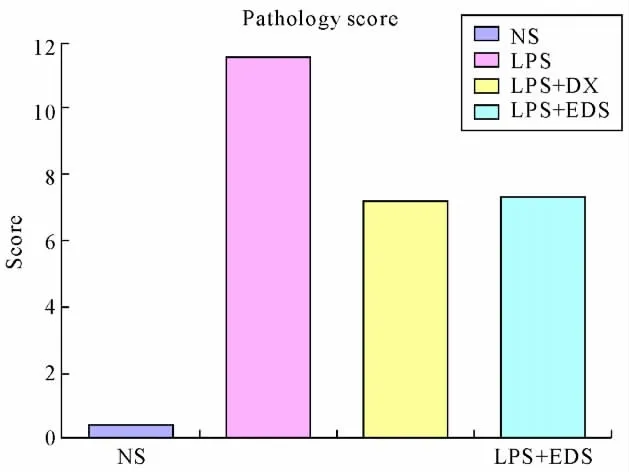
图2 各组病理评分比较
表2 每克肺组织含evans蓝量(n=8,±s)
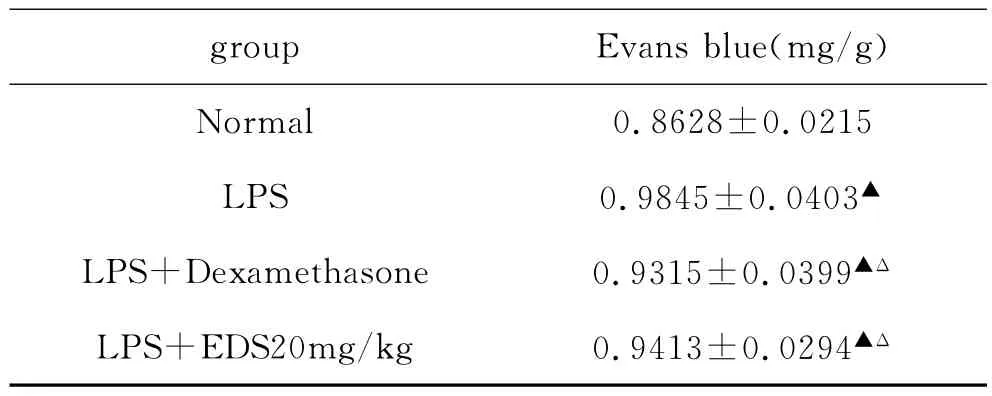
表2 每克肺组织含evans蓝量(n=8,±s)
group Evans blue(mg/g)Normal 0.8628±0.0215 LPS 0.9845±0.0403▲LPS+Dexamethasone 0.9315±0.0399▲Δ LPS+EDS20mg/kg 0.9413±0.0294▲Δ
与生理盐水对照组比较,▲P<0.01,与LPS损伤组比较,ΔP<0.01。
3 血气指标的变化 与 NS组相比,LPS组PaO2、PH值明显下降,PaCO2明显升高。地塞米松和EDS预处理组与LPS组相比PaO2、PH值明显升高,PaCO2明显降低。
表3 大鼠血气指标的变化(n=8,±s)

表3 大鼠血气指标的变化(n=8,±s)
Group PaO2(kPa) PaCO2(kPa) PH NS 14.60 ±0.63 4.03±0.72 7.41±0.04 LPS 9.67±0.77▲ 6.09±0.54▲ 7.29±0.06▲LPS+DX 13.68±0.74▲Δ 5.01±0.54▲Δ 7.35±0.04▲Δ LPS+EDS 13.31±0.68▲Δ 4.95±0.49▲Δ 7.34±0.03▲Δ
与生理盐水对照组比较,▲P<0.01,与LPS损伤组比较,ΔP<0.01。
讨 论 肺部感染可导致急性肺损伤(ALI)或更严重并发症急性呼吸窘迫综合征(ARDS)的发生,是人类的首要死亡原因[1,2]。ALI的主要特征是微血管通透性增高,中性粒细胞聚集和促炎性介质的表达导致的严重肺损伤。革兰氏阴性细菌感染可以使人体对细菌内毒素产生过度反应导致脓毒血症的发生[4,5]。脓毒血症的一个重要临床特征是肺炎导致的急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS),表现为难以控制的肺部对脂多糖的的炎性应答反应[6]。尽管近来在这一领域的研究出现了很多的进展,但统计学表明急性肺损伤所导致的死亡率仍然居高不下,需要寻找新的治疗方法和药物[2]。

图1-1 正常对照组肺组织切片图(HE×100)
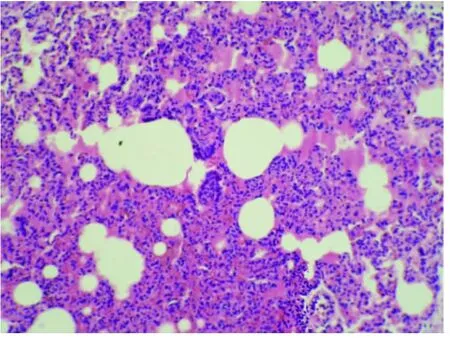
图2-1 LPS损伤组肺组织切片图(HE×100)
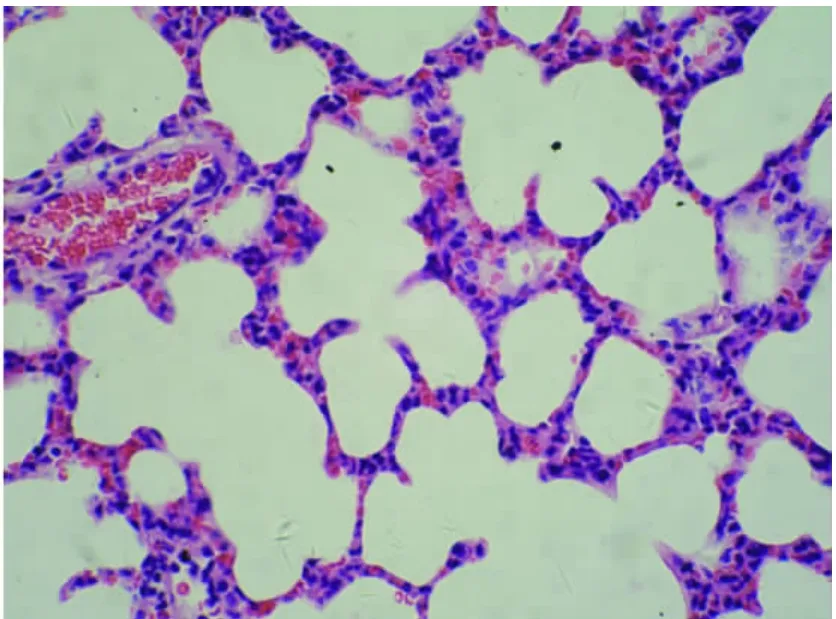
图1-2 正常对照组肺组织切片图(HE×400)
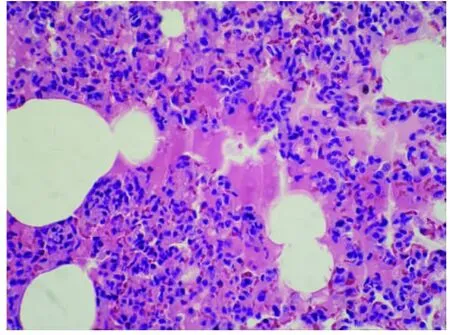
图2-2 LPS损伤组肺组织切片图(HE×400)

图3-1 地塞米松干预组肺组织切片(HE×100)
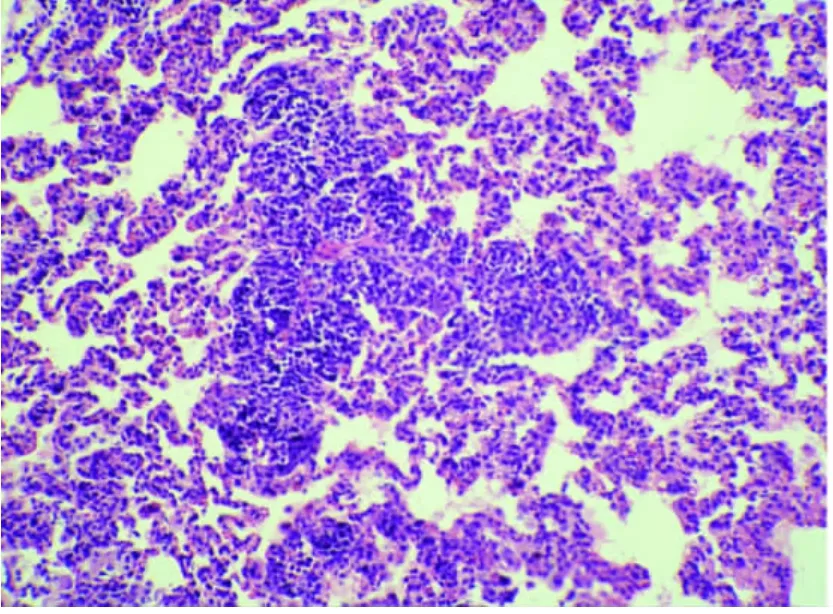
图4-1 蜕皮激素干预组肺组织切片 (HE×100)

图3-2 地塞米松干预组组肺组织切片(HE×400)
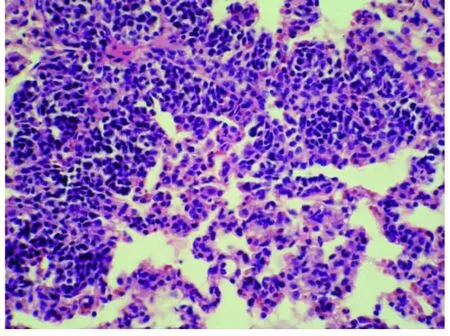
图4-2 蜕皮激素干预组组肺组织切片(HE×400)
地塞米松为肾上腺皮质激素,作用广泛,可作用于ALI的多个发病环节,广泛应用于临床ALI的治疗,但由于地塞米松有增加感染的发生率、延迟伤口愈合、骨质疏松等副作用,所以其应用仍然存在争议[7]。因此寻找一种副作用较小的替代药物是必要的。
EDS属于昆虫生长代谢调节激素,最早为昆虫学家所研究,近年来的研究发现,EDS对于高等动物同样表现出较强的生理活性,其主要作用有:促进核酸和蛋白质合成,调节糖和脂类代谢,免疫调节,减轻肺血管内皮细胞损伤,改善微循环,促进创伤愈合等作用[8,9],可用于肺损伤的治疗。
实验结果表明,EDS能减轻肺水肿,降低肺系数和肺含水量,减轻内皮细胞肿胀,降低肺血管通透性,其具体的作用机制尚不清楚,可能在于EDS具有促进细胞蛋白质合成的特性,以及阻断LPS与其受体的结合。因此,从EDS能够减轻肺血管内皮细胞的损伤以及阻断LPS与其受体结合两方面,可以认为EDS对于脓毒血症所致的ALI有治疗作用,其具体机制还有待进一步研究。
[1]Bernard,G.R.,A.Artigas,K.L.Brigham,J.Carlet,K.Falke,L.Hudson,M.Lamy,J.R.Legall,A.Morris,and R.Spragg.1994.The American-European Consensus Conference on ARDS:definitions,mechanisms,relevant outcomes,and clinical trial coordination.Am.J.Respir.Crit.Care Med,149:818-824.
[2]Piantadosi,C.A.,and D.A.Schwartz.2004.The acute respiratory distress syndrome.Ann.Intern.Med,141:460-470.
[3]AlainM,FredericB,Ecdysteroids containingliposomes for wound healing and skin regeration.Fr Demande FR2,637,182(Cl.A61K9 10),06Apr 1990,Appl.
[4]Karima,R.,S.Matsumoto,H.Higashi,and K.Matsushima.1999.The molecular pathogenesis of endotoxic shock and organ failure.Mol.Med.Today 5:123-132.
[5]Mayeux,P.R.1997.Pathobiology of lipopolysaccharide.J.Toxicol.Environ.Health 51:415-435.
[6]Goodman,R.B.,R.M.Strieter,D.P.Martin,K.P.Steinberg,J.A.Milberg,R.J.Maunder,S.L.Kunkel,A.Walz,L.D.Hudson,and T.R.Martin.1996.Inflammatory cytokines in patients with persistence of the acute respiratory distress syndrome.Am.J.Respir.Crit.Care Med.154:602-611.
[7]Bernard GR,Luce JM,Sprung CL,et al.High dose corticosteroids in patients with the adult respiratorydistress syndrom[J].N Engl J Med,1987,317:1565-1570.
[8]TakeiM,Endo K,Nishimoto N,et al.Ecdysterone on histamine release from rat peritoneal mast cells[J].J Pahm Sci,1991,80(4):309-310.
[9]吴 旭,林水金,杨映波,等.蜕皮甾酮对人脐静脉内皮细胞增殖的影响[J].中国药理学通报,1997,13:176.
[9]Sun D,Zhao M,et al.Protective effect of interleukin-1receptor antagonist on oleic acid-induced lung injury[J].Chin Med J(Engl),1996,109(7):522-526.
[10]Standiford TJ,Kunkel SL,Lukacs NW,et al.Macrophage inflammatory protein-1alpha mediates lung leukocyte recruitment,lung capillary leak,and early mortality in murinendctoxemina[J].J Immunol,1995,155:1515.

