巯甲基二苯甲酮的合成
程传杰, 孙 剑, 刘忠彬, 申 亮, 刘英佳
(江西科技师范大学 化学化工学院,江西 南昌 330013)
硫醇(酚)类化合物是重要的化工原料与农医药中间体,在有机合成、高分子合成、材料制备等方面具有广泛的用途,特别是巯基-烯和巯基-炔的点击反应更是近年来的热点课题[1,2]。与常用的Huisgen环加成反应相比,巯基参与的点击反应具有无需金属催化剂、反应速度快、条件温和、对氧不敏感等优点。一般情况下,巯基-烯或炔的点击反应是在紫外线作用下,加上普通的光引发剂(如二苯甲酮) 进行。硫醇的合成虽然有多种方法,如硫化氢法、硫氢化钠(钾)烃化水解法、硫脲烃化水解法、硫醇酯或黄原酸酯水解法等,但从原料成本及对环境的影响方面考虑,硫脲烃化水解法较理想[3]。
光固化技术具有高效、环保、节能的优点,在光固化涂料、油墨、胶黏剂等领域得到了广泛应用。光固化中一般都要使用光引发剂,而二苯甲酮类光引发剂因价廉易得而被广泛使用[4]。但是,传统的光固化常使用小分子光引发剂,这些小分子光引发剂因挥发性强、易迁移而对聚合产品不利。因而,近年来人们开始研究反应性或大分子光引发剂,以克服小分子光引发剂的不足[5,6]。
本文在文献[7]方法的基础上,以NaI为催化剂,以4-溴甲基二苯甲酮(3)或4,4′-二(溴甲基)二苯甲酮(4)为原料,采用硫脲法合成了4-巯甲基二苯甲酮(1,新化合物,产率75%)或4,4′-二(巯甲基)二苯甲酮(2,产率83%)(Scheme 1),其结构经1H NMR,13C NMR,IR和元素分析表征。并对合成工艺进行了优化,2的产率由66%[7]提高到83%。与文献[7]方法比较,该法条件更温和,产率更高。
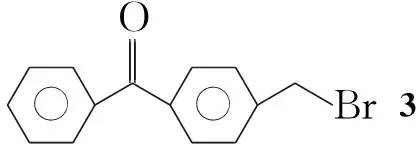

Scheme1
1 实验部分
1.1 仪器与试剂
XT-4型显微熔点仪;Bruker AV 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker V70型傅立叶变换红外光谱仪(KBr压片);FLASH EA 1112型元素分析仪。
3和4按文献[6,8]方法制备;其余所用试剂均为分析纯。
1.2 1和2的合成
在反应瓶中依次加入3550 mg(2 mmol),硫脲170 mg(2.2 mmol),无水乙醇40 mL及NaI1.5 mg(0.01 mmol, 0.5 mol%),搅拌下回流反应30 min[TLC监测,展开剂:V(PE) ∶V(EA)=4 ∶1]。旋蒸脱溶得白色黏稠物,加入15%氢氧化钠40 mL,于90 ℃反应 2 h;冷却至室温,用10%盐酸调至pH 5~6;用乙酸乙酯(2×20 mL)萃取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,旋蒸脱溶得浅黄色液体,经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=15 ∶1]纯化得白色针状晶体10.32 g,收率75%, m.p.53 ℃~55 ℃;1H NMRδ: 7.77~7.73(m, 4H, ArH), 7.57~7.53(m, 1H, ArH), 7.46~7.39(m, 4H, ArH), 3.76(d,J=7.6 Hz, 2H, ArCH2), 1.82(t,J=7.8 Hz, 1H, SH);13C NMRδ: 195.8, 145.7, 137.4, 136.0, 132.2, 130.7(2C), 129.7(2C), 128.3(2C), 128.1(2C), 28.7; IRν: 3 058, 2 929, 2 561, 1 650, 1 600, 1 570, 1 444, 1 410, 1 312, 1 281 cm-1; Anal.calcd for C14H12OS: C 73.65, H 5.30; found C 73.98, H 5.23。
用4替代3,用类似方法(于90 ℃反应 3 h;用乙醚萃取)合成2的粗品,经无水乙醇重结晶得白色针状晶体20.45 g,收率82.5%, m.p.112 ℃~114 ℃(113 ℃~114 ℃[7]);1H NMRδ: 7.76(d,J=7.6 Hz, 4H, ArH), 7.44(d,J=8.0 Hz, 4H, ArH), 3.81(d,J=7.6 Hz, 4H, ArCH2), 1.83(t,J=7.8 Hz, 2H, SH);13C NMRδ: 195.1, 145.3(2C), 135.9(2C), 130.0(4C), 127.5(4C), 28.2(2C); IRν: 3 040, 2 560, 1 641, 1 598, 1 561, 1 406 cm-1; Anal.calcd for C15H14OS2: C 65.66, H 5.14; found C 65.75, H 5.09(表征数据与文献[7]相吻合)。
2 结果与讨论
2.1 表征
1的结构未见文献报道。IR分析表明,3 058 cm-1峰为苯环的CH峰;2 561 cm-1归属SH; 1 650 cm-1为羰基峰;1 600 cm-1~1 444 cm-1为苯环骨架振动峰;1 410 cm-1为苄基的CH弯曲振动峰。1H NMR分析表明,7.77~7.39处三组峰为PhH; 3.75处的二重峰为苄基上的亚甲基峰;1.82处的三重峰对应SH。13C NMR分析表明,195.8峰为羰基碳吸收峰;145.7~127.8的8个峰归属苯环碳;28.5对应苄基碳。元素分析结果进一步证明了1的结构与Scheme 1预期吻合。
2.2 反应条件筛选
(1) 催化剂用量和反应时间
从反应原理看,硫脲首先进攻卤代烃生成异硫脲盐的反应属于亲核取代反应,亲核试剂与离去基团都会对反应产生影响。
以NaI为催化剂,其余反应条件同1.2,考察其用量和反应时间对反应的影响,结果见表1。从表1可见,不加NaI反应1 h, 1的收率中等(49%);加入0.5 mol%NaI反应30 min, 1的收率达75%,延长反应时间对其产率无明显影响。
从表1还可见,反应时间对反应有一定影响。加入1.0 mol%NaI反应 40 min, 2的收率就达83%,延长反应时间对其产率无明显影响。
(2) 水解温度
水解反应一般在回流条件下进行[7]。1.0 mol%NaI反应 40 min,其余反应条件同1.2,考察水解反应温度对合成2的影响,实验结果表明,回流温度并非最佳温度。在回流反应条件下,会产生较多的副产物,并导致产率下降,这一现象在合成 2时尤为明显。通过条件优化,温度为90 ℃并适当延长水解时间,可得到较高的收率。这可能是由于巯基产物本身易发生其它副反应如亲核、自由基、氧化反应等,在回流的剧烈条件下生成了其它副产物。另外,在制备 2 的后处理过程中,用乙醚萃取较合适,而用乙酸乙酯则分离产率下降。
综上所述,合成2的较佳反应条件为:n(4) ∶n(硫脲) ∶n(NaI)=2 ∶5 ∶0.02,回流反应40 min;于90 ℃反应3 h。
合成的1和2可同时起到两方面的功能:一是作为反应试剂参与巯基相关的点击反应;二是在点击反应中发挥光引发剂的功能,因此可有效克服小分子光引发剂的缺点。而且,2在高分子合成中还可起到交联剂的作用。
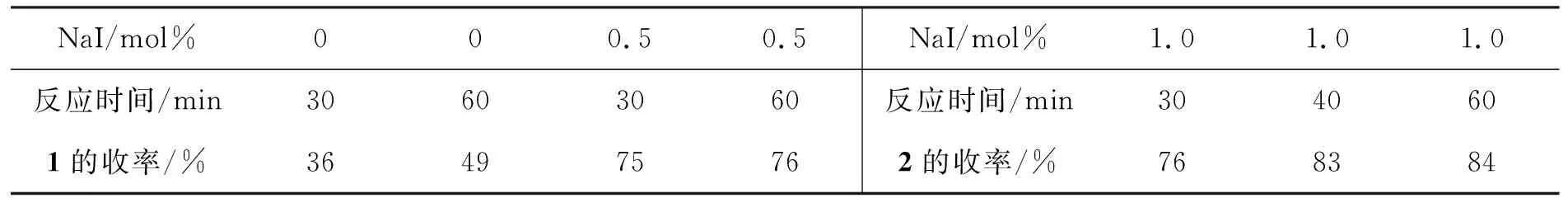
表1 催化剂用量和反应时间对反应条件的影响*Table 1 Effect of catalyst amount and reaction time on raction
*反应条件同1.2
[1] Hoyle C E, Bowman C N. Thiol-ene click chemistry[J].Angew Chem Int Ed,2010,49(9):1540-1573.
[2] Hoogenboom R. Thiol-yne chemistry:A powerful tool for creating highly functional materials[J].Angew Chem Int Ed,2010,49(20):3415-3417.
[3] 熊飞. 巯基化合物的合成[D].南京:南京理工大学,2010.
[4] 熊伟,刘金水,文应军. 二苯甲酮/胺:紫外光固化涂料中的新型引发剂[J].合成化学,1999,7(2):202-206.
[5] Matsushima H, Hait S, Li Q,etal. Non-extractable photoinitiators based on thiol-functionalized benzophenones and thioxanthones[J].Eur Polym J,2010,46(6):1278-1287.
[6] 邱艳秀,程传杰,黄海青,等. 具有光引发活性ATRP引发剂的选择性合成[J].合成化学,2011,19(1):59-61.
[7] Podkokielny W, Kultys A. Products of the reaction of 4,4′-bis(mercapto-methy1)benzophenone with halogenalkane acids and halogenalkane diols as new monomers[J].Die Angewundte Mukromolekulure Chemie,1997,246(1):71-83.
[8] 郑义,程传杰,黄海青,等. 过氧化尿素法快速合成具有光引发活性的 ATRP 引发剂[J].合成化学,2011,19(3):376-378.

