CAN/PEG-400体系催化合成氧杂蒽二酮类衍生物
曹瑞伟, 陈朝辉, 吴春雷, 周玉波, 高晓忠, 黄云云, 王欢欢
(1. 浙江医药股份有限公司 新昌制药厂,浙江 新昌 312500;2. 绍兴文理学院 化学化工学院,浙江 绍兴 312000)
氧杂蒽是一类重要的杂环化合物,是组成许多天然产物的结构单元,由于其结构中内在的吡喃环而常被用作合成复杂有机化合物的中间体。该类化合物在抗病毒、消炎、抗菌[1]和抗癌[2]等方面表现出了较好的药理活性,而且还被用作高效的激光染料[3]和荧光探针[4]。因此,开发高效、绿色的氧杂蒽类化合物的合成方法一直是有机化学中的研究热点。
自Nagarajan于1992年首次以达米酮和芳香醛合成氧杂蒽衍生物以来,该类化合物的合成方法层出不穷。其中用于催化合成该类化合物的催化剂有FeCl3·6H2O/离子液体[5], HCO2H/H2O[6], HPWA/MCM-41[7], H2SO4[8], Mg(HSO4)2[9], InCl3[10]等。然而,上述方法均存在反应时间长、产率过低、催化剂不易回收、操作繁琐等缺点。
本文以硝酸铈铵(CAN)为催化剂,PEG-400为溶剂,β-环己二酮(1a, 1g)与芳香醛(2a~2g)经一锅法合成了一系列氧杂蒽二酮类衍生物(3a~3l, Scheme 1),其结构经1H NMR和13C NMR确证。并对反应条件进行了优化,结果表明,在最佳反应条件下[1 10 mmol,n(1) ∶n(2)=2 ∶1, CAN 10 mol%(以2计算),于85 ℃反应2.0 h~3.0 h],收率83%~96%, CAN/PEG-400可回收套用4次。

Scheme1
该方法具有反应速度快、收率高和环境友好的特点,符合“绿色化学”的要求。
1 实验部分
1.1 仪器与试剂
Buchi M-560型熔点仪(温度未经校正);Avance DMX Ⅲ 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标)。
所用试剂均为化学纯或分析纯。
1.2 3的合成通法
在圆底烧瓶中依次加入PEG-400 5 mL, 1 10 mmol和2 5 mmol,搅拌下加入催化剂CAN 0.27 g,于85 ℃反应2 h~3 h(TLC跟踪)。冷却至室温,过滤,滤饼用95%乙醇重结晶得3。滤液于80 ℃烘干至恒重回收CAN/PEG-400(套用)。
3a:1H NMRδ: 0.99(s, 6H, CH3), 1.12(s, 6H, CH3), 2.21(q,J=20.0 Hz, 4H, CH2), 2.50(s, 4H, CH2), 4.83(s, 1H, CH), 7.48(d,J=8.4 Hz, 2H, ArH), 8.10(d,J=8.4 Hz, 2H, ArH);13C NMRδ: 196.4, 163.1, 151.7, 146.3, 129.4, 123.3, 114.3, 50.6, 40.7, 32.4, 32.2, 29.2, 27.2。
3a~3l的实验结果见表1;3b~3l的表征数据[13]与Scheme 1预期吻合。
2 结果与讨论
2.1 反应条件筛选
(1) 反应温度

表1 3a~3l的实验结果*Table 1 Experimental results of 3a~3l
反应条件同1.2
以5,5-二甲基-1,3-环己二酮(1a)与4-硝基苯甲醛(2a)反应合成3a为探针反应,考察反应温度对其收率的影响。结果表明,不加催化剂CAN时,于100 ℃反应,反应不能进行。加入10 mol% CAN(以2计算),于室温反应10 min,有大量固体生成,TLC检测显示原料点已基本消失,但经过滤、冰乙醇洗涤得到浅黄色固体的m.p.190 ℃,1H NMR检测发现在11.81处有强吸收峰,再经13C NMR分析及文献[11]对比,认为是芳香醛和达米酮的Knoevenagel反应的缩合物3a′(Chart 1);1H NMRδ: 1.12(s, 6H, CH3), 1.24(s, 6H, CH3), 2.32~2.52(m, 8H, CH2), 5.55(s,1H, CH), 7.25(d,J=10.4 Hz, 2H, ArH), 8.14(d,J=10.4 Hz, 2H, ArH), 11.81(s, 1H, ArOH);13C NMRδ: 191.0, 189.6, 146.6, 146.1, 127.7, 123.5, 114.9, 47.0, 46.4, 33.2, 31.5, 29.5, 27.4。
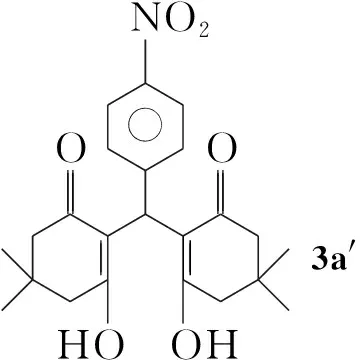
Chart1
将3a′投入CAN/PEG-400体系,于85 ℃反应2.0 h, TLC检测原料点基本消失,并有新物质生成,经后处理得浅黄色晶体,m.p.226 ℃;1H NMR检测后高位移处的羟基吸收峰已经消失,与文献[11]值对比,确证此物质才是预期的氧杂蒽3a。因此,我们认为该反应历程实质是芳香醛先与β-环己二酮经Knoevenagel反应缩合得到氧杂蒽的开环物,再经脱水生成氧杂蒽。
较佳的反应温度为85 ℃。
(2) CAN用量
于85 ℃反应2 h,其余反应条件同1.2,考察CAN用量对合成3a的影响,结果表明,CAN的用量10 mol%(以2计算)即可。
在研究2的苯环上取代基对反应的影响时发现,芳环上的取代基(吸电子或给电子基团)对反应活性和产物收率影响不大。但邻位有取代基时影响较大,尤其是水杨醛,同等反应条件下收率较低。
2.2 CAN/PEG-400的回收套用
以合成3a为例,考察CAN/PEG-400的回收套用情况,结果见表2。从表2可见,CAN/PEG-400体系回收套用四次,其催化活性未见明显降低。
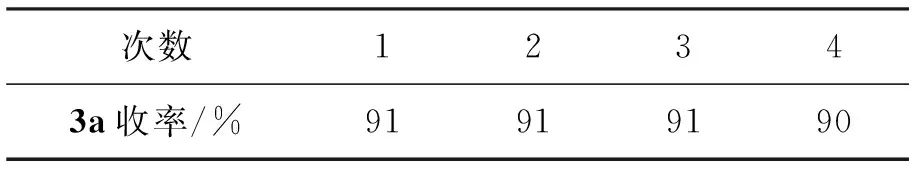
表 2 CAN/PEG-400的回收使用结果*Table 2 Recycled reuse results of CAN/PEG-400 system
*CAN 10 mol%(以2计算),于85 ℃反应2 h,其余反应条件同1.2
[1] Muharrem K, Erhan B, Ferdag C. Synthesis and antimicrobial activity of some bisoctahydroxanthene-1,8-dione derivatives[J].Med Chem Res,2011,20(8):1214-1219.
[2] Silvia G, Angela R, Alessandra B,etal. Synthesis and antitumor activity of new derivatives of xanthen-9-one-4-acetic acid[J].J Med Chem,2002,45(22):4931-4939.
[3] Akio O, Ippei T, Takahiro K,etal. Turn-on fluorescence sensing of nucleoside polyphosphates using a xanthene-based Zn(Ⅱ) complex chemosensor[J].J Am Chem Soc,2008,130(36):12095-12101.
[4] Janet C, Erhan D, Francisco M. Photochromic compounds for fluorescence nanoscopy[J].Curr Phys Chem,2011,1(3):232-241.
[5] 范学森,李艳贞,张新迎,等. 离子液体介质中FeCl3·6H2O催化下芳香醛与5,5-二甲基-1,3-环己二酮的缩合反应[J].有机化学,2005,25(11):1482-1486.
[6] 张美月,刘敏,李越敏. 无相转移剂水相中3,3,6,6-四甲基-9-芳基-1,2,3,4,5,6,7,8-八氢化氧杂蒽-1,8-二酮的合成[J].化学试剂,2009,31(12):1026-1028.
[7] Karthikeyan G, Pandurangan A. Heteropoly acid(H3P W12O40) supported MCM-41:An efficient solid acid catalyst for the green synthesis of xanthenedione derivatives[J].J Mol Catal A:Chem,2009,311(1-2):36-45.
[8] Zhang F Y, Wang Y X, Yang F L,etal. Efficient solvent-free Knoevenagel condensation between diketone and aldehyde catalyzed by silica sulfuric acid[J].Syn Commun,2011,41(3):347-356.
[9] Shaterian H R, Doostmohammadi R, Khorami F. Mag nesium hydrogensulfate[Mg(HSO4)2] as an efficient catalyst for the preparation of silyl ethers, dibenzo[a,j]xanthenes,and octahydroxanthene derivatives[J].Phosphorus,Sulfur and Silicon Relat Elem,2010,185(1):171-180.
[10] Verma G K, Raghuvanshi K, Vervia R K,etal. An efficient one-pot solvent-free synthesis and photophysical properties of 9-aryl/alkyl-octahydroxanthene-1,8-diones[J].Tetrahedron,2011,67(20):3698-3704.
[11] Song G Y, Wang B, Luo H T,etal. Fe3+-montmorillonite as a cost-effective and recyclable solid acidic catalyst for the synthesis of xanthenediones[J].Catal Commun,2007,8:673-676.
[12] 王桂兰,曾必文,康晖,等. 酸性离子液体催化合成9-芳基-2,3,4,5,6,7-六氢-2H-氧杂葸-1,8-二酮[J].化学试剂,2008,30(10):773-775.
[13]3b:1H NMRδ: 0.99(s, 6H, CH3), 1.10(s, 6H, CH3), 2.20(q,J=28.0 Hz, 4H, CH2), 2.46(s, 4H, CH2), 4.75(s, 1H, CH), 7.08~7.28(m, 5H, ArH);13C NMRδ: 193.6, 165.4, 143.6, 128.0, 127.2, 115.6, 50.4, 40.3, 32.0, 31.3, 29.1, 27.1.3c:1H NMRδ: 0.99(s, 6H, CH3), 1.10(s, 6H, CH3), 1.54(s, 3H, CH3), 2.20(q,J=24.0 Hz, 4H, CH2), 2.45(s, 4H, CH2), 4.71(s, 1H, CH), 7.02(d,J=7.2 Hz, 2H, ArH), 7.17(d,J=7.2 Hz, 2H, ArH);13C NMRδ: 196.5, 162.2, 141.2, 135.7, 128.8, 128.2, 115.7, 50.8, 40.8, 32.2, 31.4, 29.3, 27.4, 21.1.3d:1H NMRδ: 0.99(s, 6H, CH3), 1.10(s, 6H, CH3), 2.20(q,J=26.8, 4H, CH2), 2.45(s, 4H, CH2), 3.73(s, 3H, CH3), 4.70(s, 1H, CH), 6.75(d,J=7.2 Hz, 2H, ArH), 7.20(d,J=7.2 Hz, 2H, ArH);13C NMRδ: 196.5, 162.1, 157.9, 136.5, 129.3, 115.7, 113.4, 55.1, 50.8, 40.8, 32.2, 31.0, 29.3, 27.3.3e:1H NMRδ: 0.99(s, 6H, CH3), 1.11(s, 6H, CH3), 2.20(q,J=28.0 Hz, 4H, CH2), 2.46(s, 4H, CH2), 4.71(s, 1H, CH), 7.19(d,J=8.0 Hz, 2H, ArH), 7.23(d,J=8.0 Hz, 2H, ArH);13C NMRδ: 196.4, 162.5, 142.8, 131.9, 129.8, 128.2, 115.2, 50.7, 40.8, 32.2, 31.5, 29.3, 27.3.3f:1H NMRδ: 1.01(s, 6H, CH3), 1.11(s, 6H, CH3), 2.15~2.26(m, 4H, CH2), 2.48(s, 4H, CH2), 5.53(s, 1H, CH), 7.26(m, 1H, ArH), 7.42(m, 2H, ArH), 7.76~7.78(d, 1H, ArH);13C NMRδ: 196.4, 163.1, 149.7, 138.3, 132.1, 127.1, 124.6, 114.2, 50.6, 40.8, 32.1, 29.0, 28.2, 27.5.3g:1H NMRδ: 0.99(s, 6H, CH3), 1.13(s, 6H, CH3), 1.91~2.02(m, 4H, CH2), 2.34~2.63(m, 4H, CH2), 4.66(s, 1H, CH), 7.00~7.26(m, 4H, ArH), 10.53(s, 1H, ArOH);13C NMRδ: 200.9, 169.1, 151.0, 128.0, 127.5, 115.7, 50.0, 41.5, 32.3, 31.0, 29.2, 27.7, 27.2.3h:1H NMRδ: 1.91~2.09(m, 4H, CH2), 2.28~2.42(m, 4H, CH2), 2.53~2.69(m, 4H, CH2), 4.77(s, 1H, CH), 7.17~7.27(m, 5H, ArH);13C NMRδ: 196.7, 164.2, 143.0, 132.0, 129.8, 128.2, 116.4, 36.9, 31.3, 27.1, 20.3.3i:1H NMRδ: 1.91~2.07(m, 4H, CH2), 2.27~2.42(m, 4H, CH2), 2.53~2.69(m, 4H, CH2), 4.81(s, 1H, CH), 7.10~7.29(m, 4H, ArH);13C NMRδ: 196.6, 164.0, 144.4, 128.4, 128.1, 126.4, 116.9, 37.0, 31.6, 27.1, 20.3.3j:1H NMRδ: 1.92~2.08(m, 4H, CH2), 2.25~2.41(m, 4H, CH2), 2.51~2.68(m, 4H, CH2), 4.72(s, 1H, CH), 7.03(d,J=8.0 Hz, 2H, ArH), 7.19(d,J=8.0 Hz, 2H, ArH);13C NMRδ: 196.7, 164.0, 141.6, 135.8, 128.8, 128.2, 116.9, 37.0, 31.2, 27.1, 21.1, 20.3.3k:1H NMRδ: 1.75~1.86(m, 2H, CH2), 1.99~2.17(m, 4H, CH2), 2.38~2.45(m, 2H, CH2), 2.46~2.62(m, 3H, CH2), 2.64~2.79(m, 1H, CH2), 4.64(s, 1H, CH), 7.01~7.04(m, 3H, ArH), 7.14~7.18(m, 1H, ArH), 10.85(s, 1H, ArOH);13C NMRδ: 201.4, 197.0, 172.8, 171.1, 150.9, 128.0, 127.5, 124.6, 119.8, 115.5, 112.3, 37.0, 36.0, 29.7, 28.0, 19.9, 19.6.3l:1H NMRδ: 1.93~2.08(m, 4H, CH2), 2.27~2.40(m, 4H, CH2), 2.41~2.68(m, 4H, CH2), 3.74(s, 3H, CH3), 4.76(s, 1H, CH), 6.75~6.77(m, 2H, ArH), 7.20~7.23(m, 2H, ArH);13C NMRδ: 196.7, 163.9, 158.0, 136.8, 129.3, 117.0, 113.5, 55.1, 37.0, 30.7, 27.1, 20.3.

