玻璃化法冷冻和慢速冷冻对人类卵巢组织的影响
牛晓明
卵巢组织的冷冻保存是女性生殖保险的一种新方法。本研究分别采用玻璃化冷冻法及慢速程序冷冻法,将人类卵巢组织冷冻保存,解冻后对组织切片进行光镜及卵泡凋亡观察,比较不同冷冻保护方案对人类卵巢组织的保护作用,探究玻璃化法冷冻保存人类卵巢组织的可行性。
1 材料和方法
1.1 卵巢组织来源及处理 卵巢组织来自2009年7月至2010年7月期间,泰安市中心医院生殖遗传科因各种原因需部分卵巢组织的育龄期女性,共计19例。获取的卵巢组织用含5%人血清白蛋白的磷酸盐缓冲液反复清洗后,去除卵巢髓质、脂肪等杂质部分,仅留卵巢皮质并切割成约切成1 mm×1 mm×1 mm的组织块,随机分为3组:玻璃化冷冻组、程序冷冻组、新鲜对照组。
1.2 主要试剂 丙二醇(PRHO)、乙二醇(EG)、二甲基亚砜(DMSO)、蔗糖(S)、聚乙烯吡咯烷酮(PVP)、磷酸盐缓冲液(PBS)均购自美国Sigma公司,人血清白蛋白(HSA)购自瑞典Vitrolife公司
1.3 冷冻复苏方案
1.3.1 玻璃化冷冻 冷冻方法:卵巢组织块在冷冻基础液(PBS+10%HSA)的培养皿中平衡10 min后,进行三步渗透平衡:①卵巢组织块在冷冻液1(0.35 mol/L DMSO+0.38 mol/L PROH+0.38 mol/L EG+冷冻基础液)的培养皿中平衡10 min。②4℃条件下卵巢组织块在含冷冻液2(0.7 mol/L DMSO+0.75 mol/L PROH+0.75 mol/L EG+冷冻基础液)的培养皿中平衡10 min。③4℃条件下卵巢组织块在含冷冻液3(1.4 mol/L DMSO+1.5 mol/L PROH+1.5 mol/L EG+10%PVP的冷冻基础液)的培养皿中平衡10 min。卵巢组织从冷冻液3中取出后,转入开放式0.5 ml麦管中,然后将含有玻璃化冷冻组织的麦管置入预冷的5 ml冷冻管中后投入液氮中保存。复温方法:①麦管从冷冻管中取出后直接置入37℃预热的(PBS+10 mg/ml HSA+0.5 mol/L S)中置换5 min。②取出的卵巢组织在含有解冻液(PBS+10 mg/ml HSA+0.25 mol/L S)的培养皿中置换5 min。③取出的卵巢组织在含有解冻液(PBS+10 mg/ml HSA+0.125 mol/L S)的培养皿中置换5 min。④取出的卵巢组织在含有解冻液(PBS+10 mg/ml HSA)的培养皿中置换5 min。
1.3.2 慢速程序冷冻 冷冻方法参考Newton等[1 2]的慢速程序冷冻法:将卵巢组织投入含1.5 mol/L PROH+0.1 mol/L S+10 mg/ml HSA的PBS液中,室温平衡90 min,装入0.5 ml冷冻管中放于程序冷冻仪上,从室温开始以2℃/min降至-7℃,人工植冰,再以0.3℃/min的降温速率降至-30℃,以10℃/min的降温速率降至-120℃,投入液氮中冷冻保存。复温方法:将冷冻管自液氮罐中取出,置入37℃水浴箱中2-3 min,室温中按含1.0 mol/L PROH、0.5 mol/L PROH的 PBS液梯度递减洗脱冷冻保护剂各三遍,将组织移入含5%HSA的PBS液中完成复温。
1.4 冻融后卵巢组织结构分析
1.4.1 新鲜及冻融卵巢组织的组织学观察 光镜下观察各级卵泡及卵巢间质细胞的结构形态学改变,计数形态正常和异常的间质细胞、始基卵泡和初级卵泡。为避免重复计数,每间隔10个组织切片分析一次。
1.4.2 人类卵巢组织内卵泡凋亡情况观察 采用TUNEL实验来观察卵泡的凋亡情况。实验步骤按照产品说明书进行。切片在光镜随机选取10个视野,计数全部及凋亡卵泡数,计算凋亡卵泡率。
1.5 统计学方法 采用SPSS 13.0统计软件进行统计分析。样本率的比较采用Fisher's确切概率法或χ2检验。以α=0.05为检验水准。
2 结果
2.1 冻融后卵巢组织的形态学观察 卵巢组织中形态正常的卵泡表现为卵泡及卵母细胞呈圆形,卵母细胞膜完整,细胞核形态正常。形态异常的卵泡表现为卵泡和卵母细胞形态失常,皱缩,卵母细胞浆内出现较多空泡,细胞核固缩,卵母细胞外周颗粒细胞不完整。形态异常的间质细胞主要表现为细胞核固缩。慢速程序冷冻组的异常卵巢间质细胞比率高于玻璃化冷冻组和新鲜对照组,差异有统计学意义(P<0.05),玻璃化冷冻组与新鲜对照组差异无统计学意义(P>0.05)。各冷冻组的异常始基卵泡及初级卵泡比率均高于新鲜对照组,差异有统计学意义(P<0.05),各冷冻组间差异无统计学意义(P >0.05)。见表1、2。
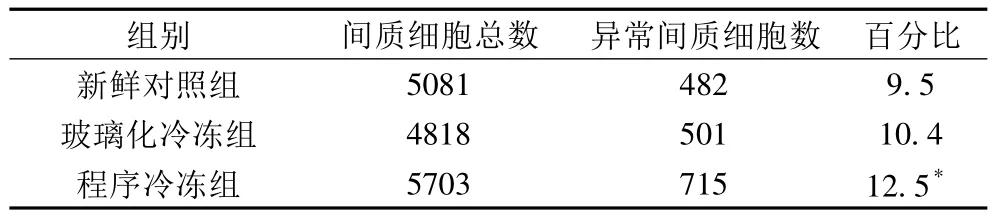
表1 不同冷冻方案卵巢间质细胞形态学的改变

表2 不同冷冻方案卵泡形态学的改变
2.2 冻融卵巢组织中卵泡凋亡比值 3组中共计数了169个卵泡,凋亡卵泡比值分别为23.3%(10/43)、21.9%(9/41)、18.9%(11/37)组间比较差异无统计学意义(P>0.05)。见表3。

表3 不同冷冻方案卵泡卵泡凋亡率比较
3 讨论
放射疗法及化学药物疗法的生殖细胞毒性作用,可导致女性恶性肿瘤患者卵巢功能衰竭[3]。为生殖保险而进行的人类卵巢组织冷冻保存已成为生殖医学研究的热点。传统慢速程序冷冻法过程繁琐,需要昂贵的程序冷冻仪,且对卵巢组织的间质细胞保护效果欠佳[4]。有别于慢速程序冷冻法在降温的冷冻过程中会形成冰晶,进而造成对组织的伤害,玻璃化冷冻技术的特点是使细胞本身及冷冻溶液在冷冻时,呈现黏稠而不产生结晶的玻璃化状态,以改善慢速冷冻之缺点[5]。Miyamoto H 等[6]通过玻璃化冷冻大鼠卵巢后,观察到卵巢形态学结构保存良好。Isachenko等[7]采用乙二醇+蔗糖+蛋黄混合液作为玻璃化液,采用液氮直投法冷冻保存人类卵巢组织。研究发现,卵巢组织中的始基卵泡和初级卵泡可以得到很好地保存。本研究联合应用DMSO、EG、PROH,采用了三步渗透法,逐渐增加玻璃化冷冻保护剂浓度。为减小DMSO毒性,本研究在4℃下进行第二、三步平衡。并在第三步平衡时添加了PVP,PVP可以优先同溶液中水分子结合,降低溶液中自由水的含量,使冰点降低,减少冰晶的形成。同时,由于其分子量大,使溶液中电解质浓度降低,从而减轻溶质损伤[8]。在冷冻过程中,我们使用了经过开放式的冷冻麦管,尽可能减少组织周围的液体容积,最大限度提高组织冷冻速度。复温溶解时,解冻液中的蔗糖,提供了一个细胞外高渗环境,防止细胞肿胀造成的渗透休克[9]。
Demirci等[10]认为卵巢组织冷冻保存后,卵泡DNA损伤增加。本研究应用TUNEL实验来观察DNA受损情况,发现冷冻组和对照组的卵泡凋亡率无统计学差异,证实玻璃化冷冻并不会造成卵泡DNA的损伤。
本研究证实采用DMSO、EG、PROH、PVP等作为冷冻保护剂,三步渗透平衡的玻璃化法,其冷冻保存人类卵巢组织中的始基卵泡和初级卵泡的功效与传统慢速程序法相似,对卵巢间质的保护优于慢速程序冷冻法。不会造成卵泡DNA的损伤,且具有冷冻步骤简单,无须昂贵、复杂的冷冻设备等优点,是适宜的人类卵巢组织冷冻保存的方法。
[1]Newton H,Aubard Y,Rutherford A,et al.Low temperature storage and grafting of human ovarian tissue.Hum Reprod,1996,11(7):1487-1491.
[2]Newton H,Fisher J,Arnold JR,et al.Permeation of human ovarian tissue with cryoprotective agents in preparation for cryopreservation.Hum Reprod,1998,13(2):376-380.
[3]Meirow D,Nugent D.The effects of radiotherapy and chemotherapy on female reproduction.Hum Reprod update,2001,7(6):535-543.
[4]Hreinsson J,Zhang P,Swahn ML,et al.Cryopreservation of follicles in human ovarian cortical tissue.Hum Reprod,2003,18(11):1-9.
[5]Dela Pena EC,Takahashi Y,Katagiri S,et al.Birth of pups after transfer of mouse embryos derived from vitrified preantral follicles.Reproduction 2002,123(4):593-600.
[6]Miyamoto H,Sugimoto M.Assessment of follicle development and histo cytological examination of neonatal rat ovaries cryopreserved by vitrification technique.Cryobiology,1994,31:614-615.
[7]Isachenko E,Isachenko V,Rahimi G,et al.Cryopreservation of hu-man ovarian tissue by direct plunging into liquid nitrogen.Eur J Obstet Gy-necol Reprod Biol,2003,108(2):186-193.
[8]Victoria Keros1,Susanna Xella,Kjell Hultenby,et al.Vitrification versus controlled-rate freezing in cryopreservation of human ovarian tissue.Human Reproduction,2009,24(7):1670-1683.
[9]Oktay K,Economos K,Kan M,et al.Endocrine function and oocyte retrieval after autologous transplantation of ovarian cortical strips to the forearm.JAMA,2001,286(12):1490-1493.
[10]Demirci B,Salle B,Frappart L,et al.Morphological alterations and DNA fragmentation in occytes from primordial and primary follicles after freezing-thawing of ovarian cortex in sheep.Fertil Steril 2002,77(3):595-600.

