电针加灸对AD模型大鼠细胞周期调节因子cyclinE、p21/cip的影响*
夏微光 杜艳军 孙国杰 熊 萍 刘若兰
湖北中医药大学针灸骨伤学院,武汉 430065
阿尔茨海默病(Alzheimer's disease,AD)是一种进行性发展的神经退行性疾病,是一种老年人常见病。临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,并有各种神经精神症状和行为障碍。如今人口老龄化已成为我国乃至全球性的社会问题,因此对AD的防治亦日益受到人们的重视。AD患者脑神经元的凋亡比正常人高出30~50倍,所以细胞凋亡是引起AD患者脑神经元数目减少的重要原因之一[1]。近年来的研究[2]发现,AD病理的发展及与其相关的细胞凋亡是细胞周期调控异常所致神经元重新进入细胞分裂周期失败的结果。cyclinE与p21/cip这两种细胞周期蛋白表达的异常是导致细胞周期紊乱的物质基础和重要原因之一。已有越来越多的临床及动物实验研究[3-5]表明,针灸治疗AD疗效肯定。本研究旨在通过电针加艾灸同时治疗AD模型大鼠,探讨电针和艾灸的协同作用对AD大鼠海马区cyclinE、p21/cip表达的影响,以进一步阐明针灸防治AD的相关机制。
1 材料与方法
1.1 实验动物及分组
Wistar大鼠,雄性50只,鼠龄(10.0±2.0)个月,体重(360.0±20.0)g,SPF级(由湖北省疾控中心提供)。购进后适应性喂养,正常饮食、饮水,7d后即开始进行Morris水迷宫测试,剔除不合格者(即反应过于迟钝或灵敏者),将合格大鼠40只称重后随机分为正常组、假手术组、模型组、治疗组,每组10只。
1.2 仪器及试剂
Morris水迷宫软件公司(MT-200Morris水迷宫视频跟踪系统,成都泰盟科技有限公司),颅脑立体定位仪(编号:89-00136,国营西北光学仪器厂),微量注射器(宁波市镇海玻璃仪器厂),BI-2000医学图像分析系统(成都泰盟科技有限公司)。Aβ1-42(美国Sigma公司),兔抗大鼠cyclinE多克隆抗体(北京博奥森公司),兔抗大鼠p21/cip多克隆抗体(北京博奥森公司),生物素化山羊抗兔二抗工作液(北京中杉金桥公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司),生物素化山羊抗兔二抗工作液AP显色液。
1.3 方法
1.3.1 动物模型制作 参照刘静等[6]的造模方法,将大鼠称重,用10%水合氯醛(3.5ml/kg)麻醉后,按大鼠脑立体定位图谱进行定位,在前囟后3.3mm,中线左右各旁开1.5mm,用牙科钻钻一小孔(直径1mm),垂直插入微量注射器,使针尖自颅骨表面缓慢进入3mm至海马区,用微量注射器分别注入5μl聚集肽的 Aβ1-42(按试剂说明,将0.1mg的 Aβ1-42单体用二甲基亚砜50μl溶解后,再加入0.01M的PBS 50μl稀释配制成1μg/μl的溶液,37℃水浴箱孵育1周,使其变成寡聚状态而具有神经毒性,-20℃分装保存)。5min内注射完,注射后留针5min,按1.0 mm/min速度缓慢拔针,以免拔针时药物溢出。术后牙托粉封固颅骨孔,缝合皮肤,局部外敷青霉素G粉,并于术后3d内(包括当日)每日肌肉注射青霉素G粉10万单位预防感染。
1.3.2 处理方法 正常组:正常喂养,不进行任何处理,作为实验对照组;假手术组:颅内注射与Aβ1-42等量生理盐水,余同模型组;模型组:适应性喂养1周后即行造模,造模完毕后,大鼠正常喂养16d(以便药物的吸收)后进行行为学检测;治疗组:造模完毕后,大鼠正常喂养3d后即行治疗。取穴根据郭义[7]提供的大鼠穴位定位方法,针灸前将正常大鼠“百会”(顶骨正中)、“肾俞”(第2腰椎下两旁)穴区直径约1.5~2.0cm区域的鼠毛剪净,暴露穴区皮肤,消毒,然后用1寸毫针对准百会穴刺入,当针尖刺到颅骨有阻力时调整方向,沿皮向后透刺约3~5mm,再用1寸毫针分别对准两侧肾俞穴向内斜刺5mm,再把电针仪的正极接左侧肾俞穴,负极接百会穴,开始通电,强度1 mA,连续波,频率2Hz,时间15min,次日改正极接右侧肾俞穴。电针治疗完毕后在上三穴上方2~3cm采用特制艾条(直径6mm)施以温和灸,使穴位表皮温度在(43.0±1.0)℃,每穴持续15min。上述操作每日1次,6d为1个疗程,疗程间休息1d,共治疗2个疗程后次日进行行为学检测。
1.3.3 标本制备及检测方法 将4组(每组10只)大鼠麻醉后快速断头取脑,剥离一侧海马称重,剪碎置于匀浆器中,加入组织匀浆液(500μl裂解液加10μl PMSF加10μl磷酸酶抑制剂)置于冰盒中反复捻转使组织尽量研碎,30min后转入离心管,在4℃下12 000rpm离心30min,取上清采用BCA法测定样品蛋白浓度。取80μg蛋白样品放入97℃变性,用12%的SDS-聚丙烯酰胺凝胶电泳,电泳结束后将蛋白电转移到PVDF膜上,剪取所需条带,用含5%脱脂奶的TBST封闭1h,分别用兔抗cyclinE和兔抗p21/cip多克隆抗体(1∶100)孵育4℃过夜,用生物素化山羊抗兔二抗37℃孵育1h,AP显色液显色(取NBT、BICP液各4μl加入992μl的APbuffer中,滴在转有目的蛋白的PVDF膜上,避光显色),显色充分后用清水中止。将目的条带膜烘干保存,扫描后用BI-2000医学图像分析系统测定蛋白条带吸光度(OD)值,对免疫印迹(Western blot)结果进行分析。另外,增加内参照蛋白β-actin的检测(兔抗β-actin多克隆抗体,Santa Cruz,1∶200),cyclinE、p21/cip的OD值分别与β-actin的OD值的比值作为观察指标。
1.4 统计学处理
采用SPSS 17.0统计软件,用SNK检验对所得数据进行统计分析,所有数据均以±s表示,以P<0.05为差异有统计学意义。
2 结果
以Maker所显示的条带对应的分子量作为参照确定cyclinE蛋白(51kDa)、p21/cip蛋白(21kDa)和β-actin蛋白(43kDa)的位置,结果在相应的位置都出现了棕色的阳性反应。见图1。
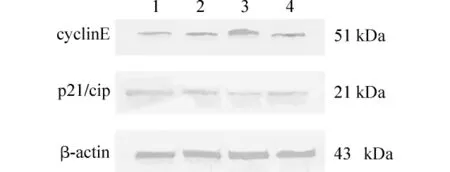
图1 cyclinE、p21/cip的表达(Western blot法)
用BI-2000医学图像分析系统测定蛋白条带OD值,并与β-actin的OD值比较,结果显示,cyclinE在模型组中的表达量明显高于正常组和假手术组(P<0.05),而治疗组cyclinE表达明显低于模型组(P<0.05),且与正常组和假手术组比较差异无统计学意义。模型组p21/cip表达明显低于正常组和假手术组(P<0.05),治疗组明显高于模型组(P<0.05)。见表1。
表1 4组大鼠cyclinE、p21/cip蛋白表达的比较(n=10,%,±s)

表1 4组大鼠cyclinE、p21/cip蛋白表达的比较(n=10,%,±s)
与模型组比较* P<0.05;与正常组比较△ P<0.05
组别 cyclinE p21/ci p 0.5449±0.0198 0.8958±0.0490假手术组 0.5744±0.0050* 0.7594±0.0685*△ 模型组 0.6958±0.0654△ 0.3764±0.0495△ 治疗组 0.5604±0.0385* 0.5432±0.0604正常组*△
3 讨论
AD的病理特征之一是大量神经元丢失。AD引起神经元丧失的主要机制是细胞凋亡,神经细胞调亡假说是AD病因病机学说的重要组成部分[8-9]。细胞周期需要细胞周期蛋白(cyclin)、细胞周期蛋白依赖性激酶(CDK)和细胞周期蛋白依赖性激酶抑制因子(CKI)三者的相互作用来调控,以保证细胞分裂正常进行。AD患者脑内正常的神经细胞本来已停止分化,可长期存活,处于不可复原的状态,即G0期,不再参与细胞增殖。如果cyclin、CDK或CKI三者的平衡被打破,细胞就会重启细胞周期,而一旦进入有丝分裂后期出现障碍,致使细胞分裂失败,就会导致细胞周期停滞,形成细胞凋亡[10]。Vincent等[11]首先报道,在AD患者脑中存在重新进入细胞周期的神经元,由于CKI失活,导致G1/S控制点的失调。神经元细胞一旦跨过G1/S控制点,就能够进行DNA的复制,并且能够进入G2期,但是细胞不能进行正常的分裂,所以就启动凋亡程序,引发细胞凋亡。
cyclinE能使细胞越过G1/S期调控点,激活视网膜母细胞瘤蛋白(pRb),使其释放出转录因子E2Fs,E2Fs再促进cyclinE与CDK2结合形成cyclinECDK2复合体,后者进一步磷酸化pRb,充分释放E2Fs,促进许多有关DNA复制的基因表达[12]。p21/cip属于CKI中的一种,当DNA损伤和细胞衰老时,一方面,它能结合并抑制 cyclinD-CDK4、cyclinECDK2、cyclinA-CDK2等复合物的磷酸化活性,使Rb低磷酸化不能释放E2F而致DNA合成受限,导致细胞不能进入S期,而停滞在G1期;另一方面,在p21/cip端有增殖细胞核抗原(PCNA)结合域,能覆盖其某些功能区,使PCNA不能与DNA聚合酶δ形成复合物,或导致DNA全酶复合物不能在DNA单链上滑动,从而影响DNA的复制[13]。这样就可以避免细胞重新进入分裂周期失败所导致的凋亡。
Aβ由淀粉样前体蛋白(APP)裂解而来,Aβ可引起氧化应激、Ca2+内流,进而损伤线粒体,导致神经细胞产能障碍,激活凋亡相关蛋白和因子,致使细胞周期异常,进而导致神经细胞凋亡或AD某种病理改变,发生AD。Aβ1-42疏水性强,更易聚集,更容易在特定脑区聚集沉积,导致AD中老年斑的形成[14],所以本文用Aβ1-42蛋白片段复制AD大鼠模型的成功率比较高,技术也较熟练。
cyclinE表达于G1期,与CDK2结合后对细胞周期具有正性调控作用,而p21/cip有负性调控作用,这两个细胞周期调节因子表达紊乱可致细胞周期紊乱,因此本文通过检测cyclinE、p21/cip在AD模型大鼠海马中的含量以期进一步阐明针灸治疗AD的作用机制。结果显示,模型组cyclinE含量比正常组和假手术组升高,p21/cip含量比正常组和假手术组明显减少。过多的cyclinE能使神经细胞越过G1/S期调控点,激活视网膜母细胞瘤蛋白以及其下游程序;p21/cip减少后不能抑制cyclin-CDK复合物的磷酸化活性,使得DNA能够合成从而细胞进入S期,同时PCNA与DNA聚合酶δ形成复合物,DNA大量复制,细胞重新进入分裂周期,但在分裂后期失败从而导致凋亡的发生。通过治疗,cyclinE含量比模型组明显降低,使细胞能维持在静止状态,从而避免凋亡程序的启动;p21/cip含量比模型组明显增多,它与大量的cyclin-CDK复合物结合导致DNA合成受阻,从而使细胞停滞在G1期,同时覆盖PCNA某些功能区,阻止DNA的复制,防止细胞重新进入分裂周期产生凋亡。结果还显示,假手术组p21/cip的表达与正常组比较亦存在一定的差异,这可能与模型复制过程中大鼠海马存在不可避免的轻微损伤有关,但与模型组比较仍存在一定的差异性(P<0.05);同时,针灸治疗组与正常组比较也存在一定的差异,但与模型组比较有显著的好转(P<0.05)。笔者认为,就p21/cip蛋白而言,其未达到与正常组一致的水平可能与治疗的疗程或方法等有关,此点有待进一步研究。
中医认为,痴呆病位在脑,其根本病机为精、气、血不足导致脑髓失养,故治疗原则为培肾固本、益精填髓。脑居颅内,主灵机、记忆,司智力意识,支配感觉,统帅全身。督脉为“阳脉之海”、“入属于脑”,与脑髓关系很密切,故有“病变在脑,首取督脉”的说法。百会穴属督脉,居巅顶,手足三阳、足厥阴等经交汇于此,为“三阳五会”,具有开窍醒神、补脑益智之功。肾为先天之本,藏精、生髓,肾俞穴为肾之背俞穴,肾之精气皆转输汇集于此,肾经与督脉相通,共同入髓络脑,共主一身阳气。故本实验电针“肾俞”能补益肾精,使精气上注于脑,从而生髓益脑,电针“百会”可激发阳气,充养脑髓,提高记忆思维能力,艾灸上两穴更可起到通经活络、益肾健脑之功。
综上所述,电针加艾灸可以明显改善AD模型大鼠海马神经元中细胞周期调节因子表达的不平衡,减少神经元的凋亡,对AD起到固本培元、填精益髓的治疗作用。但在AD发生发展的不同阶段,通过治疗,使细胞周期正负调节因子间达到怎样一个具体的平衡还有待进一步研究。
[1]YUAN J,YANKNER BA.Apoptosis in the nervous system[J].Nature,2000,407(6805):802-809.
[2]NAGY Z.The dysregulation of the cell cycle and the diagnosis of Alzheimer's disease[J].Biochim Biophys Acta,2007,1772(4):402-408.
[3]李建美,陈凤兰,李桂玲.开窍醒脑通络法治疗老年痴呆症25例[J].新中医,2006,38(6):71-72.
[4]刘勇前,何强,孙秀文.独灸百会穴配合八仙益智粥治疗老年期痴呆98例[J].中医药学报,2003,31(4):38-39.
[5]周冰,王琼,马俊.浅议针灸对老年期痴呆的调治[J].针灸临床杂志,2008,24(6):45-46.
[6]刘静,杜艳军,李婧,等.艾灸预刺激对AD大鼠细胞周期调节因子cyclinA,p21/cip的影响[J].时珍国医国药,2011,22(11):2612-2613.
[7]郭义.实验针灸学 [M].北京:中国中医药出版社,2008:360.
[8]庄莹,陈杰.阿尔茨海默病病因及发病机制研究进展[J].吉林医药学院学报,2008,29(2):101-104.
[9]丁新生.老年性痴呆的病理、发病机制及其诊断研究[J].中国临床康复,2004,8(19):3885-3887.
[10]谢朝阳,祝其锋.细胞周期调控与阿尔茨海默病的研究进展[J].中国老年学杂志,2004,24(4):379-381.
[11]VINCENT I,ROSADO M,DAVIES P.Mitotic mechanisms in Alzheimer's disease?[J].J Cell Biol,1996,132(3):413-425.
[12]OBAYA AJ,SEDIVY JM.Regulation of cyclin-Cdk activity in mammalian cells[J].Cell Mol Life Sci,2002,59(1):126-142.
[13]马骥,刘文超.细胞周期蛋白依赖性激酶抑制剂与肿瘤相关性的研究进展[J].中国肿瘤生物治疗杂志,2009,16(3):315-316.
[14]JUNG SS,NALBANTOGLU J,CASHMAN NR.Alzheimer’s beta-amyloid precursor protein is expressed on the surface of immediately ex vivo brain cells:a flow cytometric study[J].J Neurosci Res,1996,46(3):336-348.

