微生物固态发酵菜籽粕营养特性的研究
胡永娜 李爱科 王之盛 张晓琳 刘国明 韩 伟
(国家粮食局科学研究院1,北京 100037)
(四川农业大学动物营养所2,雅安 625014)
微生物固态发酵菜籽粕营养特性的研究
胡永娜1,2李爱科1王之盛2张晓琳1刘国明1韩 伟1
(国家粮食局科学研究院1,北京 100037)
(四川农业大学动物营养所2,雅安 625014)
以普通菜籽粕为原料,选用枯草芽孢杆菌、地衣芽孢杆菌、植物乳杆菌、啤酒酵母、季也蒙毕赤酵母及黑曲霉等菌种,通过单菌株与混菌株发酵试验,研究发酵对菜籽粕中粗蛋白和抗营养因子含量的影响。结果表明,芽孢杆菌的蛋白酶活性高于其他菌株;混菌株发酵效果明显优于单菌株发酵;混菌株发酵中枯草芽孢杆菌、植物乳杆菌和啤酒酵母三菌种组合发酵能较好地提高菜籽粕作为饲料蛋白的品质,此时其粗蛋白质增加率和硫代葡萄糖苷(硫苷)、唑烷硫酮(OZT)、单宁、植酸降解率分别为 5.37、93.44、99.99、34.86、18.15%(干基)。
菜籽粕 固态发酵 抗营养因子 粗蛋白
菜籽粕是我国最丰富的植物源蛋白之一,其蛋白质和氨基酸含量丰富且组成合理,长期以来作为蛋白质饲料应用于畜禽日粮中,以减少大豆粕使用,降低饲料及饲养成本[1-3]。但是,菜籽粕中的单宁、植酸、硫代葡萄糖苷及其水解产物等抗营养因子的存在,极大地限制了其作为蛋白质资源在饲料工业中的应用[4-6]。因此,研究菜籽粕的微生物固态发酵可改善其蛋白营养价值,具有十分重要的社会和经济效益。
国内外关于菜籽粕发酵的研究已有诸多报道。Rozan等[7]使用少孢根霉发酵菜籽粕40 h后,总硫苷降解率为47%。蒋玉琴等[8]利用乳酸菌、酵母菌、少孢根霉菌复合菌系发酵菜籽粕32 h,硫苷降解率达71.6%。Chiou等[9]研究表明米曲霉菌能大幅度改善菜籽粕中纤维素的消化率。陆豫等[10]使用白地霉和米曲霉脱毒菜籽粕,水料比2∶1,29℃发酵47 h,硫苷去除率达到97%,取得了较好的效果。
但是,国内外的大部分菜籽粕微生物发酵菌种并不是我国农业部(2006)允许在饲料中使用的品种[11],而且近年来对菜籽粕发酵多数以硫苷脱毒和提高蛋白含量等方面为主要研究目标[12],而对小分子肽产量及产品中益生菌和生物酶活性报道不多,发酵工艺主要采用100℃以上高温灭菌,能耗消耗大。另外对微生物法降解菜籽粕中的植酸、单宁等抗营养因子的研究报道也较少[13]。本研究利用实验室保藏的优良发酵菌种,以普通菜籽粕为原料,研究单菌和混菌固态发酵对菜籽粕各抗营养因子含量以及菜籽粕蛋白和小肽含量的影响,从而改善菜籽粕的品质,使菜籽粕成为能替代豆粕、鱼粉的优质高效饲用蛋白,为合理利用菜籽粕饲料原料和开发蛋白质饲料资源提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验菌种
枯草芽孢杆菌(Bs1)、地衣芽孢杆菌(Bl1)、啤酒酵母(Sc1)、植物乳杆菌(Lp1)、黑曲霉(An1,作为对照菌种)、季也蒙毕赤酵母(Pg1,作为对照菌种),均为本实验室保藏菌种。
1.1.2 主要原料
菜籽粕:湖北武汉,含水量 8.83%,粗蛋白42.11%(干基),硫苷 3.69mg/g,植酸 1.15%,单宁1.20%;麸皮:市售,含水量 9.55%,粗蛋白 18.80%(干基);玉米粉:市售,含水量 13.70%,粗蛋白7.82%(干基)。原料粉碎过40目筛备用。
1.1.3 培养基
MRS斜面培养基:蛋白胨10 g、牛肉膏10 g、葡萄糖20 g、酵母浸膏5 g、K2HPO42 g、柠檬酸氢二铵2 g、无水乙酸钠 5 g、Tween80 1 mL、MgSO4·7H2O0.58 g、MnSO4·H2O 0.25 g,琼脂20 g,用蒸馏水定容至 1 L,pH 6.2~6.8(1 mol/L NaOH 调节),115 ℃湿热灭菌30 min。
牛肉膏蛋白胨斜面培养基:蛋白胨10 g,牛肉膏5 g,NaCl 5 g,琼脂 20 g,用蒸馏水定容至 1 L,pH 7.0,121 ℃灭菌 20 min。
YPD斜面培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g,用蒸馏水定容至 1 L,pH 7.0,115℃灭菌30 min。
PDA培养基:将马铃薯去皮切成小块,称取200 g置于1 000 mL烧杯中,加水煮沸约30 min,6~8层纱布滤成清液,滤液中加入葡萄糖20 g,补充水分至1 L,琼脂20 g,加热融化。增殖和种子培养基:为上述培养基去除琼脂。
发酵培养基:菜籽粕80%,麸皮10%,玉米粉10%,水料比1∶1,发酵 pH 自然。
1.2 试验方法
1.2.1 菌株制备
分别从保存的各菌种斜面挑取1环接种于各菌增殖培养基。植物乳酸菌接种到MRS培养基中,于38℃恒温培养箱中静置培养48 h;枯草芽孢杆菌和地衣芽孢杆菌接种到肉膏蛋白胨培养基中,于37℃、120 r/min恒温振荡培养箱中振荡培养48 h;啤酒酵母和季也蒙毕赤酵母接种到 YPD培养基中,于30℃、120 r/min恒温振荡培养箱振荡培养48 h;黑曲霉接种到PDA培养基中(加20粒玻璃珠),30℃,150 r/min振荡培养48 h。
1.2.2 发酵种子液的制备
从上述培养好的菌液中按2%的接种量接种到各菌发酵种子培养基,培养24 h,制成发酵种子液。
1.2.3 固态发酵
将菜籽粕、麸皮和玉米粉按8∶1∶1装入500 mL三角瓶中,搅拌均匀,水料比为1∶1,将发酵种子液以20%的接种量接入发酵培养基中,用无菌玻璃棒搅拌混匀,封口发酵。发酵结束后,将样品放入干燥箱中,50℃烘干后,粉碎过40目筛。
1.2.4 单菌发酵试验
按照1.2.3方法分别将枯草芽孢杆菌(Bs1)、地衣芽孢杆菌(Bl1)、啤酒酵母(Sc1)、植物乳杆菌(Lp1)、黑曲霉(An1)、季也蒙毕赤酵母(Pg1)进行单菌固态发酵,并置不同的环境温度下发酵3 d,设3个重复。
1.2.5 混菌发酵试验
将3种菌种选择双菌组合、三菌组合固态发酵,其接种量比分别为 1∶1 和 1∶1∶1,接种总量为 20%,置于30℃恒温培养箱静止发酵3 d,设3个重复。
1.2.6 发酵产品成分分析
按照确定的混菌发酵条件进行菜籽粕发酵试验,对发酵产品中的成分进行理化分析,并与未发酵的原料进行对比。测定指标主要包括:硫甙降解率、植酸降解率、单宁降解率、粗蛋白含量、小肽含量和主要酶的活性。
1.2.7 检测指标及方法
水分测定:GB/T 10358烘箱干燥法;粗蛋白测定:GB/T 6432—1994;真蛋白测定:三氯乙酸沉淀法;硫甙测定:硫脲紫外比色法;植酸测定:三氯化铁比色法;单宁测定:GB/T 15686—1995;蛋白酶酶活力测定:SB/T 10317—1999;活菌计数:平板稀释法;小肽测定:Tris-SDS聚丙烯凝胶电泳和高效液相色谱。
1.2.8 数据处理
所有数据用EXCEL预处理后采用SPSS13.0统计分析软件进行方差分析,试验结果用平均数±标准差表示。
2 结果与分析
2.1 蛋白酶活测定
蛋白酶活测定结果见图1。

图1 发酵液蛋白酶活
将以上6株菌的发酵液进行蛋白酶活的测定。如图1,不同菌株产蛋白酶有较大差异,其中,枯草芽孢杆菌明显具有较高的产蛋白酶活性;植物乳杆菌和地衣芽孢杆菌紧随其后;产蛋白酶活性最小的是黑曲霉。芽孢杆菌和乳酸菌是目前蛋白酶的主要生产菌。蛋白酶作用于蛋白质可将其分解为蛋白胨、多肽及游离氨基酸,使菜籽粕适口性更佳。
2.2 单菌株发酵试验
单菌株发酵试验结果见图2。

图2 单菌株发酵后硫苷、OZT、单宁、植酸降解率和粗蛋白提高率
由图 2 可以看出,菌种 Bs1、Bl1、Sc1、Lp1、An1和Pg1对硫苷、OZT和植酸都有一定的降解作用,但降解率相差很大(菌种不同);其中菌株Lp1的硫苷、OZT 和单宁降解率分别最高达 86.90、99.29、32.62%。可见,菌株Lp1产生了较多的降解硫苷和单宁的酶系,有效地降低了硫苷和单宁的含量。其次是菌株Bs1、Pg1和Sc1降解硫甙和OZT很高,而An1、Sc1和Bl1降解单宁较高。但6种菌株单独发酵后其植酸降解率相当,均在14%~15%左右。其中菌株Pg1提高粗蛋白率最高达6.08%,其次是An1、Sc1和Bs1。结合图1和图2,综合考虑菌种特性和生长情况,本试验选择Bs1、Sc1和Lp1进行混菌发酵,即枯草芽孢杆菌、啤酒酵母和植物乳杆菌,均为农业部公告(2006)允许使用的有益菌种[11]。
单菌发酵去除菜籽粕中硫甙效果不同主要原因在于各菌自身所分泌的酶系的不同。植物乳杆菌对硫苷的去除效果最好。植物乳杆菌对各种糖类有很强的利用能力,硫苷是一种葡萄糖的衍生物。从OZT的测定结果可以看出硫苷酶解产生的毒素随着微生物发酵而挥发或降解,并未在菜籽粕中堆积存留。
Kerovuo等[14]研究发现枯草芽孢杆菌能产生植酸酶,可以分解植酸,释放其中的磷,提高动物对磷的吸收利用。Ashok 等[15]、Kim 等[16]也报道相同的结果。另外也有研究报道乳酸杆菌也能够分泌植酸酶[17]。单宁对动物的毒害作用远低于硫甙等,不会直接引起动物中毒[18]。
2.3 混菌株发酵试验
2.3.1 双菌株发酵试验结果
双菌株发酵试验结果见图3。由图3可以看出,菜籽粕底物经双菌株混合发酵后,与单菌株相比其硫苷、单宁和植酸的降解率普遍提高,其中Bs1+Lp1组硫苷和 OZT降解率最高,分别达到 88.90、99.90%,Lp1+Sc1组单宁降解率最高,达到33.60%。这表明植物乳杆菌对硫苷、OZT和单宁的去除作用最大,这与单菌发酵结果相符。Bs1+Sc1组合植酸降解率最高,达到16.65%,说明酵母菌和芽孢杆菌混合后,可能产生互利协同作用,使植酸酶产量提高或活性增强,因而使植酸降解率得以提高。菜籽粕底物经双菌发酵后,与单菌发酵比其粗蛋白质提高率明显,Bs1+Sc1组合提高率最高达到4.34%。这给三菌混菌发酵提供依据。

图3 双菌株发酵后硫苷、OZT、单宁、植酸降解率和粗蛋白提高率
2.3.2 三菌株发酵试验结果
三菌株发酵试验结果见图4。由图4可以看出,三菌株发酵后,较双菌株发酵硫苷、OZT、单宁和植酸的降解率相比有较大提高,但其OZT的降解率最大,基本检测不出。而硫苷降解率、单宁降解率和植酸降解率分别高达 93.44、34.86、18.15%。三菌发酵产物的粗蛋白质含量达45.70%,比原菜籽粕底物的粗蛋白质含量提高了多5%。
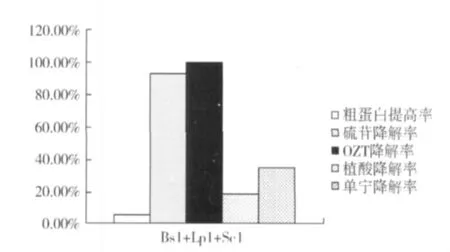
图4 三菌株发酵后硫苷、OZT、单宁、植酸降解率和粗蛋白提高率
以上研究可以看出混菌发酵比单菌发酵效果更具有优势,硫苷、OZT、单宁和植酸的去除率高于单菌发酵,混菌发酵脱毒效果较高在很大程度上依赖菌种间的互生共生的协同作用。同时混菌发酵粗蛋白的增加率也高于单菌发酵。本试验选用了酵母菌、芽孢杆菌和乳酸菌进行混菌发酵。酵母菌的菌体蛋白质量分数为50%~60%,可分泌多种水解酶类,AA构成合理,富含B族维生素,可以同化尿素、硫酸铵等非蛋白氮源,并能产生促进细胞分裂的生物活性物质,有强化营养和抗病促长的效果,可作为优质蛋白源。枯草芽孢杆菌蛋白含量也很高,可产生蛋白酶、淀粉酶、纤维素酶、脂肪酶等活性较高的酶,可以有效消除菜籽粕中的抗营养因子。此外,芽孢杆菌菌种具有不易致死的芽孢,饲喂时可以以活菌的状态进入动物的消化系统,进而抑制肠道中有害菌的生长繁殖。乳酸菌发酵经EMP途径产生乳酸、降低饲料pH,产生有机酸、细菌素、过氧化氢、双乙酰的功能天然抑菌物质,从而控制大多数腐败菌及致病菌的生长。利用酵母菌、枯草芽孢杆菌和乳酸菌混菌发酵菜籽粕,可产生大量的菌体蛋白,增加发酵产品的蛋白含量,提高饲料的适口性,改善饲料营养品质。
2.4 三菌发酵产品成分分析
比较未发酵原料与发酵产品的主要成分含量变化,并对菜籽粕发酵样品进行SDS-PAGE凝胶电泳。
2.4.1 三菌发酵产品的分析
结果如表1所示。由表1可见,原料发酵后,粗蛋白质量分数由42.11%上升到44.50%,粗蛋白增加率为5.37%。产品的真蛋白质量分数由38.62%上升到42.55%,真蛋白占粗蛋白的比率由91.71%上升到94.94%,真蛋白增加率为3.23%,即3%以上的真蛋白为发酵转化的菌体蛋白。另外,并对发酵样的中性蛋白酶进行测定,活力为125.82 U/g,由于枯草芽孢杆菌具有能产生蛋白酶、纤维素酶等特性,因此其对菜籽粕中小肽含量的改变达到了影响显著的作用,利用枯草芽孢杆菌发酵生产富含多肽的产品在国内也有相关的报道。

表1 发酵前后菜籽粕成分的变化(干基)
三株菌混合发酵后明显减弱了单菌、双菌发酵时产生的氨臭味,大大改善了发酵产物的可接受性和适口性。同时酵母发酵过程中能产生大量的菌体蛋白,不仅使发酵后活菌数大大增加,也具有提供养分,增强消化吸收和促进动物体免疫功能等功能,提高了发酵产物的功能和作用。
2.4.2 三菌发酵前后菜籽粕的 Tricine-SDSPAGE分析结果
为了研究经发酵后菜籽粕中蛋白质的变化,进行了发酵前后菜籽粕的Tricine-SDS-PAGE电泳分析,混合菌株对菜籽粕底物固态发酵产物的SDSPAGE结果列于图5。

图5 菜籽粕固态发酵前后的SDS-PAGE电泳图谱
从图5可以看出,普通粕经发酵后均有不同程度的降解。C的蛋白质主要集中在泳道中部,大约在5.8~44.3 ku 之间。D 在大约 5.8、7.8 和 20.1 ku处出现条带,高于20.1 ku的高分子肽链降解比较完全,同时,在普通粕中存在的多数10 ku左右的杂肽也都被降解,这表明采用发酵处理能将菜籽粕中的其他分子质量蛋白质降解成更低分子质量的蛋白。
3 结论
3.1 微生物发酵能够有效地提高菜籽粕中的粗蛋白质含量,降低抗营养因子水平,提高菜籽粕的营养水平。
3.2 多菌种组合发酵优于单一菌种发酵。试验表明,三菌株组合发酵后,菜籽粕的品质改善较优,其硫苷降解率、OZT降解率、单宁素降解率、植酸降解率分别为 93.44%、99.99%、34.86%、18.15%。
3.3 三菌发酵菜籽粕中蛋白质的变化,粗蛋白增加率为5.37%,真蛋白增加率为3.23%,水溶性蛋白增加率高达 105.80%,小肽含量较发酵前提高了96.90%。发酵菜籽粕基本上被降解到分子质量为20 ku以下。
[1]潘雷,李爱科,程茂基,等.菜籽饼粕脱毒方法研究进展[J].中国油脂,2009,34(10):32 -35
[2]孙东升,王永刚.中国油籽和植物油产业现状及其国际竞争力研究[J].农业展望,2006,2(9):3 -8
[3]席鹏彬,马永喜,李德发,等.中国菜籽饼粕化学组成特点及其影响因素的研究[J].中国畜牧杂志,2004,40(10):12-15
[4]孙智达.菜籽饼中多酚类物质的脱除及蛋白质提取与分离研究[J].华中农业大学学报,1999,18(4):394-396
[5]陈彩.菜籽饼的开发利用综述[J].饲料工业,1990(2):25-28
[6]李爱科.我国主要饼粕类饲料资源开发及利用技术[C]//动物营养研究进展论文集,北京:中国农业科技出版社,2004:285-289
[7]Rozan F,Villaume C,Bau H M.Detoxication of rapeseed meal by rhizopusoligosorus sp-t3-a first steptowards rapeseed protein concentrate[J].International journal of food science& technology,1996,3l(1):85 -90
[8]蒋玉琴,李荣林,邵明诚,等.复合菌脱毒菜籽饼粕及其应用研究I不同处理条件下复合菌体系发酵对菜籽饼粕硫甙的降解[J].江苏农业学报,1999,5(2):104 -106
[9]Chiou P W S,Chen C,Yu B.Effects of aspergillus oryzae fermentation extract on in situ degradation of feedstuffs[J].Asian - Australasian Journal of Animal Sciences,2000,13(8):1076-1083
[10]陆豫,余勃.发酵菜籽粕脱毒工艺优化研究[J].食品科学,2007,28(10):267 -271
[11]中国饲料工业协会.中国饲料工业年鉴2006/2007:饲料添加剂品种目录(2006)[M].北京:中国商业出版社,2008
[12]Franke K,Meyer U,Wagner H,et al.Influence of various iodine supplementation levels and two differernt iodine species on the iodine content of the milk of cow s fed rapeseed meal or distillers dried grains with solubles as the protein source[J].Dairy Sci,2009,92:4514 - 4523
[13]孙林,李吕木,张邦辉,等.多菌种固态发酵去除菜籽粕中的植酸[J].中国油脂,2008,33(8):60 -63
[14]Kerovuo J,Lauraeus M,Nurminen P,et a1.Isolation,characterization,molecular gene cloning,and sequencing of a novel phytase from Bacillus subtilis[J].Applied and Environmental Microbiology,1998,64(6):2079 -2085
[15]Ashok P,George S,Carlos R,et a1.Production,purification and properties of microbial phytases[J].Bioresource Technology,2001,77(3):203 - 214
[16]Kim Y O,Kim H K,Bae K S,et a1.Purification and properties of a thermostable phytase from bacillus sp.DS11[J].Enzyme and Microbial Technology,1998,22:2 -7
[17]万琦,陆兆新,吕凤霞,等.枯草芽孢杆菌生产大豆多肽溶液的加工功能特性研究[J].食品科学,2003,24(11):99-102
[18]Kerovuo J,Tynkkynen S.Expression of bacillus subtilis phytase in lactobacillus plantarum 755[J].Letters in Applied Microbiology,2000,30(4):325 -329.
Study on the Nutritional Character of Rapeseed Meal by Microbial Solid State Fermentation
Hu Yongna1,2Li Aike1Wang Zhisheng2Zhang Xiaolin1Liu Guoming1Han Wei1
(Academy of State Administration of Grain1,Beijing 100037)
(Institute of Animal Nutrition,Sichuan Agricultural University2,Ya'an 625014)
In order to improve the quality of rapeseed meal,common rapeseed were used as raw materials and Bacillus subtilis,Bacillus licheniformis,Lactobacillus plantarum,Saccharomyces cerevisiae,Pichia guilliermondii and several species of Aspergillus niger were selected to study the fermentation of rapeseed meal protein and anti-nutritional factors content,by a single and mixed culture solid state fermentation.The results showed that the activity of Bacillus protease was higher than other strains;the result of mixed culture solid state fermentation was better than single culture solid state fermentation;the fermentation of the combination of Bacillus subtilis,Lactobacillus plantarum and Saccharomyces cerevisiae could improve the quality of protein.Then the increase rate of crude protein and glucosinolate,OZT,tannin,phytic acid degradation rates were respectively 5.37,93.44,99.99,34.86 and 18.15%(dry basis).
rapeseed meal,state fermentation,anti- nutritional factors,crude protein
S816.43
A
1003-0174(2012)03-0076-05
国家科技支撑计划(2006BAD12B04)
2011-07-04
胡永娜,女,1985年出生,硕士,动物营养与饲料科学
李爱科,男,1963年出生,研究员,博士,动物营养与饲料资源开发

