转Bt基因水稻种子中Bt蛋白含量测定方法的研究
陈笑芸 汪小福 周 育 缪青梅 方 敬 徐俊锋
(浙江省农业科学院农产品质量标准研究所,杭州 310021)
转Bt基因水稻种子中Bt蛋白含量测定方法的研究
陈笑芸 汪小福 周 育 缪青梅 方 敬 徐俊锋
(浙江省农业科学院农产品质量标准研究所,杭州 310021)
采用ELISA技术检测转Bt基因水稻中Bt蛋白的含量,判断水稻样品中是否含有转基因成分。利用研磨、酶标、孵育等技术对样品进行前处理。采用阳性质控物浓度等倍稀释方法,建立标准曲线,相关系数为0.997 4。用一系列不同转基因含量的标准基体材料,分析方法的最低检测限,灵敏度达0.1%。通过对我国进入生产性试验的转Bt基因水稻品系TT51-1和科丰6号的测试,表明该方法与普通PCR方法真实性和灵敏度一致,可以广泛应用于转Bt基因水稻及其粗加工产品的转基因成分检测。为转基因生物安全监管和安全性评价提供技术支撑。
Bt蛋白 转基因水稻 快速检测 灵敏度
水稻作为世界主要粮食作物,也是虫害最多的粮食作物之一。2009年底,转基因抗虫水稻华恢1号和转cry1Ab/cry1Ac基因抗虫水稻Bt汕优63在湖北省生产应用的安全证书。随着转基因水稻将从小型试验逐渐走向大规模种植,给转基因生物安全监管、追溯提出了更高的要求[1],快速、精准检测技术体系的建立是安全监管的有效途径之一。
目前,转基因生物检测技术主要分为两大类[2-5],一类是基于蛋白质检测的蛋白检测技术,另一类是基于核酸检测的检测技术。其中ELISA检测方法是比较理想的方法。因为在ELISA检测中将抗原与抗体反应的特异性与酶对底物的高效催化作用结合起来,从而使测定方法达到快速、简便、准确、敏感度高等特点。并且ELISA检测既可根据颜色反应的深浅做出定性分析,也可通过酶标仪读数结合标准曲线进行定量分析。陈松等[6]对转Bt基因棉花建立了双抗夹心ELISA定量检测方法,徐宝粱等[7]用试剂盒对转基因棉子壳中Bt蛋白含量的较系统试验,建立了转基因Bt棉花蛋白检测技术。而快速、稳定、标准化的转Bt基因水稻蛋白检测方法研究较少。本研究应用检测试剂盒,以不同转Bt基因水稻品系为研究材料,采用ELISA方法检测水稻中Bt蛋白含量,以期建立快速、灵敏、有效的转基因水稻蛋白检测体系。
1 材料和方法
1.1 材料
转基因抗虫水稻品系TT51-1、科丰6号:农业部科技发展中心;非转基因水稻品种明恢63、明恢86:浙江省农业科学院;灵敏度检测所用标准试样:将经鉴定为转基因的水稻品系与非转基因水稻混合,实验室自制。
Bt-Cry1Ab/1Ac ELISA试剂盒:美国dgdia公司。Model 680酶标仪、1575洗板机:BIO-RAD公司。
1.2 方法
1.2.1 样品前处理
称取磨碎的100 mg样品,以1∶10的比例加入样品提取液,混均后静置5 min,吸取上清液加入到微孔中。加酶标记物,室温孵育2 h,洗板(重复6-7次),加入 3,3',5,5'- 四甲基联苯胺(TMB)底物溶液,15 min后,用3 mol/L的硫酸溶液终止反应,用酶标仪测定OD450处的吸光值。
1.2.2 测试对照设置
为避免试验污染而造成蛋白测试结果出现假阳性或假阴性,进行ELISA检测时必须设置阳性对照、阴性对照和空白对照。阳性对照用阳性材料前处理后作为底物。阴性对照用阴性材料前处理后作为底物。空白对照用ddH2O作为底物。
1.2.3 定量检测标准曲线
将阳性质控物按 20、10、5 、2.5、1.25、0.625、0.315 ng/mL进行稀释,以阳性质控物中Bt蛋白浓度为横坐标,扣除空白对照值OD450为纵坐标,进行回归分析,建立标准曲线。
1.2.4 定量检测极限(LOD)
用一系列不同转基因含量(5%、1%、0.5%、0.1%、0.05%和 0.01%)的标准基体材料,经前处理后作为ELISA反应底物。经过至少3次重复后,确定可以稳定检测样品的最低转基因含量。
2 结果与分析
2.1 ELISA检测体系阳性质控物标准曲线建立
阳性质控物稀释处理后的测定结果见表1。以阳性质控物中Bt蛋白浓度为横坐标,扣除空白对照OD450值为纵坐标,进行回归分析,获得标准曲线 y=0.052 6x+0.011 3(见图1),相关系数为:R2=0.997 4,具有很好的相关性,表明此检测体系可用于Bt蛋白含量测定,Bt蛋白含量的计算公式为:ρ=(θ-0.011 3)÷0.052 6

表1 标准曲线测定数据

图1 阳性质控物标准曲线
2.2 转Bt基因水稻Bt蛋白的线性范围
提取转Bt基因水稻TT51-1纯系中的Bt蛋白,并将提取液做2倍梯度稀释。稀释倍数、不同稀释倍数下Bt蛋白浓度及扣除空白后的吸收值见表2。

表2 TT51-1和科丰6号纯系转Bt水稻各梯度吸光度
2.2.1 转Bt基因水稻TT51-1纯系Bt蛋白的线性
TT51-1纯系提取液 OD450为0.946,代入标准曲线方程,得Bt浓度为18.683 ng/mL。以不同稀释倍数下Bt蛋白浓度为横坐标,以吸光度为纵坐标(扣除空白对照),进行回归分析。结果发现,从16倍稀释开始Bt蛋白浓度与吸光度成线性关系,回归方程 y=0.354 0x -0.008 6,相关系数为 0.998 4,具有很好的相关性。16倍稀释时,Bt蛋白质量浓度为1.168 ng/mL,256 倍稀释时,Bt蛋白浓度为 0.070 ng/mL,因此,此检测体系测定TT51-1 Bt蛋白的线性范围为 0.070 ~1.168 ng/mL。
2.2.2 转Bt基因水稻科丰6号纯系Bt蛋白的线性
科丰6号纯系提取液 OD450为1.004,代入标准曲线方程,得Bt浓度为18.870 ng/mL。以不同稀释倍数下Bt蛋白浓度为横坐标,以吸光度为纵坐标(扣除空白对照),进行回归分析。结果发现,从16倍稀释开始Bt蛋白浓度与吸光度成线性关系,回归方程 y=0.300 3x+0.001 7,相关系数为 0.990 7,具有很好的相关性。16倍稀释时,Bt蛋白浓度为1.150 ng/mL,256 倍稀释时,Bt蛋白浓度为 0.036 ng/mL,因此,此检测体系测定科丰6号Bt蛋白的的线性范围为0.036 ~1.150 ng/mL。
2.3 转Bt基因水稻种子中Bt蛋白含量测定
用试剂盒测定了TT51-1、科丰6号、明恢63和明恢86纯系的 OD450。扣除空白对照,代入 y=0.052 6x+0.011 3,得到转 Bt基因水稻纯系 TT51 -1的Bt蛋白含量为18.683 ng/mL;转Bt基因水稻科丰6号的Bt蛋白含量为18.870 ng/mL;明恢63和明恢86吸光度均为负值,表明未检测到Bt蛋白。
2.4 ELISA检测体系检测水稻中Bt蛋白含量的检测极限(LOD)
按质量分数配置混样,TT51-1质量分数为5%、1%、0.5%、0.1%、0.05%、0.01%样品的吸光值分别为 0.197、0.050、0.018、0.090、0.000 和 -0.004(表3)。以质量分数为横坐标,吸光度为纵坐标进行回归分析,回归方程为 y=3.856 9x+0.004 9,R2=0.996 4,在0.1%~5%范围内,其质量分数与吸光度呈现很好的相关性。科丰6号5%、1%、0.5%、0.1%、0.05%、0.01% 样品的吸光值分别为 0.250、0.089、0.037、0.008、-0.003、-0.005,以质量分数为横坐标,吸光度为纵坐标进行回归分析,回归方程为 y=4.957 2x+0.003,R2=0.996 3,在0.1%~5%,其质量分数与吸光度呈现很好的相关性。此ELISA检测体系的检测极限可达0.1%,可满足转基因生物安全检测监管需求。
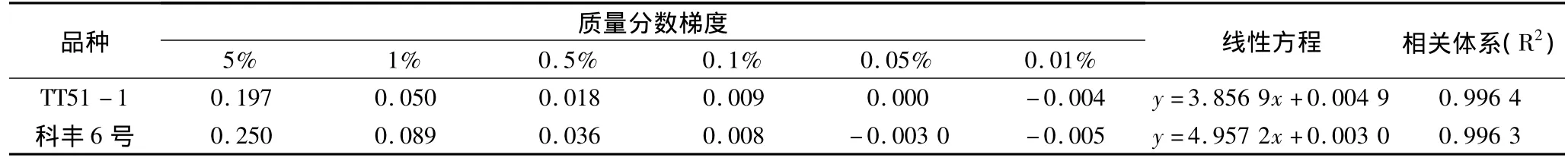
表3 TT51-1和科丰6号各质量分数吸光度和线性方程
3 讨论
3.1 转Bt基因水稻种子蛋白检测体系及检测极限
本试验利用Bt-Cry1Ab/1Ac ELISA试剂盒对不同浓度梯度的转Bt基因水稻进行了较为全面的研究,优化了反应条件,所得标准曲线y=0.052 6x+0.011 3,相关系数 R2=0.997 4,建立了稳定、快速的Bt蛋白检测体系。转Bt水稻TT51-1和科丰6号中的Bt蛋白的线性范围分别为0.070~1.168 ng/mL和0.036 ~1.150 ng/mL。其检测灵敏度达到了 0.1%。除准备样品的时间外,测试过程所需时间约为2.5 h,比其他检测蛋白方法更为省时。该体系的建立,对于大规模的检测水稻种子中是否含有Bt基因成分提供了很好的标准化检测方法和规范的检测程序,为转基因生物安全监管提供了技术平台。
3.2 转Bt基因水稻蛋白检测体系的应用
目前转基因产品检测监管是基于核酸的PCR检测方法体系,无论是定性PCR方法,还是定量PCR方法,由于建立在DNA水平上的PCR方法的组成体系复杂,参数较多,整个过程耗时比较长且对操作人员要求比较高[10-11]。而此蛋白检测体系操作简单,且快速、稳定,对大规模筛选检测监管极为有利。
本试验用ELISA方法和普通PCR方法同时测定了不同转基因质量分数(5%、1%、0.5%、0.1%、0.05%和0.01%)的标准基体材料,真实性和灵敏度完全一致,且本方法检测效率明显高于普通PCR方法。本试验方法针对检测样品亦有不足之处,只能对原材料或粗加工产品进行快速检测,而不适合用于一些深加工品或成分复杂的产品。这些产品中,蛋白质性质往往发生改变,不能被抗体有效识别[12-14]。
4 结论
本研究采用ELISA技术检测转Bt基因水稻中Bt蛋白的含量,判断水稻样品中是否含有转基因成分,建立了快速稳定的转Bt基因水稻蛋白定性定量检测方法。该方法制作的阳性质控物标准曲线相关系数为0.997 4,检测灵敏度达0.1%。该方法与普通PCR方法检测结果一致,且效率明显提高,可以广泛地应用到转Bt基因水稻及其粗加工产品的转基因成分检测。
[1]李飞武,徐世艳,宋贵文,等.浅谈我国转基因作物安全监控需求与策略[J].农业科技管理,2010,29(2):27 -29
[2]张大兵,郭金超.转基因生物及其产品检测技术和标准化[J].生命科学,2011,23(2):195 -204
[3]Brodmann P D,Iig E C,Berthoud H,et al.Real- time quantitative polymerase chain reaction methods for four genetically modified maize varieties and maize DNA content in food[J].Journal of AOAC INTERNATIONAL,2002,85(3):646 -653
[4]王保民,何钟佩,田晓莉.苏云金芽孢杆菌杀虫晶体蛋白Cry1A单克隆抗体的制备及在转Bt基因棉毒蛋白检测上的应用[J].棉花学报,2000,12(1):34 -39
[5]McKenzie M J,Jameson P E,Jameson P E.Modified ELISA for the detection of neomycin phosphotransferase II in transformed plant species[J],Plant Cell Reports,2000,9:286 -289
[6]CHEN S,WU J Y,CHEN D R,el al.On the Enzyme linked Immunosorbent Assay of Bacillus thuringiensis Insecticidal Protein Expressed in Transgenic Cotton [J],Acta Gossypii Sinica,1999,11(5):259 -267
[7]徐宝粱,苏宁,陈颖,等.转基因棉子壳中Bt蛋白含量测定方法研究[J],中国棉花,2004,31(2):12 -14
[8]陈颖,李强,李玲,等.抗虫转基因欧洲黑杨的western印迹法分析[J],林业科学,1996,32(3):274 -276
[9]Rogan G J,Dudin Y A,Lee T C,et al.Immunodiagnostic methods for detection of 5-enolpyruvylshikimate-3-phosphate synthase in Roundup Ready soybeans[J],Food control,1999,10:407 -414
[10]Nan Zhang,Wentao Xu,Weibin Bai,et al.Event- specific qualitative and quantitative PCR detection of LY038 maize in mixed samples[J],Food Control,2011,22(8):1287 -1295
[11]Takashi Kodama,Masaki Kasahara,Yasutaka Minegishi,et al.Qualitative PCR Method for Roundup Ready®Soybean:Interlaboratory Study [J],Journal of AOAC INTERNATIONAL,2011,94(1):224 -231
[12]Fantozzi A,Ermolli M,Marini M,et al.Frist application of a microsphere-based immunoassay to the detection of genetically modified organisms(GMOs):quantification of Cry1Ab protein in genetically modified maize[J].Journal of Agricultural and Food Chemistry,2007,55(4):1071 -1076
[13]Shim YY,Shin WS,Moon GS,et al.Quantitative analysis of phosphinothricin-N-acethltransferase in enetically modifies herbicide tolerant pepper by an enzyme-linked immunosorbent assay [J].Journal of Microbiology and Biotechnology,2007,17(4):681 -684
[14]Holst- Jensen A.Testing for genetically modified organisms(GMO):Past,present and future perspectives[J].Biotechnology Advances,2009,27(6):1071 -1082.
Protein Content in Bt-Gene Rice Seed
Chen Xiaoyun Wang Xiaofu Zhou Yu Miao QingmeiFang Jing Xu Junfeng
(Institute of Quality Standards for Agricultural Products,Zhejiang Academy of Agricultural Science,Hangzhou 310021)
In this study,the enzyme-linked immunosorbent assay(ELISA)has been develpoed for the detection of Bt protein content in transgenic Bt rice to evaluate the presence of genetically modified ingredients in rice samples.The sample pre - treatment step involved in grinding,enzymatic labeling reaction and incubation process.The standard curve was constructed by dilution of the the positive control material with the same dilution factor,and the correlation coefficient is 0.997 4.A range of different standards containing of genetically modified ingredients were used to analyze the limit of detection method.The results showed the detection sensitivity is up to 0.1%.Through testing the transgenic Bt rice strain TT51 -1 and Kefeng 6 which are putting into the production test in China,the ELISA method developed demonstrated consistency with ordinary PCR methods in both authenticity and sensitivity aspects.Therefore,this ELISA method could be widely applied to detect genetically modified ingredients in transgenic Bt rice or raw commodities,providng technical support for the safety regulation and evalution of genetically modified organisms.
Bt protein,transgenic rice,rapid detection,sensitivity
Q788
A
1003-0174(2012)03-0121-04
浙江省重大科技专项(2008C12074)
2011-06-10
陈笑芸,女,1977年出生,助理研究员,转基因检测
徐俊锋,男,1977年出生,副研究员,转基因与生物安全

